2. 吉林省农业科学院 农业资源与环境研究所, 吉林 长春 130033
2. Institute of Agricultural Resources and Environment, Jilin Academy of Agricultural Sciences, Changchun 130033, China
土壤盐渍化是世界性的环境和农业灾害,全世界大约有8亿多hm2土地遭受不同程度的盐胁迫伤害.在盐胁迫下,植物的种子萌发[1]、生长发育[2-3]及光合能力[4-5]均受到不同程度的影响.盐胁迫对植物的伤害可分为快速的渗透胁迫和缓慢的离子毒害[6].渗透胁迫主要体现为环境中的盐浓度过高,水分难以进入植物体内,造成植物生理干旱;而离子毒害则是由于Na+和Cl-在叶片中大量积累造成的.氮肥是作物生产中增产作用最大的养分,对作物的许多生理过程、抗逆性和其他营养元素的利用均有重要的调节作用[7].Palfi[8]研究表明,盐胁迫下水稻对N的吸收降低.许多学者对氮素营养提高水稻耐盐性做过研究,刘开力等[9]研究表明盐胁迫下对水稻幼苗施加低浓度外源NO可以提高幼苗根组织的抗氧化能力,黄本开等[10]认为外源NO可以缓解水稻幼苗膜质过氧化作用.Abdelgadir等[11]在3个盐浓度和3个供氮水平下对水稻进行研究,结果表明增加NO3-能够减少水稻体内Cl-的含量.关于不同供氮水平培养的水稻植株在盐胁迫后生理特性变化鲜见报道.本文选择2个北方常规粳稻品种为材料,研究在不同供氮水平下盐胁迫对水稻光合特性及生理特性的影响,探讨盐胁迫下水稻的最佳施氮量,为提高水稻耐盐性提供理论依据.
1 材料与方法 1.1 材料北方常规粳稻品种:九稻13号和吉粳88号,生育期均在142 d左右,为中晚熟品种.其中,九稻13号为耐盐品种,吉粳88号为盐敏感品种.以上2个品种是通过对吉林省156个水稻品种采用NaCl浓度为80 mmol·L-1的改良IRRI Yoshida(1976)营养液在种子萌发期和幼苗期筛选获得的.
1.2 试验设计试验在植物生长室进行,每天光照11 h;昼夜温度分别为(22±0.5)和(17±0.5) ℃,湿度为(60±5)%.发芽阶段施用蒸馏水在培养皿中进行培养,成苗后(株高超过10 cm)用脱脂棉固定幼苗根部将幼苗插入打孔的黑色塑料泡沫板中,移栽至直径为30 cm、高为35 cm的桶中,移栽后植株间距为2.5 cm,每桶15株,同时分别施以改良IRRI Yoshida(1976)营养液正常含氮量的1/4、1/2、1、2和4倍的营养液进行培养(分别记为1/4N、1/2N、1N、2N、4N,其中,1/4N、1/2N为低氮,2N、4N为高氮),pH为5.1±0.2,7 d更换1次营养液,并调节营养液的pH.水稻移栽后于孕穗初期进行盐胁迫处理,即在每个氮水平营养液中分别加入不同量的NaCl [c(NaCl)分别为40、80、120 mmol·L-1,分别表示低盐、中盐、高盐],每个品种16个处理,其中,对照(CK)为不含盐的正常改良IRRI Yoshida(1976)营养液,7 d更换1次营养液,并调节营养液的pH至5.1±0.2,每个处理设3次重复,处理15 d后在孕穗中期开始进行器官生物量、光合特性、膜透性、丙二醛、抗氧化酶活性和渗透性调节物质的测定,每个指标测3次.
1.3 各项指标的测定方法 1.3.1 生物量的测定随机选取3株植株进行生物量的测定,先分别测定地上部分和根系的鲜质量,然后将鲜样在105 ℃的烘箱中杀青15 min,于80 ℃烘干48 h后,用分析天平分别称地上部和根系的干质量.然后将干物质粉碎,用于可溶性糖、脯氨酸含量的测定.
1.3.2 光合特性指标的测定用Li-6400型便携式光合测定系统(Li-cor公司)测定,测定时采用光量子密度为1 200 μmol·m-2·s-1的固定红蓝光源,为避免测定时环境CO2浓度的变化对测定结果的干扰,将仪器的进气口与装有恒定CO2浓度的钢瓶相接,钢瓶CO2浓度调节成(495±5) μmol·mol-1.测定水稻剑叶的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci).测定时间为09:00—11:00.
气孔限制值(Ls)按下式计算:
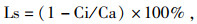
|
式中, Ci为胞间CO2浓度,Ca为环境CO2浓度;
表观叶肉导度(AMC)是通过净光合速率与胞间CO2浓度的比值(Pn/Ci)来计算的,用于估测非气孔限制作用,即RuBP羧化酶的活性.
1.3.3 生理指标的测定膜透性、丙二醛含量和抗氧化酶活性均采用张治安等[12]的方法进行测定. SOD活性以抑制NBT光化学还原的50%为1个酶活性单位,CAT活性以1 min内D240 nm减少0.1的酶量为1个酶活性单位,POD活性以1 min内D470 nm减少0.01的酶量为1个酶活性单位,均记为“U”.脯氨酸采用磺基水杨酸法[13]进行测定.可溶性糖采用蒽酮比色法[14]进行测定.
1.4 数据分析文中所有数据均为3次重复的平均值,数据的处理采用Excel 2003和DPS数据处理系统进行.
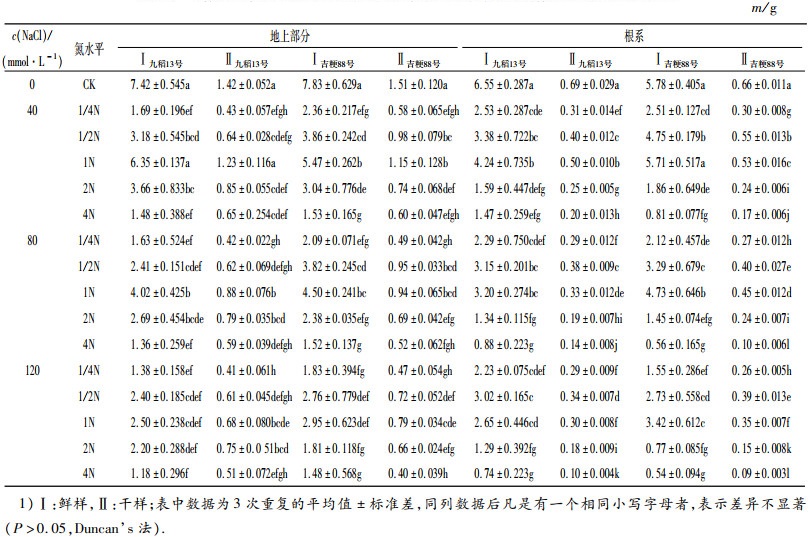
2 结果与分析 2.1 不同供氮水平下盐胁迫对水稻植株生物量的影响从表 1中可以看出,盐胁迫下,水稻植株地上部分和根系的鲜质量与干质量显著下降,随着盐浓度的提高,下降幅度越显著.随着氮浓度的升高,植株地上部分和根系鲜质量与干质量均呈先增加后下降的变化趋势,与对照相比,3个盐浓度下植株生物量均表现为1N水平培养的下降最小.
|
|
表 1 不同供氮水平下盐胁迫对水稻生物量的影响1) Table 1 Effects of salt stress on biomass of rice varieties at different nitrogen levels |
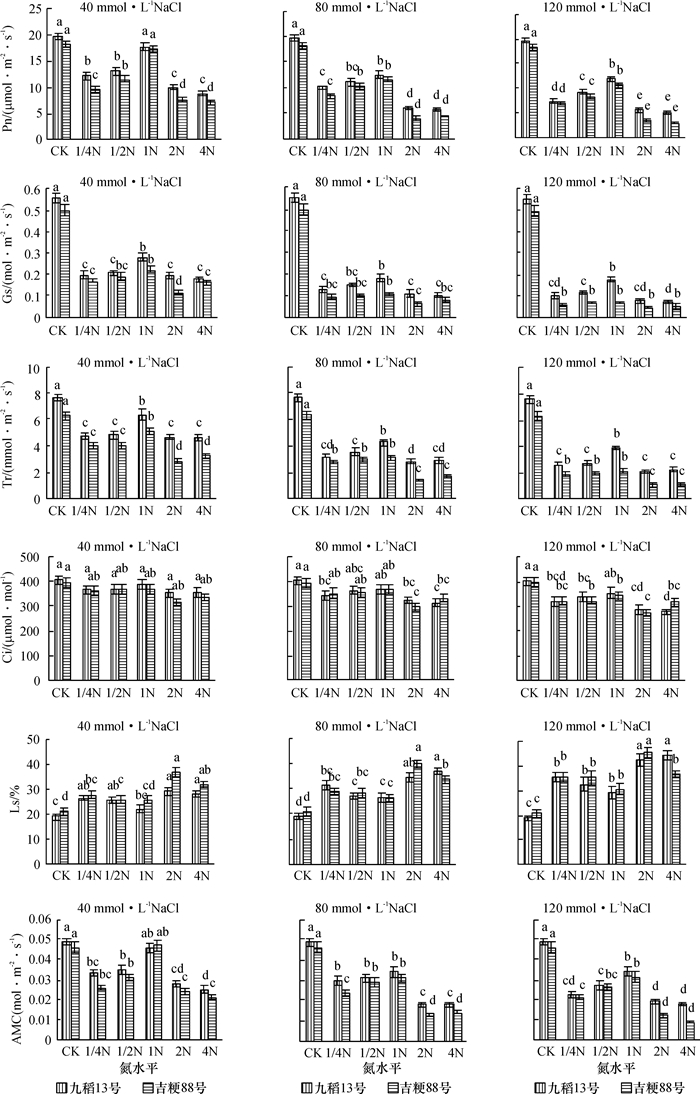
由图 1可以看出,与对照相比,盐胁迫下水稻叶片净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)和表观叶肉导度(AMC)均呈下降趋势;随着氮浓度的增加,水稻叶片Pn、Gs、Tr和AMC均呈先增加后下降的变化趋势,与对照相比,高氮水平培养的水稻植株叶片光合特性指标的下降幅度显著高于低氮水平.低盐胁迫后,水稻叶片胞间CO2浓度(Ci)在5个氮水平下均变化不大,气孔限制值(Ls)在低氮和1N水平下变化不大,在高氮水平下略有升高;中盐胁迫后,低氮和1N水平下Ci变化不大,高氮水平下Ci显著下降,Ls在5个氮水平下均显著升高;高盐胁迫后,Ci在5个氮水平下均显著下降,且Ls均显著升高.由此推测低氮水平培养的水稻植株在盐胁迫后净光合速率下降的原因是由非气孔限制因素引起的,而高氮水平下其在盐胁迫后净光合速率下降的原因还增加了气孔限制因素.从图 1还可以看出,不同处理下,九稻13号的Pn、Gs和Tr均高于吉粳88号.
|
图 1 不同供氮水平下盐胁迫对水稻叶片光合特性的影响 Figure 1 Effects of salt stress on photosynthesis traits of rice leaves at different nitrogen levels 各图中相同柱子上凡是有一个相同小写字母者,表示差异不显著(P > 0.05, Duncan’s法). |
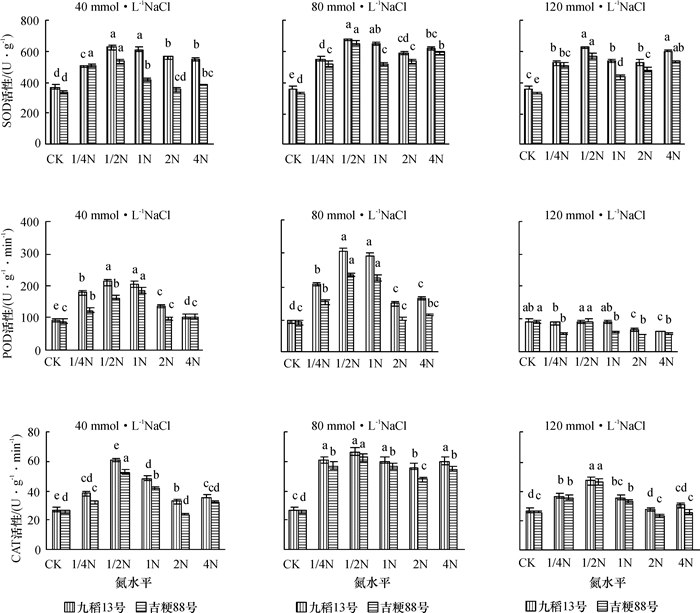
从图 2可以看出,随着盐浓度的增加,水稻叶片中SOD、POD和CAT活性呈先增加后下降的变化趋势,说明低盐胁迫可诱导水稻叶片提高SOD、POD和CAT活性.过高的盐浓度超过了水稻自身的忍耐程度,导致SOD、POD、CAT活性下降.1/2N水平培养的水稻植株在盐胁迫后体内抗氧化酶活性最强.不同处理下,九稻13号叶片中抗氧化酶活性均高于吉粳88号,说明在盐胁迫下,耐盐水稻品种比盐敏感水稻品种能保持更高的抗氧化酶活性以抵御盐害.
|
图 2 不同供氮水平下盐胁迫对水稻叶片抗氧化酶活性的影响 Figure 2 Effects of salt stress on antioxidant enzyme activities in rice leaves at different nitrogen levels 各图中相同柱子上凡是有一个相同小写字母者,表示差异不显著(P > 0.05, Duncan’s法). |
由图 3可知,在盐胁迫下,叶片及根系中的渗透性调节物质可溶性糖和脯氨酸大量积累,九稻13号的可溶性糖和脯氨酸含量均高于吉粳88号.随着盐浓度的增加,可溶性糖和脯氨酸含量先增加后减少,说明盐胁迫后水稻体内迅速积累渗透性调节物质来抵御盐害,而盐浓度过高时,水稻已无法产生足够的渗透性调节物质来抵御盐害.盐胁迫后,水稻体内可溶性糖和脯氨酸含量随着供氮浓度的增加,均呈先增加后下降的变化趋势,其中以1/2N水平培养下含量最高.说明1/2N水平培养的水稻体内能积累更多的可溶性糖和脯氨酸来抵御盐害.
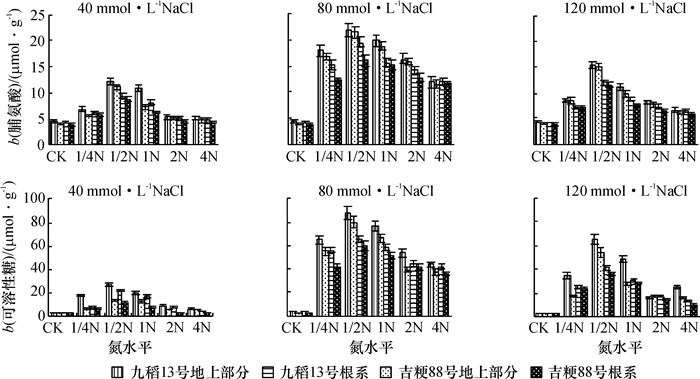
|
图 3 不同供氮水平下盐胁迫对水稻叶片及根系渗透性调节物质的影响 Figure 3 Effects of salt stress on physiological traits in rice leaves and roots at different nitrogen levels |
从图 4可以看出,水稻在盐胁迫下丙二醛含量增加,膜透性也显著增加,且盐浓度越大,增加幅度越明显,九稻13号的丙二醛含量和膜透性均低于吉粳88号.与对照相比,1/2N水平培养的水稻叶片中,丙二醛含量和膜透性增加幅度最小,说明1/2N水平的处理可以降低盐胁迫对水稻叶片细胞质膜的伤害.
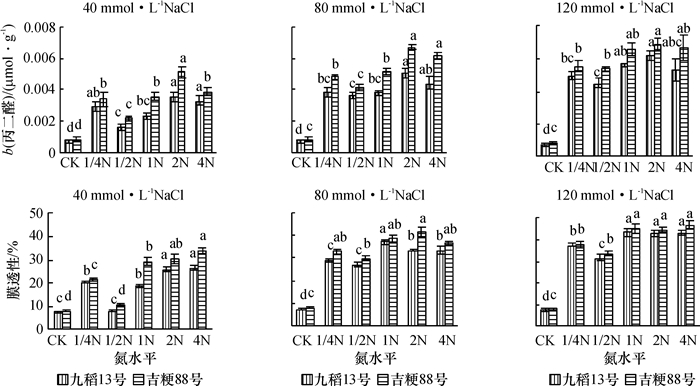
|
图 4 不同供氮水平下盐胁迫对水稻叶片质膜透性的影响 Figure 4 Effects of salt stress on plasma membrane permeability in rice leaves at different nitrogen levels 各图中相同柱子上凡是有一个相同小写字母者,表示差异不显著(P > 0.05, Duncan’s法). |
水稻对盐害的抵御能力与环境间存在复杂的互作关系,温度、水分、光照、肥料等条件以及添加外源物质都会不同程度地影响水稻的耐盐性[15-16].朱晓军等[17]研究表明,盐胁迫下,外源Ca2+能有效改善水稻的光合作用,使净光合速率和气孔导度增加.氮肥管理是作物养分管理中的核心内容,杜洪艳[18]认为盐胁迫下水稻幼苗对不同氮形态的养分利用具有差异性,NH4+-N高于NO3--N时对水稻生长较有利,过高的NO3--N则不利于水稻生长;Herralde等[19]认为,适量的氮肥有助于补偿因盐胁迫造成的离子失衡.本研究结果表明,1/2N水平培养的水稻叶片抗氧化酶活性以及脯氨酸、可溶性糖含量均高于其他供氮水平,同时膜透性和丙二醛含量也低于其他供氮水平,因此,1/2N水平营养液培养的水稻可以增强抗氧化酶活性和生成更多的渗透性调节物质来抵御盐害,从而增强其在孕穗期的抗盐能力.
盐胁迫可通过限制植物的光合作用进而影响其产量.一般认为,盐胁迫导致植物光合速率降低的原因包括气孔限制因素和非气孔限制因素[20-21].许多研究表明,盐胁迫下植物气孔发生非均匀性关闭,导致光合速率下降[5, 22].孙璐等[23]认为,NaCl胁迫下高粱幼苗光合作用下降的原因在NaCl浓度为50 mmol·L-1时是气孔限制因素,100~200 mmol·L-1时是非气孔限制因素.本研究结果则表明,低盐胁迫后,5个供氮水平培养的水稻叶片Ci均变化不大,Ls在低氮和1N水平下变化不大,在高氮水平下略有升高;中盐胁迫后,Ci在低氮和1N水平下变化不大,高氮水平下显著升高,Ls显著升高;高浓度盐胁迫后,5个氮水平处理下Ci均显著下降,且Ls显著升高;由此推测低氮水平培养的水稻植株在盐胁迫后净光合速率下降的原因是由非气孔限制因素引起的,而高氮水平下其在盐胁迫后净光合速率下降的原因还增加了气孔限制因素.同时AMC显著下降,进一步推测,盐胁迫导致水稻体内RuBP羧化酶活性下降,而这是导致净光合速率下降的非气孔限制因素,这与前人[24-26]的研究结果基本一致.
本研究结果表明,低氮水平培养的水稻植株在盐胁迫后净光合速率下降的原因是由非气孔限制因素引起的,而高氮水平下在非气孔限制因素的基础上,还增加了气孔限制因素.用1/2N水平的营养液培养水稻可以提高水稻的渗透调节能力,从而增强其在孕穗期的抗盐能力.盐胁迫下,耐盐品种体内能保持较高的Pn、Gs、Tr、抗氧化酶活性以及脯氨酸和可溶性糖含量,这也是耐盐品种比盐敏感品种更能适应盐胁迫环境的生理优势.
| [1] |
KOYRO H W, EISA S S. Effect of salinity on composition, viability and germination of seeds of Chenopodium quinoa Willd[J]. Plant Soil, 2008, 302(1/2): 79-90. (  0) 0) |
| [2] |
KOCA H, BOR M, ÖZDEMIR F, et al. The effect of salt stress on lipid peroxidation, antioxidative enzymes and proline content of sesame cultivars[J]. Environ Exp Botany, 2007, 60(3): 344-351. DOI:10.1016/j.envexpbot.2006.12.005 (  0) 0) |
| [3] |
梁正伟, 杨福, 王志春, 等. 盐碱胁迫对水稻主要生育性状的影响[J]. 生态环境, 2004, 13(1): 43-46. DOI:10.3969/j.issn.1674-5906.2004.01.014 (  0) 0) |
| [4] |
SOUSSI M, OCANA A, LLUCH C. Effects of salt stress on growth, photosynthesis and nitrogen fixation in chick-pea(Cicer arietinum L.)[J]. J Exp Botany, 1998, 49(325): 1329-1337. DOI:10.1093/jxb/49.325.1329 (  0) 0) |
| [5] |
王仁雷, 华春, 刘友良. 盐胁迫对水稻光合特性的影响[J]. 南京农业大学学报, 2002, 25(4): 11-14. (  0) 0) |
| [6] |
SILVA E C, NOGUEIRA R J M C, ARAUJO F P, et al. Physiological responses to salt stress in young umbu plants[J]. Environ Exp Botany, 2008, 63(1/2/3): 147-157. (  0) 0) |
| [7] |
GAMETT T, CONN V, KAISER B. Root based approaches to improving nitrogen use efficiency in plants[J]. Plant, Cell and Environ, 2009, 32(9): 1272-1283. DOI:10.1111/pce.2009.32.issue-9 (  0) 0) |
| [8] |
PALFI G. A correlation between nitrogen nutrition of rice and asparagines concentration in leaves[J]. Növenyter-méles, 1963, 12: 157-168. (  0) 0) |
| [9] |
刘开力, 韩航如, 徐颖洁, 等. 外源一氧化氮对盐胁迫下水稻根部脂质过氧化的缓解作用[J]. 中国水稻科学, 2005, 19(4): 333-337. DOI:10.3321/j.issn:1001-7216.2005.04.009 (  0) 0) |
| [10] |
黄本开, 刘开力, 徐晟, 等. 一氧化氮供体对盐胁迫下水稻幼苗叶片脂质过氧化的调节[J]. 南京农业大学学报, 2005, 28(3): 22-25. (  0) 0) |
| [11] |
ABDELGADIR E M, OKA M, FUJIYAMA H. Nitrogen nutrition of rice plants under salinity[J]. Biol Plantarum, 2005, 49(1): 99-104. DOI:10.1007/s10535-005-0104-8 (  0) 0) |
| [12] |
张治安, 陈展宇. 植物生理学实验技术[M]. 长春: 吉林大学出版社, 2008.
(  0) 0) |
| [13] |
张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸的方法[J]. 植物生理学通讯, 1990(4): 62-65. (  0) 0) |
| [14] |
石连旋, 胡勇军, 宫亮, 等. 不同盐碱化草甸羊草越冬根茎中可溶性糖和蛋白的研究[J]. 东北师范大学学报:自然科学版, 2008, 40(2): 88-92. (  0) 0) |
| [15] |
王建飞, 陈宏友, 杨庆利, 等. 盐胁迫浓度和胁迫时的温度对水稻耐盐性的影响[J]. 中国水稻科学, 2004, 18(5): 449-454. DOI:10.3321/j.issn:1001-7216.2004.05.013 (  0) 0) |
| [16] |
董海凤, 王义霞, 孙运杰. 水稻盐胁迫的研究进展[J]. 生物灾害科学, 2012, 35(4): 439-442. DOI:10.3969/j.issn.2095-3704.2012.04.024 (  0) 0) |
| [17] |
朱晓军, 杨劲松, 梁永超, 等. 盐胁迫下钙对水稻幼苗光合作用及相关生理特性的影响[J]. 中国农业科学, 2004, 37(10): 1497-1503. DOI:10.3321/j.issn:0578-1752.2004.10.016 (  0) 0) |
| [18] |
杜红艳. NaCl胁迫和氮形态对水稻幼苗生长的影响[D]. 扬州: 扬州大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-11117-2008087158.htm
(  0) 0) |
| [19] |
HERRALDE F D, BIEL C, SAVE R, et al. Effect of water and salt stresses on the growth, gas exchange and water relations in Argyranthemum coronopifolium plants[J]. Plant Sci, 1998, 139: 9-17. DOI:10.1016/S0168-9452(98)00174-5 (  0) 0) |
| [20] |
BERRY J A, DOWNTON W J S. Environmental regulation of photosynthesis[M]//GOVIND J. Photosynthesis : VolⅡ. New York: Academic Press, 1982: 263-345.
(  0) 0) |
| [21] |
葛江丽, 石雷, 谷卫彬, 等. 盐胁迫条件下甜高粱幼苗的光合特性及光系统Ⅱ功能调节[J]. 作物学报, 2007, 33(8): 1272-1278. DOI:10.3321/j.issn:0496-3490.2007.08.009 (  0) 0) |
| [22] |
BETHKE P C, DREW M C. Stomatal and nonstomatal components to inhibition of photosynthesis in leaves of Capsicum annuum during progressive exposure to NaCl salinity[J]. Plant Physiol, 1992, 99: 219-226. DOI:10.1104/pp.99.1.219 (  0) 0) |
| [23] |
孙璐, 周宇飞, 李丰先, 等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响[J]. 中国农业科学, 2012, 45(16): 3265-3272. DOI:10.3864/j.issn.0578-1752.2012.16.005 (  0) 0) |
| [24] |
武志海, 赵国臣, 徐克章, 等. 吉林省过去47年来水稻品种遗传改良过程中叶片光合指标的变化[J]. 中国水稻科学, 2009, 23(2): 165-171. DOI:10.3969/j.issn.1001-7216.2009.02.009 (  0) 0) |
| [25] |
徐晨, 凌凤楼, 徐克章, 等. 盐胁迫对不同水稻品种光合特性和生理生化特性的影响[J]. 中国水稻科学, 2013, 27(3): 280-286. DOI:10.3969/j.issn.1001-7216.2013.03.008 (  0) 0) |
| [26] |
曹树青, 翟虎渠, 钮中一, 等. 不同产量潜力水稻品种的剑叶光合特性研究[J]. 南京农业大学学报, 2000, 23(3): 1-4. (  0) 0) |
 2015, Vol. 36
2015, Vol. 36