丹毒丝菌Erysipelothrix rhusiopathiae属于丹毒丝菌属, 是一种兼性厌氧、无芽孢、不产酸的纤小革兰阳性杆菌[1], 是引起猪丹毒和人类丹毒症的病原体[2].该菌能够在各种环境中长期存在(包括海中) [3], 并且能够感染各种野生动物和家畜、鸟类和鱼类[4-8], 从而引发疾病(鱼除外), 该病在全球广泛存在, 呈散发或流行性发生, 特别是能够引起猪的急性热性败血症、亚急性疹块、慢性关节炎和心内膜炎, 给养猪业造成了巨大的损失[9].目前国内猪丹毒病仍时有发生[10-14], 虽然感染阳性率不高, 但是猪丹毒的阳性检出率却比较高[15], 因此猪丹毒的隐性感染值得关注.目前, 常用防治猪丹毒的方法还是传统疫苗, 虽然此类疫苗在一定程度上起到了相应的作用, 但对慢性猪丹毒的作用效果并不强, 而且还在很大程度上增加了猪慢性关节炎的发病率[16-17], 因此研究一种新型猪丹毒疫苗迫在眉睫.
近年来国内外学者对猪丹毒免疫保护性蛋白(rSpa)进行了大量的研究, 为猪丹毒的诊断和防治提供了科学的理论依据.其中表面保护抗原A (SpaA)由N端的免疫保护性区域和C端的细胞结合区域组成, 大量研究表明其具有良好的免疫保护功能[8, 18-20].而SpaA蛋白中起主要免疫保护效应的核心区段为氨基端(SpaA-N), 其免疫保护作用受到国内外学者的广泛关注, 并进行了大量的试验研究[21-25].研究者们利用原核表达技术成功地克隆出Spa-N片段基因序列, 并且研究了其免疫功能[23, 25].
本试验成功地扩增了Spa-N基因序列, 并利用酵母表达系统对其进行表达, 为Spa-N作为一种亚单位疫苗投入生产时的高产量、生长快速、易操作和低成本提供了理论依据.
1 材料与方法 1.1 材料 1.1.1 菌株和载体猪丹毒菌分离自广东某猪场, pPICZαC为Invitrogen公司产品, 大肠埃希菌Escherichia coli DH5α为TaKaRa公司产品, 毕赤酵母Pichia pastoris X-33由华南农业大学兽医学院传染病教研室保存.
1.1.2 试剂与酶类质粒提取试剂盒、胶回收试剂盒、纯化试剂盒等为Omega公司产品; 各限制性内切酶、T4连接酶、DNA聚合酶、DNA Marker等为TaKaRa公司产品; PCR引物合成及测序由Invitrogen公司完成; 博莱霉素、D-生物素、酵母氮碱等为Sigma公司产品; 培养基成分如蛋白胨、酵母提取物、葡萄糖、培养基以及SDS-PAGE试验所需试剂、HRP标记的羊抗鼠IgG等均为北京鼎国生物技术公司产品; 其他试剂均为国产分析纯.
1.1.3 培养基LB液体培养基: 10 g胰蛋白胨, 5 g酵母提取物, 10 g NaCl, 双蒸水定容至1 L.固体LB培养基:在液体LB培养基基础上加1.5%琼脂粉.血清琼脂培养基:在普通LB培养基的配方基础上, 双蒸水定容至90 mL后混匀高压, 待冷却至一定温度时加入10%的兔血清.YPD培养基:酵母提取物10 g, 胰蛋白胨20 g, 溶于900 mL双蒸水中, 高压灭菌20 min, 再加入100 mL已过滤0.2 g·mL-1的D-葡萄糖.YPDS培养基:酵母提取物10 g, 胰蛋白胨20 g, 山梨醇182.2 g, 双蒸水定容至900 mL, 高压20 min后加入100 mL已灭菌的0.2 g·mL-1的D-葡萄糖.BMGY培养基:酵母提取物10 g、胰蛋白胨20 g溶于700 mL双蒸水中, 高压灭菌后冷却至室温, 分别加入100 mL已除菌的1 mol · L-1磷酸缓冲液(pH6.0)、134 g·L-1酵母氮碱、体积分数为10%的丙三醇及20 mg·L-1的生物素2 mL.BMMY培养基:酵母提取物10 g, 胰蛋白胨20 g, 溶于700 mL双蒸水中, 高压灭菌后冷却至室温, 分别加入100 mL已除菌的1 mol·L-1磷酸缓冲液(pH6.0)、134 g·L-1酵母氮碱、体积分数为10%的甲醇10 mL及20 mg·L-1的生物素2 mL.
1.2 重组毕赤酵母表达载体的建立 1.2.1 引物的设计与合成根据NCBI上SpaA序列, 登录号: AB259654.1, 运用Primer premier 5.0软件设计1对特异性引物用于扩增SpaA-N.上游引物P1加入Xho Ⅰ酶切位点; 下游引物P2加入Xba Ⅰ酶切位点和终止密码子.本试验预采用毕赤酵母表达载体的α因子信号肽, 由于质粒pPICZαC双酶切中会丢失KEX2蛋白酶的酶切位点Lys-Arg, 因此在设计上游引物的时候, 还加入了编码Lys-Arg的密码子AAAAGA.引物由Invitrogen公司合成.引物序列:上游引物P1, 5′- CCCTCGAGAAAAGAGGGTACCAAAGTTTCGAAGC-3′; 下游引物P2, 5′-GC TCTAGATTAGATCTTTAGGTTTTTCTTCATCAA-3′.
1.2.2 丹毒丝菌SpaA-N的PCR扩增利用煮-冻煮法裂解猪丹毒丝菌的细胞壁, 进行菌落PCR.PCR反应体系: Ex 10 × PCR Buffer 2 μL, 2.5 mmol dNTP Mixture 2 μL, 引物P1、P2各0.5 μL, Ex Taq DNA聚合酶0.125 μL, ddH2O 17.375 μL, 模板2 μL.反应条件: 94 ℃预变性5 min; 94 ℃变性30 s, 54 ℃退火30 s, 72 ℃延伸70 s, 30个循环; 72 ℃终延伸10 min.经8 g·L-1琼脂糖凝胶电泳分析产物后, 利用DNA回收试剂盒进行纯化回收.
1.2.3 重组表达载体的构建对胶回收后的回收产物Spa-N和表达载体pPICZαC同时进行Xho Ⅰ和Xba Ⅰ双酶切, 并利用DNA胶回收试剂盒进行纯化回收.将酶切回收后的目的基因与表达载体连接后转化大肠埃希菌DH5α感受态细胞, 将最后一步的重悬液均匀涂布于含ZencinTM(25 μg·mL-1)的低盐LB固体培养基上, 放入37 ℃培养箱中培养12 ~ 16 h.
1.2.4 重组表达质粒的鉴定PCR鉴定:挑选低盐LB平板上的可疑菌落于含ZencinTM (100 μg·mL-1)LB液体培养基中37 ℃震荡培养8 h, 做菌液PCR鉴定.PCR体系与反应条件同“1.2.2”.
单酶切和双酶切鉴定:按照相应体系, 利用酶Xho Ⅰ与Xba Ⅰ进行双酶切鉴定, 用酶Xba Ⅰ进行单酶切鉴定.
1.3 SpaA-N基因在毕赤酵母中的表达 1.3.1 毕赤酵母X-33感受态细胞的制备参照Invitrogen EasySelect Pichia Expression kit介绍的方法进行制备.
1.3.2 重组质粒pPICZαC-SpaA-N的电击转化根据Invitrogen公司实验手册进行.先利用Sac Ⅰ单酶切重组质粒pPICZαC-SpaA-N, 使之线性化, 同时对空质粒pPICZαC也进行同酶同系线性化, 反应体系(50 μL): 10 × Buffer 5 μL, pPICZαC-SpaA-N 30 μL, Sac Ⅰ 3 μL, ddH2O 12 μL.将75 μL新制备的感受态酵母细胞与25 μL线性化的重组质粒轻轻混匀后转入预冷的电转杯中冰浴5 min.设定电转参数305 V, 进行15 ms电转后立即加入1 mL预冷的1 mol·L-1山梨醇, 混匀后转入5 mL离心管, 30 ℃条件下静置1 ~ 2 h, 再加入YPD液体培养基1 mL, 30 ℃震荡培养1 h.4 000 r·min-1收集菌体, 用50 ~ 200 μL YPD重悬菌体后铺于新鲜制备的YPDS平板(含ZencinTM 100 μg·mL-1)上, 将平板倒置于30 ℃培养箱中培养3 ~ 5 d.
1.3.3 重组酵母菌菌液PCR鉴定及高拷贝转化子的筛选挑取单菌落于1 mL YPDS培养基中(含ZencinTM200 μg·mL-1)扩菌培养, 采用煮-冻-煮法制备PCR模板分析毕赤酵母转化子, 以P1、P2为引物扩增出1 029 bp的片段为阳性转化子.PCR体系与反应条件同“1.2.2”.再经不同浓度ZencinTM的YPDS平板筛选高拷贝克隆工程菌, 用于高效诱导表达SpaA-N蛋白.
1.3.4 抗血清的制备购买8只体质量都在15 g左右的SPF雌鼠.培养猪丹毒菌, 用平板计数法进行计数, 并用生理盐水将其稀释至10 LD50 (1.1 × 102 cfu), 加入体积分数为0.1%的甲醛进行灭菌处理, 划板验证为无菌后进行下一步试验.将铝胶佐剂与经过灭菌处理的猪丹毒菌液按照体积比1: 5的比例进行混合, 第1次免疫时每只小鼠腹腔注射100 μL混合液, 14 d后进行第2次免疫, 第2次免疫10 d后进行第3次免疫, 3次注射剂量均相同, 在第3次免疫10 d后进行摘眼取血.采集的血液先置37 ℃条件下凝固约2 h, 然后置4 ℃条件下过夜, 使血块收缩, 第2天5 000 r·min-1离心5 min, 收集血清, 于-80 ℃条件保存备用.
1.3.5 高拷贝酵母工程菌的诱导表达和SDS-PAGE挑取阳性单克隆转化子, 接种至BMGY中, 28 ℃摇至D600 nm为2 ~ 6, 用BMMY重悬细胞至D600nm为1.0进行诱导表达, 每24 h加甲醇至甲醛终体积分数为1%以继续诱导.分别在48、72、96 h时离心收集上清液, 立即做SDS-PAGE或-20 ℃条件保存备用, 并做SDS-PAGE及Western-blot分析.
1.3.6 免疫及动物保护试验将16只体质量为18 ~ 20 g的昆明小鼠随机分为2组, 每组8只.将生理盐水、经过毕赤酵母表达的SpaA-N蛋白分别与铝胶佐剂以体积比5 : 1进行混合, 每只小鼠腹腔注射混合液100 μL进行第1次免疫, 分别命名为组1、组2, 其中组1为空白对照组.第1次免疫14 d后进行第2次免疫, 各组的免疫剂量与方法同第1次免疫.分别对第2次免疫14 d后的2组免疫小鼠进行腹腔注射攻毒, 攻毒剂量为100 LD50(1.1 × 103 cfu), 连续观察10 d, 记录各组小鼠死亡数, 计算各免疫组的保护率.
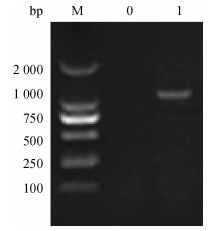
2 结果 2.1 Spa-N基因的合成以菌液为模板, P1、P2为引物, 进行PCR扩增, 经10 g·L-1琼脂糖凝胶电泳可观察到有单一条带, 与实际条带1 029 bp相符(图 1).
|
图 1 Spa-N基因PCR扩增 Figure 1 PCR amplification of Spa-N gene M: DNA marker DL2000; 0:阴性对照; 1: Spa-N基因. |
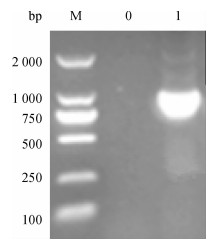
从转化后培养的低盐LB平板上挑取疑似阳性的单菌落, 接种于含ZencinTM 25 μg·mL-1的LB液体培养基中, 37 ℃条件下震荡过夜, 直接以菌液为模板进行PCR鉴定, 以P1、P2为引物, 扩增产物经10 g·L-1琼脂糖凝胶电泳, 可观察到大小约为1 029 bp的单一条带(图 2), 而阴性对照无任何条带.结果表明猪丹毒SpaA-N已成功插入表达载体中.
|
图 2 重组质粒pPICZαC-SpaA-N的PCR鉴定 Figure 2 Identification of recombinant plasmid pPICZαC-SpaA-N by PCR M: DNA marker DL2000; 0:阴性对照; 1:重组质粒pPICZαC-SpaA-N. |
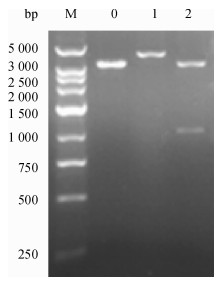
以抽提的质粒分别在20 μL体系中做Xho Ⅰ单酶切鉴定及Xba Ⅰ和Xho Ⅰ的双酶切鉴定, 并且以不加酶的重组表达质粒作阴性对照, 于37 ℃恒温水浴过夜后, 以1 g·L-1的琼脂糖凝胶电泳检测结果.单酶切出现1条4.6 kb左右条带, 与实际相符; 双酶切出现2条带, 其中1条大小约为1 029 bp, 与外源目的基因大小1 029 bp相符(图 3).
|
图 3 重组质粒pPICZαC-SpaA-N的酶切鉴定 Figure 3 Identification of recombinant plasmid pPICZαC-SpaA-N by restriction endonucleases digestion M: 250 bp DNA ladder marker; 0:未酶切的pPICZαC-SpaA-N质粒; 1: pPICZαC-SpaA-N质粒Xho Ⅰ单酶切产物; 2: pPICZαC-SpaA-N质粒Xba Ⅰ和Xho Ⅰ双酶切产物. |
将经过PCR和酶切鉴定的阳性重组表达质粒, 送Invitrogen公司, 用载体引物(即通用引物)对重组质粒pPICZαC-SpaA-N进行测序.结果显示, 目的片段与NCBI已发表的Spa-N序列的相似性高达99%.
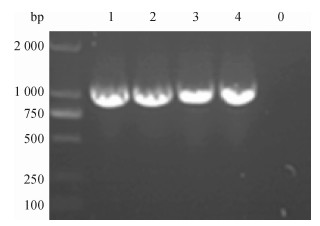
2.5 重组酵母菌液PCR鉴定挑取电转的阳性菌落于1 mL的YPDS液体培养基中(含ZencinTM100 μg·mL-1), 30 ℃条件下180 r·min-1振荡培养, 取少量菌液进行PCR鉴定.同时取空载体pPICZαC/X-33转化的重组酵母菌作阴性对照, 电泳检测.结果显示:重组质粒转化的重组酵母菌液可以扩增出大小约为1 029 bp的特异条带, 而空质粒转化的酵母菌液在1 029 bp处无条带(图 4).
|
图 4 重组酵母菌液PCR鉴定 Figure 4 Identification of recombinant yeast by PCR M: DNA marker DL2000; 0:空质粒转化酵母PCR扩增产物; 1 ~ 4:重组质粒/X-33的PCR扩增产物. |
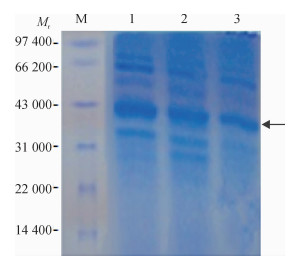
高拷贝重组酵母工程菌株经甲醇诱导表达, 分别于诱导48、72、96 h后经10 000 r·min-1离心收集酵母上清液后进行SDS-PAGE(12%分离胶和5%浓缩胶)表达分析, 考马斯亮蓝染色鉴定.结果显示, 相对分子质量约为40 000的Spa-N蛋白得以表达(图 5), 表明猪丹毒Spa-N蛋白在酵母X-33中成功表达.
|
图 5 Spa-N表达产物的SDS-PAGE分析 Figure 5 SDS-PAGE analyses of expression products of Spa-N gene M:低相对分子质量蛋白质Marker; 1: SpaA-N诱导96 h后上清液; 2: SpaA-N诱导72 h后上清液; 3: SpaA-N诱导48 h后上清液. |
表达蛋白的Western-blot免疫印迹检测结果显示, 抗天然SpaA蛋白抗体(抗血清)和通过酵母表达的SpaA-N蛋白发生了特异性反应, 说明SpaA-N蛋白在毕赤酵母中得到成功的表达(图 6).

|
图 6 SpaA-N表达产物的Western-blot分析 Figure 6 Immunoreactivies of expression products of SpaA-N gene by Western-blot M:蛋白质相对分子质量Marker; 1:诱导96 h后上清液. |
组1的生理盐水对照组小鼠在攻毒后表现出一些不适的症状:食欲下降、毛发起皱及精神沉郁等, 第5天开始死亡, 到第8天全部死亡.而组2的SpaAN蛋白试验组在攻毒的前2 d有一些不适症状, 但到后期这些不适症状消失, 没有出现死亡情况.试验结果表明试验所表达的SpaA-N蛋白具有免疫保护性.
3 讨论现在世界各地猪丹毒仍频繁爆发[26], 给世界各国的养猪业造成了巨大的经济损失.目前常用活菌疫苗、灭活疫苗及联苗等来预防和控制该病的发生和传播, 但是接种活菌苗有可能使免疫动物变成带菌者和细菌的传播者, 从而使得慢性病例逐渐增加; 灭活疫苗的培养液本身是异体蛋白, 易使接种动物发生过敏反应.而亚单位疫苗具有安全性高、产量高、稳定性好等优点, 克服了活菌疫苗的毒力返强和灭活对猪只引起过敏反应等缺点.
近几年来, 相继出现了一些对猪丹毒杆菌的分子生物学和免疫学的研究, Makino等[18]克隆和表达了猪丹毒丝菌表面保护性抗原SpaA, 发现SpaA的N端342个氨基酸残基组成的多肽承担了该蛋白的免疫保护功能.前人对猪丹毒杆菌SpaA的氨基酸进行原核表达和重组疫苗的研究结果表明, SpaA-N蛋白具有良好的免疫保护作用[21-25].但现如今的研究都是基于原核表达系统上, 其表达的目的产物常以包涵体形式存在, 无翻译后的修饰加工过程[27], 包涵体复性困难且效率很低.而本试验采用的毕赤酵母表达系统与其他表达系统相比, 有着不可比拟的优势, 其既有原核生物繁殖快、易于培养、培养基廉价和试验过程简单可行等特点, 又具有强有力的启动子, 还可以对外源蛋白进行加工折叠和翻译后修饰[28]等真核生物表达体系的特点, 而且巴斯德毕赤酵母还是一种能高效表达外源蛋白的表达系统, 具有遗传稳定、表达水平高、蛋白可翻译后加工、产物可分泌、可高密度发酵等许多优点[29].
本研究成功克隆并表达了猪丹毒丝菌C43065 SpaA的N端免疫保护片段, 测序结果分析发现其与NCBI上已登录的不同血清型菌株的SpaA基因的核苷酸序列的相似性高达99%, 说明该基因具有很高的保守性.SDS-PAGE及Western-blot结果表明其具有免疫反应性, 因此, 本研究为猪丹毒新型亚单位疫苗的研制和大规模生产奠定了基础.
致谢:感谢兽医学院传染病教研室的老师和同学给予的支持和帮助!
| [1] |
BROOKE C J, RILEY T V. Erysipelothrix rhusiopathiae: Bacteriology, epidemiology and clinical manifestations of an occupational pathogen[J]. J Med Microbiol, 1999, 48(9): 789-799. DOI:10.1099/00222615-48-9-789 (  0) 0) |
| [2] |
BOO T W, HONE R, HURLEY J. Erysipelothrix rhusiopathiae endocarditis: A preventable zoonosis[J]. Ir J Med Sci, 2003, 172(2): 81-82. DOI:10.1007/BF02915253 (  0) 0) |
| [3] |
SITT T, BOWEN L, MYRA T, et al. Cellular immune responses in cetaceans immunized with a porcine erysipelas vaccine[J]. Vet Immunol Immunopathol, 2010, 137(3/4): 181-189. (  0) 0) |
| [4] |
GARTRELL B D, ALLEY M R, MACK H, et al. Erysipelas in the critically endangered kakapo (Strigops habroptilus)[J]. Avian Pathol, 2005, 34(5): 383-387. DOI:10.1080/03079450500268583 (  0) 0) |
| [5] |
HASSANEIN R, SAWADA T, KATAOKA Y, et al. Serovars of Erysipelothrix species isolated from the tonsils of healthy cattle in Japan[J]. Vet Microbiol, 2001, 82(1): 97-100. DOI:10.1016/S0378-1135(01)00379-0 (  0) 0) |
| [6] |
BOERNER L, NEVIS K R, HINCKLEY L S, et al. Erysipelothrix septicemia in a little blue penguin (Eudyptula minor)[J]. J Vet Diagn Invest, 2004, 16(2): 145-149. DOI:10.1177/104063870401600209 (  0) 0) |
| [7] |
HOLTIFIELD J L, COOPER G L, CHARLTON B R. An outbreak of erysipelas in 2-day-old poultry[J]. Avian Pathol, 2000, 44(33): 721-724. (  0) 0) |
| [8] |
CHEUN H I, KAWAMOTO K, HIRAMATSU M, et al. Protective immunity of SpaA-antigen producing lactococcus lactis against Erysipelothrix rhusiopathiae intfection[J]. J Appl Microbiol, 2004, 96(6): 1347-1353. DOI:10.1111/jam.2004.96.issue-6 (  0) 0) |
| [9] |
HASSANEIN R, SAWADA T, KATAOKA Y, et al. Pathogenicity for mice and swine of Erysipelothrix isolates from the tonsils of healthy cattle[J]. Vet Microbiol, 2003, 91(2/3): 231-238. (  0) 0) |
| [10] |
朱凤琼, 陈达燕, 夏英杰, 等. 猪丹毒杆菌的分离及鉴定[J]. 现代农业科技, 2012(4): 316-317. DOI:10.3969/j.issn.1007-5739.2012.04.200 (  0) 0) |
| [11] |
邱美珍, 杜丽飞, 杨爱梅, 等. 猪丹毒杆菌临床分离鉴定与药敏试验[J]. 养猪, 2011(6): 111-112. DOI:10.3969/j.issn.1002-1957.2011.06.065 (  0) 0) |
| [12] |
郭良兴, 陈克研, 赵魁, 等. 猪丹毒杆菌的分离鉴定及耐药性试验[J]. 中国畜牧兽医, 2011, 38(4): 199-202. (  0) 0) |
| [13] |
车勇良, 陈如敬, 王隆柏, 等. 猪丹毒杆菌的分离鉴定及其SpaA基因的遗传变异分析[J]. 中国兽医学报, 2011, 31(11): 1591-1593. (  0) 0) |
| [14] |
万莉, 韩国全, 郭万柱, 等. 猪丹毒疫苗研究进展[J]. 猪业科学, 2010(6): 32-35. DOI:10.3969/j.issn.1673-5358.2010.06.008 (  0) 0) |
| [15] |
周绪斌, 丹尼, 李聪, 等. 猪丹毒---古老的传染病是否从中国规模化猪场消失了[J]. 农业新技术, 2009(5): 22-24. (  0) 0) |
| [16] |
FREDDY H, FRANK P, KOEN C, et al. Efficacy of vaccines against bacterial diseases in swine: What can we expect[J]. Vet Microbiol, 2004, 100(3/4): 255-268. (  0) 0) |
| [17] |
SILVA A J, HORTA A C, IEMMA M, et al. Production of potential subunit vaccine against swine erysipelas in fedbatch cultures of E.coli BL21(DE3)[J]. New Biotechnol, 2009, 255(6): 187-188. (  0) 0) |
| [18] |
MAKINO S, YAMAMOTO K, MURAKAMI S, et al. Properties of repeat domain found in a novel protective antigen, SpaA, of Erysipelothrix rhusiopathiae[J]. Microb Pathog, 1998, 25(2): 101-109. DOI:10.1006/mpat.1998.0216 (  0) 0) |
| [19] |
IMADA Y, GOJI N, ISHIKAWA H, et al. Truncated surface protective antigen (SpaA) of Erysipelothrix rhusiopathiae serotypes 1a and 2b in pigs[J]. Infect Immun, 1999, 67(9): 4376-4382. (  0) 0) |
| [20] |
ALAINA L I, JAMES A R, PAUL J H. Erysipelothrix rhusiopathiae: Association of Spa-type with serotype and role in protective immunity[J]. Vaccine, 2010, 28(13): 2490-2496. DOI:10.1016/j.vaccine.2010.01.041 (  0) 0) |
| [21] |
曹文尧. 丹毒丝菌表面保护抗原A作为重组亚单位疫苗和核酸疫苗的初步研究[D]. 乌鲁木齐: 新疆大学, 2007.
(  0) 0) |
| [22] |
谭侃侃. 丹毒丝菌的分离鉴定及其SpaA-N蛋白和lipo蛋白的免疫原性分析[D]. 长沙: 湖南农业大学, 2011.
(  0) 0) |
| [23] |
吾鲁木汗·那孜尔别克, 张磊, 何翠, 等. 猪丹毒丝菌天然SpaA和重组SpaA-N免疫保护效果的评价[J]. 微生物学报, 2010, 50(3): 367-372. (  0) 0) |
| [24] |
李伟杰, 赵耘, 康凯, 等. 红斑丹毒丝菌SpaA抗原基因的克隆、序列分析及蛋白结构预测[J]. 中国兽医学报, 2011, 31(11): 1591-1594. (  0) 0) |
| [25] |
DA A J, SILVA M R, IEMMA A C, et al. Cloning, autoinduction expression, and purification of rSpaA swine erysipelas antigen[J]. Curr Microbiol, 2012, 65(4): 369374. (  0) 0) |
| [26] |
OPRIESSNIG T L, HOFFMAN J, HARRIS D L, et al. Erysipelothrix rhusiopathiae: Genetic charact erization of Midwest US isolates and live commercial vaccines using pulsed field gel electrophoresis[J]. J Vet Diagn Invest, 2004, 16(2): 101-107. DOI:10.1177/104063870401600202 (  0) 0) |
| [27] |
JIN F L, XU X X, YU X Q, et al. High-level expression of active recombinant ubiquitin carboxyl terminal hydrolase of drosophila melanogaster in Pichia pastoris[J]. Protein Expr Purif, 2009, 65(2): 115-121. DOI:10.1016/j.pep.2008.08.010 (  0) 0) |
| [28] |
杨梅, 温真, 林丽玉. 毕赤酵母蛋白表达系统研究进展[J]. 生物技术通报, 2011(4): 46-51. (  0) 0) |
| [29] |
DALY R, HEARN M T W. Expression of heterologous proteins in Pichia pastoris: A useful experimental tool in protein engineering and production[J]. J Mol Recognit, 2005, 18(2): 119-138. DOI:10.1002/(ISSN)1099-1352 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36


