2. 华南农业大学 热带亚热带生态研究所,广东 广州 510642;
3. 东莞市香蕉蔬菜研究所,广东 东莞 523061
2. Institute of Tropical & Subtropical Ecology, South China Agricultural University, Guangzhou 510642, China;
3. Dongguan Institute of Banana & Vegetable, Dongguan 523061, China
探索安全、有效、持久的病虫害控制方法是农业可持续发展的重要任务.近年来,利用有益微生物控制病虫害的方法受到越来越多的重视[1-3].植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)是指定殖于植物根际系统,并能促进植物生长的一类有益细菌的总称[4].PGPR能够提高植物对矿物质营养的吸收利用,并产生促进植物生长的代谢产物,从而促进植物的生长发育、增加作物产量[3, 5].同时,PGPR对土壤中有害病原微生物与非寄生性根际有害微生物都有拮抗作用[6].在菌根真菌、根瘤菌、内生菌等有益微生物中,PGPR定殖于几乎所有的植物,存在十分普遍,可以被人工培养,很容易开发成产品应用于农业生产.因此,近20多年来国外对PG- PR的研究十分活跃,并已成功开发出一些PGPR产品[4, 7].大力加强PGPR的基础与应用研究,将为作物可持续高产和生物防治提供理论和技术支撑.
作物病害给农业生产带来巨大的经济损失,特别是一些土传病害,危害严重且难以控制.由古巴镰刀菌Fusarium oxysporum f. sp. cubense侵染而引起的香蕉枯萎病对很多地区的香蕉产业造成毁灭性打击[8-11].如何控制香蕉枯萎病等土传作物病害是农业可持续发展的重要课题.本研究从广东省东莞市当地未曾发生香蕉枯萎病的健康香蕉植株的根际土壤中分离出对香蕉枯萎病菌具有拮抗活性的细菌,测定这些细菌对其他植物病原菌的抑菌活性,同时研究了其中抑菌活性较好的细菌对旱地作物玉米和番茄植株生长的促进作用.
1 材料与方法 1.1 材料细菌:从广东省东莞市香蕉与蔬菜研究所未曾发生香蕉枯萎病的香蕉种植地根际土壤中分离出来,细菌分离由广东省东莞市香蕉与蔬菜研究所完成,细菌鉴定由亚热带农业生物资源保护与利用国家重点实验室完成.经鉴定、分离出的细菌分别为枯草芽孢杆菌Bacillus subtilis、解淀粉芽孢杆菌B. amyloliquefaciens、耳炎假单胞菌Pseudomonas otitidis和绿针假单胞菌Ps. choloeaphtis.
植物病原真菌:番茄早疫病菌Alternaria solani、玉米纹枯病菌Rhizoctonia solani、荔枝炭疽病菌Colletotrichum gloeosporioides Penz.、香蕉炭疽病菌C. musarum Cooke et Mass、青瓜枯萎病菌Fusarium oxysporum(Schl.) f. sp. cucumerinum Owen、小麦赤霉病菌F. graminearum、荔枝霜霉病菌Penorophythora litchi Chen以及香蕉枯萎病镰刀菌4号小种F. oxysporum f. sp. cubense race 4(简称FOC),由华南农业大学植物病理学系姜子德教授和周而勋教授提供,由华南农业大学亚热带农业生物资源保护与利用国家重点实验室保存
细菌培养基(简称BG):细菌学蛋白胨10 g,酵母浸提物1 g,水解酪蛋白1 g,葡萄糖5 g,琼脂15 g,蒸馏水1 L;植物病原真菌培养基:马铃薯培养基(PDA).
1.2 方法 1.2.1 香蕉根际土壤分离细菌对植物病原真菌拮抗试验细菌和植物病原真菌均在生化培养箱26 ℃下培养2周,至菌丝长满整个培养皿备用.用打孔器于细菌和真菌的培养皿中打出直径为0.5 cm的菌块,将病原真菌置于PDA培养基中心,以真菌为中心距其3 cm处放置细菌菌块.每个培养皿放置3块细菌菌块,并且使3个细菌连线呈等边三角形,每种细菌3个重复.以同样的处理不接细菌作为病原菌生长对照,1周后测量细菌与真菌生长的半径以及产生的抑菌圈大小.计算细菌、真菌和抑菌圈的生长比例,比较真菌生长抑菌率.
1.2.2 耳炎假单胞菌菌体及其次生物质对植物生长的影响于500 mL三角瓶中装入200 mL BG液体培养基,取直径0.5 cm的耳炎假单胞菌菌块放入三角瓶中进行摇菌发酵,发酵时间为3 d.试验处理分为对照和耳炎假单胞菌菌体发酵液(将发酵原液稀释10倍),菌体浓度为109 cfu·mL-1,吸取50 mL发酵液注射于在温室中生长1个月的玉米Zea mays和番茄Lycopersicon esculentum Mill.苗土壤中,1周后再注射1次,对照不加菌块.栽培过程中用纯净水进行浇灌,并于处理后的第60天测量植株地下部根系和地上部茎叶干质量,测量番茄叶片中的叶绿素含量[12],并比较番茄与玉米的株高变化.每种作物3个重复、每个重复15株,随机摆放.
1.2.3 数据处理使用SPSS 14.0统计软件处理数据,使用Sigmaplot 10.0作图.
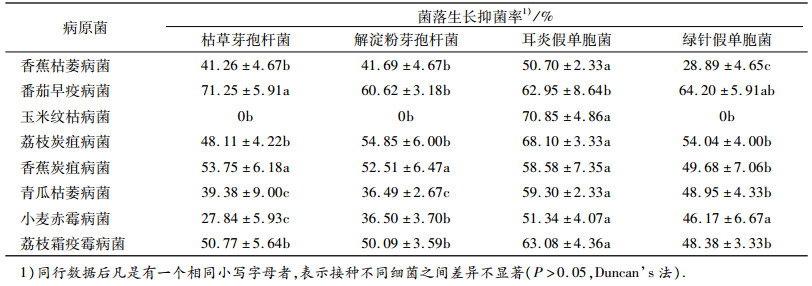
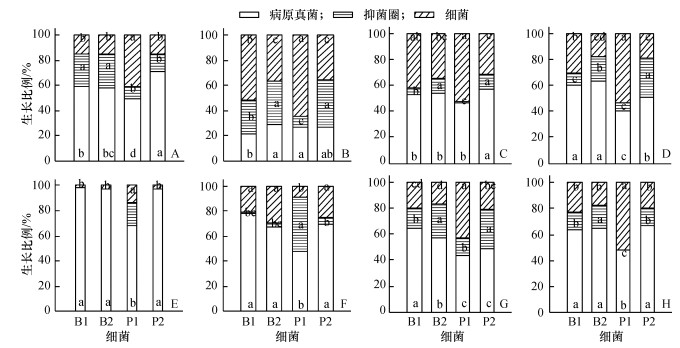
2 结果与分析 2.1 香蕉根际土壤细菌对病原真菌的拮抗作用 2.1.1 香蕉枯萎病菌由图 1A可见,4种香蕉根际土壤细菌中生长最快的是耳炎假单胞菌,其生长半径分别是枯草芽孢杆菌、解淀粉芽孢杆菌、绿针假单胞菌的2.75、2.61和2.70倍.从形成的抑菌圈来看,耳炎假单胞菌的最小.从病原真菌生长受抑制角度的比较发现,耳炎假单胞菌对香蕉枯萎病镰刀菌的抑制作用最强,其抑菌率达到50.70%(表 1).
|
图 1 香蕉根际土壤分离的细菌对作物病原真菌的拮抗作用 Figure 1 The antagonistic effects of bacteria from banana rhizosphere soil on crop pathogens A:香蕉枯萎病镰刀菌4号小种,B:番茄早疫病病菌,C:香蕉炭疽病菌,D:青瓜枯萎病菌,E:玉米纹枯病菌,F:荔枝炭疽病菌,G:小麦赤霉疫病菌,H:荔枝霜疫霉病菌;B1:枯草芽孢杆菌,B2:解淀粉芽孢杆菌,P1:耳炎芽孢杆菌,P2:绿针假单胞菌;各图相同图柱中凡是有一个相同小写字母者,表示接种不同的细菌之间差异不显著(P>0. 05,Duncan's法). |
|
|
表 1 香蕉根际促生菌对作物病原真菌菌落生长的抑制作用 Table 1 Inhibitory effects of plant growth-promoting rhizobacteria from banana rhizosphere on the mycelial growth of crop pathogens |
图 1B表明,生长最快的细菌是耳炎假单胞菌,其生长半径是枯草芽孢杆菌、解淀粉芽孢杆菌、绿针假单胞菌的1.23、1.74和1.78倍.解淀粉芽孢杆菌和绿针假单胞菌形成的抑菌圈比例最大,分别达到34.0%和37.0%,且与耳炎假单胞菌和枯草芽孢杆菌形成的抑菌圈差异显著.在4种细菌抑制作用下,番茄早疫病真菌生长受到强烈抑制,抑菌率最低的是解淀粉芽孢杆菌为60.62%,最高的是枯草芽孢杆菌,其抑菌率为71.25%(表 1).
2.1.3 香蕉炭疽病菌耳炎假单胞菌对香蕉炭疽病真菌生长的抑菌率为58.58%(表 1),比枯草芽孢杆菌、解淀粉芽孢杆菌和绿针假单胞菌分别高5.0%、6.0%和9.0%.耳炎假单胞菌生长比例在4种细菌中最大,达到52.0%(图 1C),但其形成的抑菌圈比例只有1.0%,远远低于枯草芽孢杆菌的5.9%、解淀粉芽孢杆菌的11.7%和绿针假单胞菌的11.3%.
2.1.4 青瓜枯萎病菌耳炎假单胞菌对青瓜枯萎病产生的抑菌圈比例只有5%(图 1D),分别为枯草芽孢杆菌、解淀粉芽孢杆菌、绿针假单胞菌的67.0%、30.0%和19.0%.但是这并不影响它对青瓜枯萎病真菌生长的抑制,其抑菌率为59.30%,是4种细菌中最高的,其次为绿针假单胞菌(48.95%)(表 1).
2.1.5 玉米纹枯病菌从图 1E可见,4种细菌中只有耳炎假单胞菌对玉米纹枯病真菌的生长产生抑制作用,其抑菌率为70.85%,而且是在病原真菌生长1周后的结果.由于玉米纹枯病真菌菌丝生长较快,一般在试验2 d后对照可以长满整个直径7.5 cm的培养皿,而细菌在固体培养基上生长较真菌要慢很多.但从结果来看,耳炎假单胞菌较另外3种细菌对玉米有较好的拮抗作用.
2.1.6 荔枝炭疽病菌荔枝炭疽病在4种细菌的拮抗下生长都受到不同程度的抑制,其中耳炎假单胞菌抑菌率最高,达到68.10%(表 1),其次为解淀粉芽孢杆菌、绿针假单胞菌和枯草芽孢杆菌,抑菌率分别为54.85%、54.04%和48.11%.从细菌生长来看,与前几种病原菌不同,耳炎假单胞菌的生长是最慢的,且与另外3种细菌差异显著(图 1F).耳炎假单胞菌其抑菌圈比例最大,为43.0%.虽然解淀粉芽孢杆菌、绿针假单胞菌和枯草芽孢杆菌的生长半径远大于耳炎假单胞菌,但其抑菌圈比例仅为1.0% ~ 5.0%.
2.1.7 小麦赤霉病菌耳炎假单胞菌对小麦赤霉病真菌的抑菌率为51.34%,与绿针假单胞菌的46.17%相比,两者差异不显著,但均显著高于枯草芽孢杆菌和解淀粉芽孢杆菌(表 1).耳炎假单胞菌的生长速度是4种细菌中最快的,其生长半径是枯草芽孢杆菌、解淀粉芽孢杆菌和绿针假单胞菌的2.14、2.59和2.02倍,且与这3种细菌生长半径差异显著(图 1G).
2.1.8 荔枝霜疫霉病菌香蕉根际土壤细菌对荔枝霜疫霉病菌的抑制情况与香蕉炭疽病菌情况相似,耳炎假单胞菌产生的抑菌圈很小,几乎没有(图 1H).无论从细菌生长速度还是从抑菌率来看,耳炎假单胞菌都显示出对荔枝霜疫霉病的强抑制性和自身的高生长速率,抑菌率达到63.08%;枯草芽孢杆菌和解淀粉芽孢杆菌的抑菌率也较高,达到50.77%和50.09%;抑菌率最小的为绿针假单胞菌,只有48.38%(表 1).
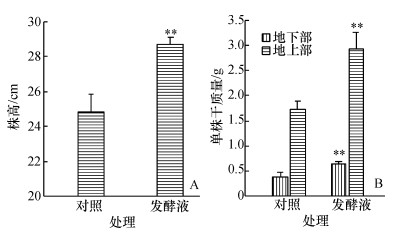
2.2 耳炎假单胞菌发酵液对番茄植株生长的影响由图 2可见,当土壤中加入耳炎假单胞菌发酵液后,番茄植株平均株高明显增长,达到28.7 cm,比对照(24.8 cm)要高16%,差异显著(图 2A).加了发酵液的番茄植株地上部和地下部干质量都明显要高于对照,处理后的番茄植株其地上部单株干质量为2.94 g、地下部为0.64 g,分别为对照(1.72和0.38 g)的1.70和1.68倍(图 2B).可见菌体发酵液促进了番茄地上部和地下部的生物量积累.
|
图 2 耳炎假单胞菌发酵液对番茄幼苗株高和生物量的影响 Figure 2 Effects of fermented broth of Pseudomonas otitidis on the shoot height and biomass of tomatoes 各图中相同图柱上“**”表示差异极显著(P<0. 01). |
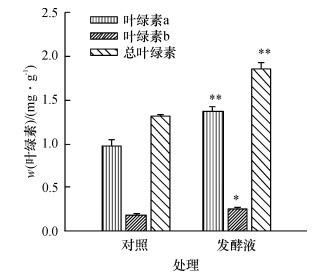
番茄植株在加入耳炎假单胞菌发酵液培养后其叶绿素a和叶绿素b的质量分数明显增加,分别达到1.3 7和0.2 6 mg·g-1,而对照分别为0.9 7和0.18 mg·g-1,处理与对照间差异达极显著和显著水平.加菌液处理的番茄植株总叶绿素质量分数为1.85 mg·g-1,比对照(1.32 mg·g-1)高40%(图 3).
|
图 3 耳炎假单胞菌发酵液对于番茄植株叶绿素的影响 Figure 3 Effects of fermented broth of Pseudomonas otitidis on the chlorophyll content of tomato leaves 各图中相同图柱上“*”、“**”分别代表 0.05、0.01的显著差异. |
加入耳炎假单胞菌发酵液后玉米的株高明显增加,株高为42.4 cm,而对照是31.8 cm,增长33.0%,二者差异极显著(图 4A).耳炎假单胞菌发酵液在促进玉米地上部增长的同时,也增加了地下部的干质量,发酵液处理的玉米根单株干质量为1.78 g,为对照的2.04倍;地上部干质量是对照的2.44倍,加发酵液的玉米地上部和地下部的生物量与对照之间差异极显著.从结果来看,耳炎假单胞菌发酵液在促进玉米生长时更多地促进地上部的增长.
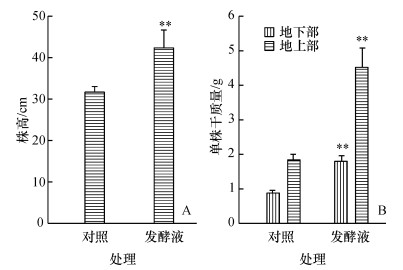
|
图 4 耳炎假单胞菌发酵液对玉米幼苗株高和生物量的影响 Figure 4 Effects of fermented broth of Pseudomonas otitidis on the shoot height and biomass of corns 各图中相同柱子上“**”表示差异极显著(P<0.01). |
本试验所使用的枯草芽孢杆菌、解淀粉芽孢杆菌、耳炎假单胞菌和绿针假单胞菌4种细菌是从未发生香蕉枯萎病的健康香蕉根际土中分离出来的.研究结果表明,这4种细菌对香蕉枯萎病镰刀菌4号小种具有强烈的拮抗作用,并且对番茄早疫病菌、玉米纹枯病菌、荔枝炭疽病菌、香蕉炭疽病菌、青瓜枯萎病菌、小麦赤霉病菌、荔枝霜霉病菌等作物病原菌均具有较好的抑菌活性.目前还不清楚该地区香蕉种植地未发生香蕉枯萎病是否与这些细菌有关,但从国外20多年来PGPR的研究来看[2, 13-16],PGPR已经开始商品化地应用于生产中来预防植物地下病害的发生.研究发现耳炎假单胞菌无论是自身菌体生长速度还是对本试验中所选取的几种植物病原真菌拮抗效果,均比另外3种细菌优异.这主要有2个方面的原因:一方面是根际细菌在生长中与病原真菌产生营养竞争作用;另一方面则是细菌在生长过程中产生抑菌次生物质,从而对病原真菌生长产生抑制作用.本研究发现细菌与真菌产生拮抗作用都形成了抑菌带,抑菌带并没有细菌菌体的产生,这说明是次生物质在培养基中的渗透抑制了真菌生长.
耳炎假单胞菌对三甲苯染料具有褪色降解作用[17-18],但关于其生态方面和对植物生长影响的研究鲜见报道.耳炎假单胞菌与荧光假单胞菌同属假单胞菌属,该属已发现多种生防菌,对植物病害都有一定的防治作用,特别是荧光假单胞菌,已有不少研究证明其对植物还有促生作用[19-20].对于PGPR的促生作用,一般认为可能是分泌植物促生物质,许多研究发现PGPR能分泌不同的促生物质,这些物质主要是植物激素、氨基酸、维生素、衍生物以及一些活性有机小分子等[21-25].此外,PGPR在植物根际中大量聚集,自身旺盛的代谢作用过程中加强了土壤中有机物的分解,通过固氮作用、释放矿物质中的磷、钾、硅等元素,使土壤中有机态化合物转化为无机态化合物从而促进植物营养元素的矿化作用,也增强了作物对营养元素的吸收和利用[26-27].将耳炎假单胞菌发酵液加入到玉米和番茄的盆栽土壤中发现,菌液对植物上均具有促进生长的作用,这说明耳炎假单胞菌发酵液除了对多种植物病原菌具有较好的拮抗作用外,对植物的生长也有促进作用.本试验结果还表明,耳炎假单胞菌发酵液更多地促进双子叶植物番茄地下部根的生长,而对于玉米这种单子叶植物则更多地促进地上部生长.本研究为利用PG- PR控制农作物病害提供了可能和理论依据.
值得注意的是,虽然荧光假单胞菌作为根际促生菌已经应用于生产中,但和耳炎假单胞菌一样,它们是一种环境污染菌,对于人类也是一种机会致病菌.荧光假单胞菌可从伤口、痰、胸水、尿和血液中分离出来,也可从血库中分离出;耳炎假单胞菌则可从耳病患者中分离出来,虽然暂未发现其与耳炎的关联,但越来越多的研究发现耳炎假单胞菌生物催化方面的作用[17].利用PGPR的前提是保证其不会对环境和人类健康产生不利的影响,应用PGPR的生态安全性还需要进一步研究.
| [1] |
崔薇薇. 植物根际促生菌的研究进展[J]. 辽宁农业科学, 2010(2): 35-39. DOI:10.3969/j.issn.1002-1728.2010.02.010 (  0) 0) |
| [2] |
程洁, 梅丽娟, 胡健, 等. 植物根际促生菌作用机制研究进展[J]. 应用生态学报, 2010, 21(1): 232-238. (  0) 0) |
| [3] |
MAKSIMOV I V, ABIZGIL DINA R R, PUSENKOVA L I. Plant growth promoting rhizobacteria as alternative to chemical crop protectors from pathogens(review)[J]. Appl Biochem Microbiol, 2011, 47(4): 333-345. DOI:10.1134/S0003683811040090 (  0) 0) |
| [4] |
GRAY E J, SMITH D L. Intracellular and extracellular PGPR:Commonalities and distinctions in the plant-bacterium signaling processes[J]. Soil Biol Biochem, 2005, 37(3): 395-412. DOI:10.1016/j.soilbio.2004.08.030 (  0) 0) |
| [5] |
RYU C, FARAG M A, HU C, et al. Bacterial volatiles induce systemic resistance in Arabidopsis[J]. Plant Physiol, 2004, 134(3): 1017-1026. DOI:10.1104/pp.103.026583 (  0) 0) |
| [6] |
DWIVEDI D, JOHRI B N. Antifungals from Fluorescent pseudomonads:Biosynthesis and regulation[J]. Curr Sci, 2003, 85(12): 1693-1703. (  0) 0) |
| [7] |
PODILE A R, KISHORE G K. Plant growth-promoting rhizobacteria[M] //Anon. Plant-associated bacteria. Ber- lin: Springer, 2006: 195-230.
(  0) 0) |
| [8] |
PÉREZ L. Fusarium wilt(Panama disease)of bananas:An updating review of the current knowledge on the disease and its causal agent[J]. Fitosanidad, 2004, 8(4): 27-38. (  0) 0) |
| [9] |
TU C C, CHANG Y C, CHENG Y H, et al. Studies on the biological control of Panama disease(Fusarium wilt)of banana[J]. Tainan Dais Res Bull, 1980, 14: 1-12. (  0) 0) |
| [10] |
VILJOEN A. The status of Fusarium wilt(Panama disease)of banana in South Africa[J]. S Afr J Sci, 2002, 98: 341-344. (  0) 0) |
| [11] |
WAITE B H. Inoculation studies and natural infection of banana varieties with races 1 and 2 of Fusarium oxysporum f sp. cubense[J]. Plant Dis Rep, 1977, 61: 15-19. (  0) 0) |
| [12] |
侯福林. 植物生理学模块实验指导[M]. 北京: 科学出版社, 2004, 57-58.
(  0) 0) |
| [13] |
ISLAM M, SULTANA T, JOE M M, et al. Nitrogen-fixing bacteria with multiple plant growth-promoting activities enhance growth of tomato and red pepper[J]. J Basic Microbiol, 2013, 53(12): 1004. DOI:10.1002/jobm.v53.12 (  0) 0) |
| [14] |
RAVISANKAR D, NITHYA C. Significance and Applications of plant growth promoting rhizobacteria(PGPR)in agriculture:A review[J]. J Agri Sci Tech, 2013, 1(3): 19-32. (  0) 0) |
| [15] |
ANNAPURNA K, KUMAR A, KUMAR L V, et al. PG- PR-induced systemic resistance(ISR)in plant disease management[M] // Anon. Bacteria in agrobiology: Dis- ease management. Berlin: Springer, 2013: 405-425.
(  0) 0) |
| [16] |
SARAF M, RAJKUMAR S, SAHA T. Perspectives of PG- PR in Agri-ecosystems[M] // Anon. Bacteria in agrobiol- ogy: Crop ecosystems. Berlin: Springer, 2011: 361-385.
(  0) 0) |
| [17] |
REDDY M V, NIKHIL G N, MOHAN S V, et al. Pseudomonas otitidis as a potential biocatalyst for polyhydroxyalkanoates(PHA)synthesis using synthetic wastewater and acidogenic effluents[J]. Bioresou Technol, 2012, 123: 471-479. DOI:10.1016/j.biortech.2012.07.077 (  0) 0) |
| [18] |
WU J, JUNG B G, KIM K S, et al. Isolation and characterization of Pseudomonas otitidis WL-13 and its capacity to decolorize triphenylmethane dyes[J]. J Environm Sci, 2009, 21(7): 960-964. DOI:10.1016/S1001-0742(08)62368-2 (  0) 0) |
| [19] |
霍宪起, 陈京元. 4种荧光假单胞菌拮抗菌株对湿地松猝倒病病原菌的抑制效果[J]. 东北林业大学学报, 2010, 38(9): 108-109. DOI:10.3969/j.issn.1000-5382.2010.09.032 (  0) 0) |
| [20] |
张伟琼, 聂明, 肖明. 荧光假单胞菌生防机理的研究进展[J]. 生物学杂志, 2007, 24(3): 9-11. DOI:10.3969/j.issn.2095-1736.2007.03.003 (  0) 0) |
| [21] |
KIM Y H. Antiviral, antimicrobial, and cytotoxic properties of peptavirins A and B produced by Apiocrea sp. 14T[J]. Plant Pathol J, 2002, 18(1): 18-22. DOI:10.5423/PPJ.2002.18.1.018 (  0) 0) |
| [22] |
BEN A M R, SIOUD S, FOURATI B F L, et al. Purification and structure determination of four bioactive molecules from a newly isolated Streptomyces sp. TN97 strain[J]. Proc Biochem, 2006, 41(7): 1506-1513. DOI:10.1016/j.procbio.2006.02.010 (  0) 0) |
| [23] |
RADZOM M, ZEECK A, ANTAL N, et al. Fogacin, a novel cyclic octaketide produced by Streptomyces strain Tü 6319[J]. J Antibiot, 2006, 59(5): 315-317. DOI:10.1038/ja.2006.45 (  0) 0) |
| [24] |
DOBBELAERE S, CROONENBORGHS A, THYS A, et al. Responses of agronomically important crops to inoculation with Azospirillum[J]. Functi Plant Biol, 2001, 28(9): 871-879. DOI:10.1071/PP01074 (  0) 0) |
| [25] |
黄晓东, 卢林纲. 植物促生菌及其促生机理(续)[J]. 现代化农业, 2002(7): 13-15. DOI:10.3969/j.issn.1001-0254.2002.07.005 (  0) 0) |
| [26] |
盛下放. 硅酸盐细菌NBT菌株在小麦根际定殖的初步研究[J]. 应用生态学报, 2003, 14(11): 1914-1916. DOI:10.3321/j.issn:1001-9332.2003.11.023 (  0) 0) |
| [27] |
陈国民, 肖静, 李友国, 等. 从植物根际分离的8株细菌的促生作用与初步鉴定[J]. 湖北农业科学, 2008, 47(1): 39-41. DOI:10.3969/j.issn.0439-8114.2008.01.015 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36