2. 云南农业大学 农学与生物技术学院,云南 昆明 650201;
3. 微生物菌种筛选与应用国家地方联合工程研究中心,云南 昆明 650217;
4. 玉溪市农业科学院,云南 玉溪 653100
2. Faculty of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China;
3. National and Local Joint Engineering Research Center for Screening and Application of Microbial Strains, Kunming 650217, China;
4. Yuxi Academy of Agricultural Sciences, Yuxi 653100, China
磷是植物生长和生殖必需的营养元素之一,同时还能促进光合作用和碳水化合物的合成与运转,促进氮素、脂肪和核酸代谢,提高作物对环境的适应性[1].我国土壤中的总磷量相当可观,但95%以上的磷以稳定的铝硅酸盐和磷灰石等无效形式存在,难以被植物直接利用[2].磷肥在作物生长的当季利用率不到25% [3],磷肥的大量施用造成磷素在土壤中的不断积累,容易引起土壤板结以及水体富营养化等环境问题.据估算,1949—1992年间,我国累计施入农田的磷肥达3.4 × 107 t,其中大约有2.6 × 107 t磷累积在土壤中[4].因此,如何减少土壤的磷素积累,提高其利用率已成为当今的研究热点.
土壤中存在多种溶磷微生物,它们能通过自身代谢促进磷矿粉等难溶磷的溶解,使之转化为可被植物直接吸收利用的有效磷.合理利用溶磷微生物能降低磷肥的投入成本,亦可作为一项提高作物产量的重要措施[5-6].本研究以采自磷矿区植物的根围土壤为研究对象,分离、筛选出溶磷细菌,通过脂肪酸鉴定和16S rDNA部分测序鉴定出溶磷细菌的种属,研究高效菌株的溶磷效果,运用单因素筛选和正交试验[7]摸索溶磷的优化条件,为溶磷菌菌剂的开发利用提供试验依据.
1 材料与方法 1.1 样品和培养基土壤样品采自云南玉溪磷矿区附近长势良好的玉米Zea mays、臭灵丹Laggera pterodonta,艾蒿Artemisia argyi、芒草Miscanthus、绿豆Vigna radiate等植物的根围.土样采集后贮存于透明封口袋内并编号,置于4 ℃冰箱中,保存备用.
分离筛选培养基:C6H12O6 10 g,Ca3(PO4)2 5 g,(NH4)2SO4 0.5 g,NaCl 0.2 g,MgSO4·7H2O 0.1 g,KCl 0.2 g,酵母浸膏0.5 g,MnSO4·4H2O 0.002 g,FeSO4·7H2O 0.002 g,40 g·L-1溴酚蓝(pH 6 ~ 7)6 mL,琼脂18 g,蒸馏水1 L,pH 7.0 ~ 7.2.
磷矿粉液体培养基:C6H12O6 10 g,磷矿粉10 g [w(磷)为22%],(NH4)2SO4 0.5 g,NaCl 0.2 g,MgSO4·7H2O 0.1 g,KCl 0.2 g,酵母浸膏0.5 g,MnSO4·4H2O 0.002 g,FeSO4·7H2O 0.002 g,蒸馏水1 L,pH 7.0 ~ 7.2.
1.2 溶磷菌筛选稀释平板培养法分离、筛选溶磷菌.称取10 g土样加入盛有90 mL无菌水的250 mL锥形瓶中,28 ℃,120 r·min-115 min,制成10-1浓度溶液,然后按10倍稀释法依次制备10-2、10-3、10-4、10-5浓度土壤悬液.取10-3、10-4及10-5的土壤稀释悬液各0.1 mL均匀涂布于分离筛选培养基平板上,每个浓度重复3次.倒置平板于30 ℃培养箱中培养24 ~ 48 h,观察并测量菌落直径和溶磷圈直径,计算溶磷圈与菌落直径比.
选择溶磷圈与菌落直径比较大的菌株,接种于磷矿粉液体培养基中,30 ℃、200 r·min-1培养7 d后,测定培养液中水溶性磷含量.选择培养液中有效磷浓度最高的1个菌株开展后续的溶磷条件优化试验.
1.3 溶磷圈及水溶性磷含量测定用灭菌的牙签将菌株分别点接在以Ca3(PO4)2为唯一磷源的培养基上,30 ℃培养5 ~ 7 d,测量溶磷圈直径(D)和菌落直径(d).
挑取单个菌落分别接入以磷矿粉为唯一磷源的液体培养基中,30 ℃、150 r· min-1培养7 d后,12 000 r·min-1、15 min,取上清液用钼蓝法测定含磷量,根据标准曲线计算出上清液中水溶性磷的含量.
1.4 溶磷细菌的鉴定全细胞脂肪酸分析和16S rDNA测序相结合来鉴定菌株.全细胞脂肪酸分析采用Sherlock全自动细菌鉴定系统,参照说明书进行操作和鉴定.细菌DNA提取采用冻融法[8].16S rDNA基因片段的PCR扩增采用细菌通用引物P0(5'-GAG AGT TTG ATC CTG GCT CAG-3')和P6(5'- CTA CGG CTA CCT TGT TAC GA-3').PCR扩增采用20μL反应体系:10 × EasyTaq Buffer(含Mg2+)2.0μL,dNTPs(10 mmol·L-1)1.6μL,P0(10 mmol·μL-1)和P6(10 mmol·μL-1)均为1.0 μL,EasyTaq DNA Polymerase(5 U·μL-1,Transgene)0.2 μL,模板DNA(10 ~ 50 ng·μL-1)0.5 μL,补充ddH2O至20 μL.PCR反应程序为:94 ℃ 5 min,94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,30个循环,最后72 ℃延伸10 min.PCR产物经0.8 g·L-1的琼脂糖凝胶电泳,试剂盒回收目标条带,将回收后的16S rDNA片段连接到pMD18-T载体上,并转化大肠杆菌DH5α感受态细胞中,菌落PCR验证阳性克隆[9].确认的克隆由北京华大基因公司测序,测序结果与NCBI分子生物学数据库比对序列相似性.
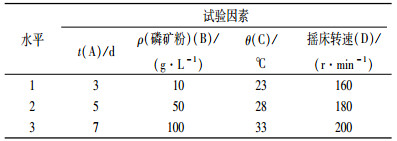
1.5 正交试验数据统计分析用软件正交设计助手ⅡⅤ3.1专业版进行处理分析.在做正交设计时,主要考虑磷矿粉量、温度、摇床转速、发酵时间对溶磷能力的影响,采用4因子3水平[L9(34)]正交试验,重复3次,试验设计见表 1.
|
|
表 1 正交试验设计 Table 1 The design of orthogonal test |
对试验中的数据采用SAS v6.12进行统计分析和Duncan's多重比较.
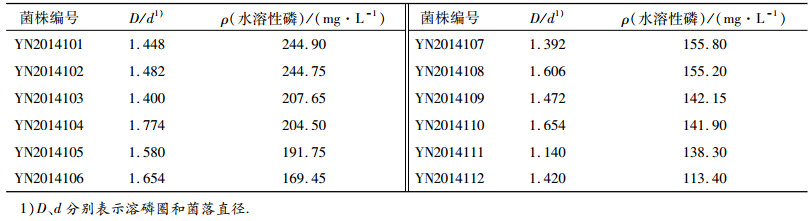
2 结果与分析 2.1 溶磷细菌的筛选本次试验共筛选出22株具有较明显溶磷圈的菌株,选取溶磷圈直径(D)与菌落直径(d)比值(D/d)比较大的12株菌株,摇瓶复筛,结果见表 2.其中YN2014101和YN2014102的溶磷效果最好.菌株YN2014102在分离筛选培养基平板上,在28 ℃下培养2 d,菌落中等大小、不透明、凸起,黄色,被选作进一步研究的菌株.
|
|
表 2 溶磷细菌从磷矿石中释放出的水溶性磷含量 Table 2 Available phosphorus dissolved by the bacterial strains from phosphate rocks |
以脂肪酸种类和含量为参数,与标准数据库比对,有3个菌株与新分离到的菌株YN2014102相似程度较高,其中与Burkholderia cenocepacia的相似系数最高,达0.902,与B. cenocepacia-GC subgroup B(Pseudomonas cepacia)的相似系数为0.639,与B. andropogonis的相似系数0.630.依据相似系数大小,菌株YN2014102可能属于B. cenocepacia.
2.3 16S rDNA序列分析根据16S rDNA的测序与NCBI数据库(http://www.ncbi.nlm.nih.gov)BLAST比对的结果,与菌株YN2014102序列相似性较高的菌株均属于伯克霍尔德菌属,且与洋葱伯克霍尔德菌B. cenocepacia相似性达99%.即菌株YN2014102的16S rDNA序列比对与脂肪酸测定结果一致,故菌株暂鉴定为洋葱伯克霍尔德菌.
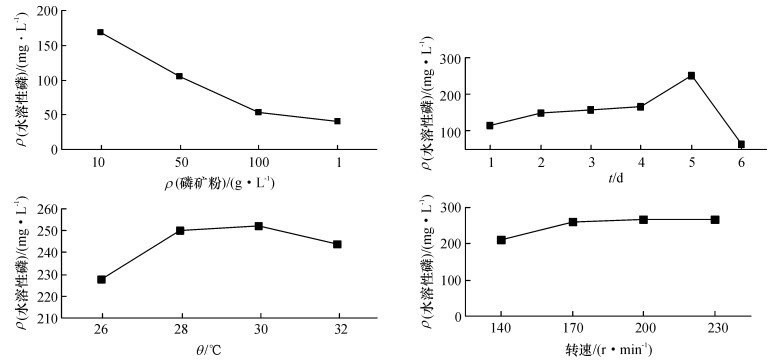
2.4 各因素对水溶性磷含量的影响由图 1可知,水溶性磷含量随着磷矿粉含量的增加而减少,当磷矿粉质量浓度为10 g·L-1时,可能刚好与菌体均匀悬浮,达最佳状态,所以溶磷的效果最好,故确定最佳磷矿粉质量浓度为10 g·L-1;随着时间的延长,水溶性磷含量上升后递减,所以确定最佳发酵时间为5 d;随着温度升高,水溶性磷含量先增后减,28 ℃之后增量并不是太显著,故确定最佳的发酵温度28 ℃;转速也是发酵过程中较重要的参数,改变转速会改变供氧条件,最佳转速使菌体处于最佳溶解氧状态,并使菌体处于均匀悬浮状态,由图 1可以看出水溶性磷含量随摇床转速的增加而略有增加,且180 r·min-1之后渐趋于平缓,所以最佳摇床转速为180 r·min-1.
|
图 1 各因素对水溶性磷含量的影响 Figure 1 Effects of different fators on the contents of available phosphorus |
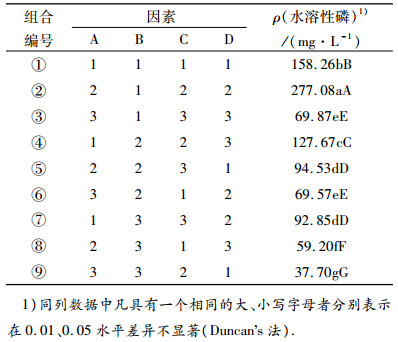
为了优化溶磷的培养条件,根据以上单因素试验结果,设计了表 1中的4因素3水平正交试验,所得到结果如表 3.在9个处理中,A2B1C2D2的溶磷效果最好,极显著地高于其他处理,即磷矿粉质量浓度10 g·L-1,28 ℃,180 r·min-1培养5 d,菌株YN2014102在培养基中的水溶性磷达277.08 mg·L-1.以A3B3C2D1效果最差,磷矿粉10 g·L-1处理水溶性磷含量极显著地高于50 g·L-1和100 g·L-1处理的,这可能是培养基中固相物多影响了菌株YN2014102的培养。5 d后可溶性磷含量较高,这可能与培养周期长,培养基中其他营养已消耗,培养周期短,菌株YN2014102生长量不够有关.
|
|
表 3 正交试验结果 Table 3 The orthogonal test results |
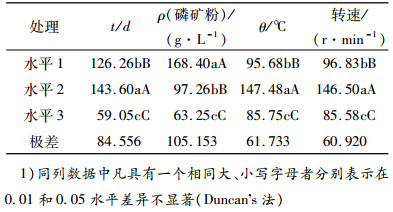
利用显著性差异和极差分析了各因素对水溶性磷含量的影响(表 4).从表 4可知,所选的时间,温度,磷矿粉含量,摇床转速对水溶磷的含量的影响存在显著性差异,说明这几个因素确实影响了该菌的溶磷能力.极差反映了该因素变化时对试验指标的影响,极差越大,该因素对试验的影响越显著.从总体来看,磷矿粉量的多少对培养基中YN2014102的溶磷量影响最大,其次是培养时间,温度和摇床转速.
|
|
表 4 正交试验分析1) Table 4 Range analysis of the orthogonal test results |
具有溶磷能力的微生物有很多,目前已报道的溶磷菌主要包括芽孢杆菌属Bacillus、假单胞菌属Pseudomonas、欧文氏菌属Erwinia、土壤杆菌属Agrobacterium、沙雷氏菌属Serratia、黄杆菌属Flavobacterium、硫杆菌属Thiobacillus、色杆菌属Chromobacterium、产碱菌属Alcaligenes、节杆菌属Arthrobacter、沙门氏菌属Salmonella、肠杆菌属Enterbacter、微球菌属Micrococcus、固氮菌属Azotobacter和根瘤菌属Bradyrhizobium等[10].有关洋葱伯克霍尔德氏菌溶磷、抑菌及促生长已有报道[11-15],但鲜见云南磷矿区土壤分离得到的洋葱伯克霍尔德氏菌的报道.
有关溶磷培养条件的优化也早有研究,大多从C源、N源、NaCl、pH、装液量、接种量、种龄、温度、摇床转速等方面来进行研究[16-18].溶磷过程是复杂的,并不是某一因素起全部作用,而是多种因素共同作用的结果,溶磷培养条件也会因菌株的不同而异.本试验对磷矿粉含量、培养时间、温度和摇床转速这4个因素进行洋葱伯克霍尔德菌YN2014102溶磷条件的优化,进一步证实了其具有很强的溶磷活性,明确了其溶磷活性与上述提及的4个因素紧密相关.通过正交试验,证明以磷矿粉10 g·L-1为唯一磷源,在28 ℃、180 r·min-1的条件下发酵5 d,发酵液中的水溶性磷质量浓度达到277.08 mg·L-1.然而,这种优化条件还只是试验性的,要真正运用菌株YN2014102溶磷,实现低品位磷矿石无害化应用及提高田间磷使用效率,还需深入研究.
洋葱伯克霍尔德氏菌不是一个简单种,而是一组表型相近但基因型不同的复合物,至今已发现它包括17个不同的基因型,由于这些基因型之间有很低的DNA杂交率,因此不同基因型可代表不同的种[19-21].有些种具有生物防治、促进植物生长、生物修复等功能,有些种是人类的条件致病菌,能引起肺囊性纤维化,或引起医院病人临床感染[22].因此,本研究中的菌株YN2014102究竟属于哪一个种?是否引起人类疾病,还有待下一步试验证实.
| [1] |
余旋. 四川核桃主产区根际解磷细菌研究[D]. 雅安: 四川农业大学, 2011.
(  0) 0) |
| [2] |
樊磊, 叶小梅, 何加骏, 等. 解磷微生物对土壤磷素作用的研究进展[J]. 江苏农业科学, 2008(5): 261-263. DOI:10.3969/j.issn.1002-1302.2008.05.090 (  0) 0) |
| [3] |
鲁如坤, 时正元, 顾益初. 土壤积累态磷研究:Ⅱ:磷肥的表观积累利用率[J]. 土壤, 1995, 27(6): 286-289. (  0) 0) |
| [4] |
杨钰, 阮晓红. 土壤磷素循环及对土壤磷流失的影响[J]. 土壤与环境, 2001, 10(3): 256-258. DOI:10.3969/j.issn.1674-5906.2001.03.024 (  0) 0) |
| [5] |
张毅民, 孙亚凯, 吕学斌, 等. 高效溶磷菌株Bmp5筛选及活力和培养条件的研究[J]. 华南农业大学学报, 2006, 27(3): 61-65. DOI:10.3969/j.issn.1001-411X.2006.03.017 (  0) 0) |
| [6] |
王光华, 赵英, 周德瑞, 等. 解磷菌的研究现状与展望[J]. 生态环境, 2003, 12(1): 96-101. DOI:10.3969/j.issn.1674-5906.2003.01.024 (  0) 0) |
| [7] |
刘瑞江, 张业旺, 闻崇炜, 等. 正交试验设计和分析方法研究[J]. 实验技术与管理, 2010, 27(9): 52-56. DOI:10.3969/j.issn.1002-4956.2010.09.016 (  0) 0) |
| [8] |
冯广达, 陈美标, 羊宋贞, 等. 用于PCR扩增的细菌DNA提取方法比较[J]. 华南农业大学学报, 2013, 34(3): 439-442. (  0) 0) |
| [9] |
MARCHESI J R, SATO T, WEIGHTMAN A J, et al. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA[J]. Appl Environ Microbiol, 1998, 64(2): 795-799. (  0) 0) |
| [10] |
胡晓峰, 郭晋云, 张楠, 等. 一株溶磷抑病细菌的筛选及其溶磷特性[J]. 中国农业科学, 2010, 43(11): 2253-2260. DOI:10.3864/j.issn.0578-1752.2010.11.008 (  0) 0) |
| [11] |
OLIVEIRA C A, ALVES V M C, MARRIEL I E, et al. Phosphate solublilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome[J]. Soil Biol Biochem, 2008, 41(9): 1782-1787. (  0) 0) |
| [12] |
余贤美, 王义, 沈奇宾, 等. 解磷细菌PSB3的筛选及拮抗作用的研究[J]. 微生物学通报, 2008, 35(9): 1389-1403. (  0) 0) |
| [13] |
PARKE J L, GURIAN-SCHERMAN D. Diversity of the Burkholderia cepacia complex and implications for risk assessment of biological control strains[J]. Ann Rev Phyto, 2001, 39: 225-258. DOI:10.1146/annurev.phyto.39.1.225 (  0) 0) |
| [14] |
张立新, 谢关林, 罗远婵. 洋葱伯克氏菌在农业上应用的利弊探讨[J]. 中国农业科学, 2006, 39(6): 1166-1172. DOI:10.3321/j.issn:0578-1752.2006.06.011 (  0) 0) |
| [15] |
牟志美, 路国兵, 冀宪领, 等. 桑树内生拮抗细菌Burkholderia cepacia Lu1021的分离鉴定及其内生定殖[J]. 微生物学报, 2008, 48(5): 623-630. DOI:10.3321/j.issn:0001-6209.2008.05.010 (  0) 0) |
| [16] |
陈俊, 陆俊棍, 康丽华, 等. 红树林溶磷菌的初步鉴定、溶磷能力测定及其优化培养[J]. 微生物学通报, 2009, 36(8): 1183-1188. (  0) 0) |
| [17] |
姚庆智, 闫伟, 高学良, 等. 油松菌根根际一株高效磷细菌培养条件的研究[J]. 安徽农业科学, 2009, 37(18): 8337-8340. DOI:10.3969/j.issn.0517-6611.2009.18.016 (  0) 0) |
| [18] |
麻瑞阳, 张爱民, 惠小双, 等. 高效解磷解钾菌NX-11菌株的分离筛选、鉴定及最佳培养条件的确定[J]. 华北农学报, 2013, 28(2): 202-208. DOI:10.3969/j.issn.1000-7091.2013.02.036 (  0) 0) |
| [19] |
PAYNE G W, VANDAMME P, MORGAN S H, et al. Development of a recA gene-based identification approach for the entire Burkholderia genus[J]. Appl Environ Microbiol, 2005, 71(7): 3917-3927. DOI:10.1128/AEM.71.7.3917-3927.2005 (  0) 0) |
| [20] |
VANLAERE E, BALDWIN A, GEVERS D, et al. Taxon K, a complex within the Burkholderia cepacia complex, comprises at least two novel species, Burkholderia contaminans sp. nov. and Burkholderia lata sp. nov.[J]. Int J Syst Evol Micr, 2009, 59(1): 102-111. DOI:10.1099/ijs.0.001123-0 (  0) 0) |
| [21] |
AGNOLI K, SCHWAGER S, UEHLINGER S, et al. Exposing the third chromosome of Burkholderia cepacia complex strains as a virulence plasmid[J]. Mol Microbiol, 2012, 83(2): 362-378. DOI:10.1111/mmi.2012.83.issue-2 (  0) 0) |
| [22] |
叶建仁, 任嘉红, 李浩, 等. 洋葱伯克霍尔德氏菌及其在林木病害防治中的应用[J]. 南京林业大学学报:自然科学版, 2013, 37(4): 149-155. (  0) 0) |
 2015, Vol. 36
2015, Vol. 36