2. 华南农业大学 教学科研基地管理中心,广东 广州 510642
2. Center for Teaching and Research Base, South China Agricultural University, Guangzhou 510642, China
苦楝Melia azedarach又名翠树、楝树、紫花树、森树等,为楝科楝属落叶乔木,分布于中国、韩国、日本、印度、斯里兰卡、印度尼西亚和澳大利亚等地,欧洲、美洲也有栽培[1].苦楝在我国分布广泛,水平分布为北纬18° ~ 40°,南至海南省崖县,北到河北保定和山西运城、陕西渭南、陇南地区,东至台湾、沿海各省,西到四川、云南保山[2].它生长速度快、木材材质优良、纹理美丽,易加工,可用于家具、建筑、农具、船舶、乐器制作等方面,木材抗白蚁、抗虫蛀、耐腐.苦楝耐烟尘,能大量吸收有毒有害气体,是优良的城市及工矿区绿化树种,也是我国南方四旁绿化常用树种[3-4].苦楝的根、皮、花、果均可入药,也可作为植物源农药[5].遗传多样性是生物多样性的重要组成部分,SRAP(Sequence-related amplified polymorphism,相关序列扩增多态性)结合了AFLP及RAPD各自的优点,方便快速,只需要极少量DNA材料,且不需要预先知道DNA序列信息,即可快速获得大量的信息,试验结果稳定可靠,且再现性较高,重复性较好[6-7].目前为止,国内对于苦楝的遗传多样性分析,鲜见开展过SRAP的研究.本试验采用单因素和正交试验设计从DNA、dNTPs、Mg2+、引物和TaqDNA聚合酶5个组分浓度对苦楝SRAP-PCR反应体系进行优化,旨在寻找一种高效、快速、经济的试验方法,建立适合苦楝的SRAP-PCR反应体系,为进一步应用SRAP技术对苦楝群体遗传多样性、种质资源鉴定等研究提供参考[7].
1 材料与方法 1.1 材料苦楝幼叶于2013年7月取自华南农业大学苗圃,随用随采,用于苦楝基因组DNA的提取,采集叶片分别为海南三亚、广东兴宁、广西梧州、福建建瓯、江西南昌、安徽利辛、陕西蒲城、河北邯郸种源.所用正向引物序列为Me19(TGAGTCCAAACCGGTTG)和Me27(TGGGGACAACCCGGCTT),反向引物序列为Em2(GACTGCGTACGAATTTGC)、Em4(GACTGCGTACGAATTTGA)和Em5(GACTGCGTACGAATTAAC).
1.2 主要试剂和仪器用于SRAP-PCR反应的Taq酶、dNTPs、Mg2+为TaKaRa公司产品,引物由北京华大基因研究中心合成,PCR反应在东胜创新生物技术有限公司的PCR扩增仪上进行,DNA浓度和纯度使用超微量紫外分光光度计(Thermo Nanodrop 2000)检测.
1.3 基因组DNA的提取苦楝基因组DNA提取参照上海生工生物工程有限公司柱式基因组DNA提取试剂盒说明书进行.所提取的基因组DNA用8 g·L-1琼脂糖凝胶电泳检测品质,并采用超微量紫外分光光度计检测DNA的浓度和纯度,然后将DNA稀释至50 ng·μL-1,置于-20 ℃条件下保存备用.
1.4 PCR扩增SRAP-PCR反应程序为:94 ℃预变性5 min;94 ℃变性1 min,35 ℃复性1 min,72 ℃延伸1 min,5个循环;94 ℃变性1 min,50 ℃复性1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min.扩增产物采用20 g·L-1的琼脂糖凝胶电泳,电泳后在自动凝胶图像分析仪上拍照分析.
1.5 PCR反应体系单因素分析对影响苦楝SRAP-PCR反应的主要因素(模板DNA、dNTPs、Mg2+、引物和Taq酶)进行单因子试验.对各影响因子分别设置8个梯度处理:模板DNA为0、10、20、30、40、50、60和70 ng;dNTPs为0、0.05、0.10、0.15、0.20、0.25、0.30和0.35 mmol · L-1;Mg2+为0、1.0、1.5、2.0、2.5、3.0、3.5和4.0 mmol·L-1;引物为0、0.16、0.24、0.32、0.40、0.48、0.56和0.64 μmol·L-1;Taq DNA聚合酶为0、0.50、0.75、1.00、1.25、1.50、1.75和2.00 U.
1.6 PCR反应体系的正交试验在对影响苦楝SRAP-PCR反应的模板DNA、dNTPs、Mg2+、引物和Taq酶进行单因子试验后采用L16(45)正交试验设计,共16个处理,每个处理设2个重复,各因素水平见表 1.根据电泳条带的多少、清晰度及背景颜色进行打分.最优的得5分,最差的得1分,并计算每个因素在不同水平下的平均得分[8].
|
|
表 1 SRAP-PCR正交试验设计L 16(45)及试验结果 Table 1 L 16(45) Orthogonal designs and results of SRAP-PCR reaction |
以SRAP-PCR反应产物电泳得到的条带数目较多且清晰为筛选原则,对反应体系中起主要作用的5个因素进行单因素浓度梯度筛选试验[9-12],每个因素设置8个浓度梯度.试验结果表明:在25 μL反应体系中,模板DNA为25 ~ 40 ng、dNTPs为0.125 ~ 0.200 mmol·L-1、Mg2+为1.75 ~ 2.25 mmol·L-1、引物为0.40 ~ 0.52 μmol·L-1、Taq DNA聚合酶为0.50 ~ 1.25 U时扩增效果好,条带较多且清晰,故将其选为后续正交试验的适宜浓度范围.
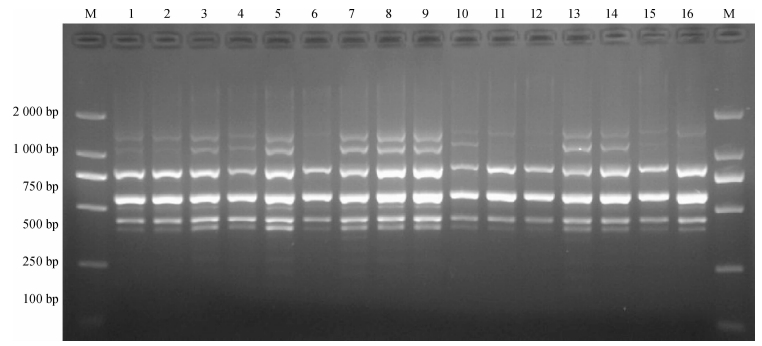
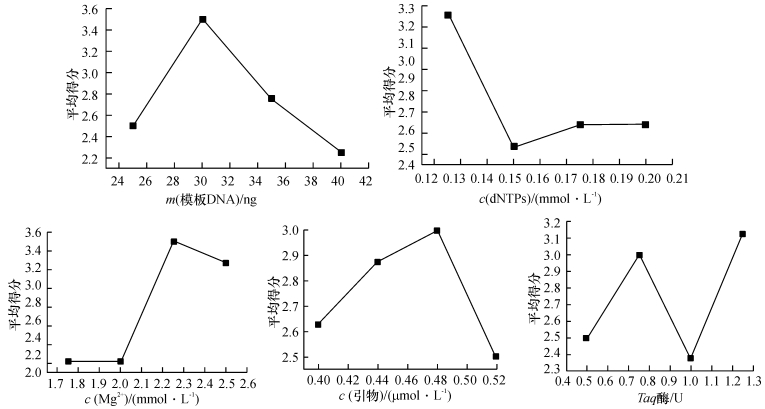
2.2 苦楝SRAP-PCR正交反应体系的优化以上述单因素试验确定的各因素适宜浓度范围为基础,采用L 16(45)正交设计对SRAP-PCR反应体系进行优化(表 1),并根据电泳条带的多少、清晰度及背景颜色(图 1)对16个处理进行打分,打分结果如表 1所示,从2次的得分来看,重复间差异不大,试验的一致性较好,其中处理5、处理7、处理8和处理9效果较好,评分均为4分,而处理15效果不好,评分仅为1.0分.从图 2可见,模板DNA 30 ng、dNTPs 0.125 mmol·L-1、Mg2+ 2.25 mmol·L-1、引物0.48 μmol·L-1、Taq DNA聚合酶0.75 U、反应总体积25 μL时得分较高,实现最佳扩增,确定为最优组合.
|
图 1 SRAP-PCR反应体系正交试验结果 Figure 1 Amplified patterns of the SRAP-PCR based on orthogonal design M:DNA maker DL2000;1 ~ 16:处理1 ~ 16(陕西蒲城种源). |
|
图 2 模板DNA、dNTPs、Mg2+、引物、Taq DNA聚合酶与平均得分的关系 Figure 2 Relationship between concentrations and mean scores of template DNA, dNTPs, Mg2+, primer and Taq polymerase |
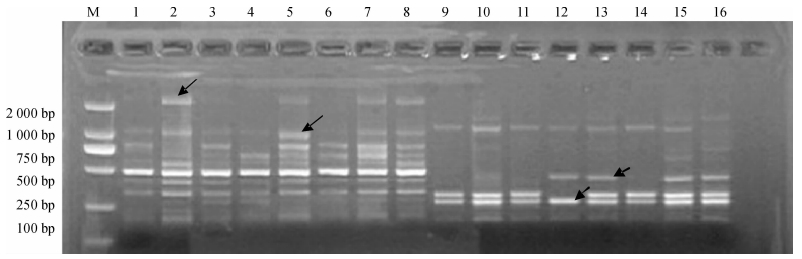
为了验证体系的准确性,以来自海南三亚、广东兴宁、广西梧州、福建建瓯、江西南昌、安徽利辛、陕西蒲城、河北邯郸的8个苦楝种源DNA为模板,选取引物Me27/Em2、Me27/Em4进行SRAP-PCR验证,其结果如图 3所示,每个种源对每个引物均有清晰的条带,且不同种源间条带有差异.由此可见,本试验建立的SRAP-PCR体系稳定可靠,适用于苦楝后续的SRAP分析.
|
图 3 SRAP-PCR反应体系稳定性检测 Figure 3 The verification of Melia azedarach SRAP-PCR reaction system M:DNA maker DL2000;1 ~ 8:引物Me27/Em2;9 ~ 16:引物Me27/Em4;自1和9开始,从左到右依次为海南三亚、广东兴宁、广西梧州、福建建瓯、江西南昌、安徽利辛、陕西蒲城、河北邯郸种源DNA. |
本试验建立并优化了适应苦楝SRAP-PCR的反应体系,前期对苦楝模板DNA、Mg2+、引物和Taq酶进行单因子试验,研究发现,SRAP对苦楝DNA浓度的要求不高,有一个较宽的浓度适宜范围,在25 μL体系中,模板DNA为10 ~ 70 ng时都扩增出了较清晰、带型基本相同的谱带;dNTPs设计的8个浓度梯度中,0.1 ~ 0.2 mmol·L-1范围内能扩增出清晰谱带,且条带基本相同,浓度低于0.1 mmol·L-1时,扩增条带弥散,高于0.2 mmol·L-1时,出现条带丢失的现象;Mg2+为2.00 mmol·L-1左右时扩增条带较清晰且数量多;引物介于0.48 ~ 0.64 μmol·L-1之间均能产生较为清晰的条带,且带型基本上保持一致,条带数并没有随着浓度的增加而增加;Taq DNA聚合酶用量在0.50 ~ 2.0 U范围内均可以得到清晰的带型,对其用量要求不高.进一步对苦楝SRAP-PCR的反应体系进行正交试验,并根据电泳条带的多少、清晰度及背景颜色对16个处理进行打分,从2次的得分来看,重复间差异不大,试验的一致性较好,其中处理5、处理7、处理8和处理9效果较好,评分均为4.0分,而处理15效果不好,评分仅为1.0分.根据得分可知,在25 μL反应体系中,当模板DNA 30 ng、dNTPs 0.125 mmol·L-1、Mg2+ 2.25 mmol·L-1、引物0.48 μmol·L-1、Taq DNA聚合酶0.75 U时,实现最佳扩增,确定为最优组合.以来自海南三亚、广东兴宁、广西梧州、福建建瓯、江西南昌、安徽利辛、陕西蒲城、河北邯郸的8个苦楝种源DNA为模板,选取引物Me27/Em2、Me27/Em4进行SRAP-PCR反应体系稳定性验证,结果表明,筛选体系能很好地满足苦楝基因组SRAP-PCR扩增的要求且不同种源间条带有差异.
| [1] |
杨湘. 不同种群苦楝中苦楝素含量变化规律研究[D]. 南京: 南京林业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10298-1011401397.htm
(  0) 0) |
| [2] |
程诗明. 苦楝聚合群体遗传多样性研究与核心种质构建[D]. 北京: 中国林业科学研究院, 2005. http://cdmd.cnki.com.cn/article/cdmd-82201-2005128807.htm
(  0) 0) |
| [3] |
刘丽云. 苦楝栽培技术及应用价值[J]. 北方园艺, 2009(9): 144-145. (  0) 0) |
| [4] |
曾东东. 家具用苦楝集成材的研究[D]. 南京: 南京林业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10298-1012256543.htm
(  0) 0) |
| [5] |
程诗明, 顾万春. 苦楝遗传资源学研究进展及其展望[J]. 浙江林业科技, 2007, 27(2): 64-69. DOI:10.3969/j.issn.1001-3776.2007.02.017 (  0) 0) |
| [6] |
董星光, 樊丽, 王志刚, 等. 梨SRAP体系的正交优化研究[J]. 江苏农业科学, 2009(2): 51-53. DOI:10.3969/j.issn.1002-1302.2009.02.016 (  0) 0) |
| [7] |
张晓蕾, 张凯旋, 杨传平, 等. 白桦SRAP反应体系的建立与优化[J]. 东北林业大学学报, 2010, 38(9): 1-3. DOI:10.3969/j.issn.1000-5382.2010.09.001 (  0) 0) |
| [8] |
刘明泰, 李杨, 刘小林, 等. 皱纹盘鲍SRAP反应体系的正交优化[J]. 大连海洋大学学报, 2013, 28(1): 12-16. DOI:10.3969/j.issn.2095-1388.2013.01.003 (  0) 0) |
| [9] |
闫建勋, 刘念, 黄邦海. 姜黄属SRAP反应体系的优化与建立[J]. 广东农业科学, 2011, 38(1): 152-154. DOI:10.3969/j.issn.1004-874X.2011.01.056 (  0) 0) |
| [10] |
高亚卉, 朱广龙, 姬志峰, 等. 太行菊SRAP-PCR反应体系的建立与优化[J]. 实验室科学, 2012, 15(1): 81-84. DOI:10.3969/j.issn.1672-4305.2012.01.026 (  0) 0) |
| [11] |
井赵斌, 俞靓, 魏琳, 等. 本氏针茅SRAP-PCR反应体系的建立及引物筛选[J]. 草业科学, 2012, 29(2): 219-228. (  0) 0) |
| [12] |
尹德洁, 苏淑钗, 刘肖, 等. 蓝莓SRAP-PCR反应体系的建立优化及引物筛选[J]. 东北林业大学学报, 2013, 41(2): 35-39. DOI:10.3969/j.issn.1000-5382.2013.02.009 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36