伪狂犬病病毒(Pseudorabies virus,PRV)属疱疹病毒科α-疱疹病毒亚科,能引起多种动物发生以发热、奇痒、脑脊髓炎为主要特征的传染病,猪为其储存宿主,并可引起猪的潜伏感染[1].该病毒可感染各个年龄段的猪,主要表现为妊娠母猪的流产、死胎及木乃伊胎,新生仔猪出现神经症状,成年猪的呼吸道症状等.该病对世界养猪业造成了严重危害,因此加强该病的防控对养猪业的健康发展至关重要.
糖蛋白E (gE)是伪狂犬病病毒复制所非必须的一种糖蛋白[2],与病毒的毒力相关.当gE基因缺失时,病毒毒力降低,但不影响病毒在宿主体内的复制和免疫原性[3].使用gE基因缺失疫苗免疫猪,其体内不会产生针对gE蛋白的抗体,而自然感染的猪则可产生[4],因此采用基因缺失疫苗结合相应的鉴别诊断方法可区分疫苗免疫猪和自然感染猪.欧美等许多国家采用此方法来根除伪狂犬病,并取得了很大的成功,部分国家已成功根除伪狂犬病[5].
gE基因全长约1.7 kb,编码577个氨基酸,gE基因的第157 ~ 714位核苷酸区域编码gE糖蛋白的5个主要抗原表位[6],本试验应用PCR扩增gE基因的主要抗原表位区,构建原核表达质粒,在大肠埃希菌Escherichia coli中进行高效表达,利用表达蛋白为诊断抗原,建立gE184-ELISA诊断方法,为伪狂犬病的快速诊断及根除计划的实施提供技术手段.
1 材料与方法 1.1 材料 1.1.1 病毒与菌株伪狂犬病病毒、大肠埃希菌DH5α及BL21(DE3)、表达载体pET-32a(+)均为华南农业大学兽医学院微生物学与免疫学教研室保存.
1.1.2 主要试剂LA Taq酶、限制性内切酶BamHⅠ及Hind Ⅲ、T4 DNA连接酶、DNA Marker、IPTG、琼脂糖均为TaKaRa公司产品; 蛋白质Marker为Fermentas公司产品; DNA凝胶回收试剂盒及质粒抽提试剂盒为Omega公司产品; HisTrapFF crude预装柱为GE公司产品; 羊抗猪IgG-HRP为广州健阳生物技术有限公司产品; PRV标准阳性、阴性血清及猪瘟病毒(CSFV)、口蹄疫病毒(FMDV)、流行性乙型脑炎病毒(JEV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒病2型(PCV-2)阳性血清由华南农业大学兽医学院微生物学与免疫学教研室保存; 290份临床血清样本为猪场送检; gE抗体试剂盒为美国IDEXX公司产品; 引物由生工生物工程(上海)股份有限公司合成.
1.2 gE184的PCR扩增参考GenBank登录的伪狂犬病病毒gE序列(登录号AF 171937),设计1对引物扩增gE基因主要抗原表位区.引物如下: gE-F: 5'-CGCGGATCCGAC GATGACCTCAACGGC-3'(下划线部分为BamHⅠ酶切位点),gE-R: 5'-CCCAAGCTTCGAGAAGAGCTGCGAGT G-3'(下划线部分为Hind Ⅲ酶切位点).
抽提猪伪狂犬病病毒Ea株的DNA作为模板进行PCR扩增[7],条件为: 95 ℃预变性5 min; 95 ℃变性30 s,56 ℃退火45 s,72 ℃延伸1 min,30个循环; 72 ℃终延伸10 min.PCR产物经0.01 g·mL-1琼脂糖凝胶电泳检测.
1.3 重组表达质粒的构建用BamHⅠ和HindⅢ双酶切PCR产物,与经同样双酶切处理的pET32a(+)进行连接,转化DH5α感受态细胞.提取质粒并采用PCR和酶切方法进行鉴定,经鉴定正确的重组质粒送到生工生物工程(上海)股份有限公司进行基因序列测定,鉴定后的阳性重组质粒命名为pET-gE184.
1.4 重组蛋白的表达、纯化及Western-blot活性检测将鉴定正确的重组质粒pET-gE184转化大肠埃希菌BL21(DE3).优化诱导条件,在最佳诱导条件下表达目的蛋白,采用HisTrapFF镍柱亲和层析柱纯化目的蛋白,BCA法测定纯化蛋白的含量,并用SDSPAGE电泳和Western-blot进行检测.
1.5 间接gE184-ELISA检测方法的建立 1.5.1 反应条件的优化采用方阵滴定法确定重组蛋白gE184的包被浓度及血清稀释度,并对封闭液的选择及其作用时间、二抗稀释度及其作用时间、TMB显色时间分别进行优化.
1.5.2 判定标准的确定取20份PRV阴性猪血清样本,用建立的间接gE184-ELISA方法检测,以20份血清的平均D450 nm+3 × SD作为判定阴阳性的临界值.
1.5.3 特异性试验用建立的间接gE184-ELISA方法检测CSFV、PRRSV、JEV、FMDV、PCV-2标准阳性血清及gE基因缺失疫苗免疫血清.同时设猪伪狂犬病病毒阳性血清、阴性血清对照,判定血清交叉反应情况.
1.5.4 敏感性试验将PRV阳性血清作平行倍比稀释,用建立的间接gE184-ELISA方法检测血清中抗体的含量,判定其抗体检出效价.
1.5.5 重复性试验批内重复性试验:取5份抗体水平不同的血清,在同一批次包被的酶标板中按优化的ELISA操作程序进行试验,每份样品重复8个孔,根据D450 nm计算变异系数.批间重复性试验:取5份抗体水平不同的血清,用8块不同批次包被的酶标板按优化的ELISA操作程序进行试验,根据D450 nm计算变异系数.
1.5.6 临床样品检测使用本试验建立的间接gE184-ELISA检测不同猪场送检的290份猪血清样本,并与商品化ELISA试剂盒检测结果进行比较.
2 结果与分析 2.1 PCR扩增及重组表达质粒构建经PCR扩增出约为552 bp的目的条带,与预期大小相符(图 1).重组质粒pET-gE184经BamHⅠ、HindⅢ双酶切后,可得到约552和5 800 bp的2个片段(图 1),与预期结果相符,基因序列测定结果显示和参考的序列一致.

|
图 1 PRV gE184 PCR扩增结果及重组质粒pET-gE184的酶切鉴定 Figure 1 Amplification of gE184 of PRV by PCR and identification of recombinant plasmid expression pET-gE184 M1 : DNA marker DL2000; 1: gE基因PCR扩增产物; 2: BamHⅠ和Hind Ⅲ双酶切pET-gE184; M2 : DNA marker DL10000. |
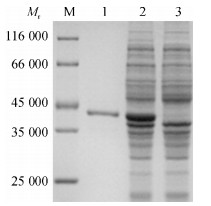
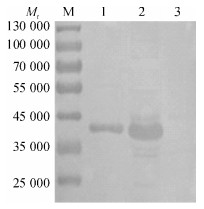
重组质粒pET-gE184转化大肠埃希菌BL21 (DE3),经IPTG诱导后通过SDS-PAGE电泳,可见表达蛋白相对分子质量约为39 000(图 2).通过His TrapFF镍柱亲和层析获得较纯的重组蛋白,Western blot结果表明表达蛋白可与PRV阳性血清反应(图 3),具有良好的反应原性.通过BCA法测定纯化后的蛋白质量浓度约为0.4 mg·mL-1.
|
图 2 重组蛋白的SDS-PAGE电泳分析 Figure 2 Identification of the recombinant protein by SDS-PAGE M:标准蛋白相对分子质量; 1:纯化后的蛋白条带; 2: BL21 (DE3) + pET-gE184(诱导); 3: BL21(DE3) + pET-gE184(未诱导). |
|
图 3 重组蛋白的Western-blot分析 Figure 3 Identification of the recombinant protein by Western-blot M:标准蛋白相对分子质量; 1:纯化后的蛋白条带; 2: BL21 (DE3) + pET-gE184(诱导); 3: BL21(DE3) + pET-gE184(未诱导). |
经过方阵滴定确定重组抗原最佳包被质量浓度为2.5 μg ·mL-1,阴、阳性血清的最佳稀释度为1:200,作用时间为40 min; 最佳封闭液为0.01 g·mL-1BSA,封闭时间为2 h; 二抗的最佳稀释度为1:5 000,作用时间为50 min; 底物最佳显色时间为20 min.
2.4 判定标准的确定用建立的间接gE184-ELISA检测20份阴性血清,计算出平均D450 nm为0.083,标准差SD为0.015,从而计算出阴阳临界值为0.128,因此,若样本D450 nm≥0.128,判定为阳性; 若样本D450 nm<0.128,判定为阴性.
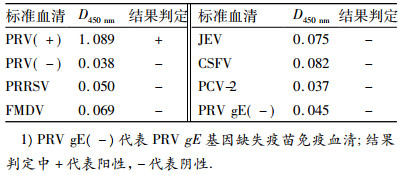
2.5 特异性试验用建立的间接gE184-ELISA方法检测PRV、PRRSV、FMDV、JEV、CSFV、PCV-2标准阳性血清,结果显示除猪伪狂犬病病毒阳性血清为阳性外,其余血清的D450 nm均低于0.128,判定为阴性,表明本试验建立的gE184-ELISA方法对PRV有较好的特异性(表 1).
|
|
表 1 间接gE184-ELISA方法特异性试验1) Table 1 The specificity of indirect gE184-ELISA |
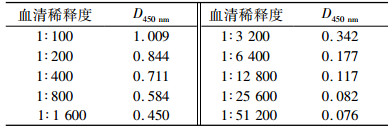
用建立的间接gE184-ELISA方法检测PRV标准阳性血清,当血清稀释1:6 400时,检测结果仍为阳性(D450 nm= 0.177) (表 2),表明建立的方法敏感性良好.
|
|
表 2 间接gE184-ELISA方法敏感性试验 Table 2 The sensitivity of indirect gE184-ELISA |
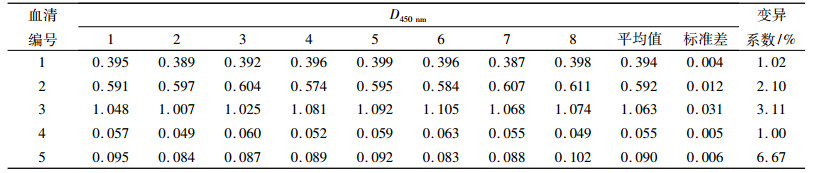
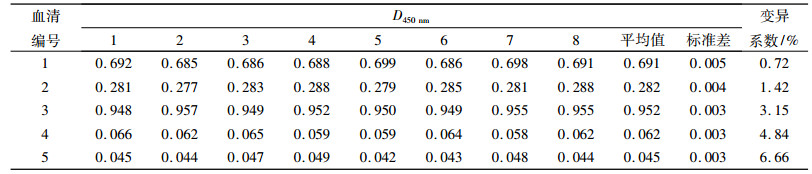
5份血清经建立的间接gE184-ELISA方法进行批内重复性试验,结果(表 3)显示变异系数小于10%,5份血清分别用8块不同批次的酶标板进行批间重复性试验,结果(表 4)显示变异系数小于10%,表明所建立的检测方法具有良好的重复性.
|
|
表 3 间接gE184-ELISA方法批内重复性试验 Table 3 The intra-repeatability of indirect gE184-ELISA |
|
|
表 4 间接gE184-ELISA检测方法批间重复性试验 Table 4 The inter-repeatability of indirect gE184-ELISA |
使用建立的间接gE184-ELISA方法检测不同猪场送检的290份猪血清样本,并与商品化ELISA试剂盒检测结果进行比较(表 5).从表 5中可以看出,用IDEXX ELISA试剂盒检测为阳性的129份血清中,间接gE184-ELISA检出118份阳性,阳性的符合率为91.5% (118 /129); IDEXX ELISA试剂盒检测为阴性的161份血清中,间接gE184-ELISA检出152份阴性,阴性符合率为94.4% (152 /161);间接gE184-ELISA检测方法与IDEXX ELISA试剂盒的总符合率为93.1% [(118 + 152) /290].
|
|
表 5 临床样品检测结果对比1) Table 5 The result of clinical samples by gE184-ELISA and IDEXX ELISA Kit |
PRV基因缺失弱毒疫苗的使用很好地控制了我国伪狂犬病的发生,但从2011年开始,我国不同省份多个猪场先后出现接种PRV基因缺失弱毒疫苗后仍出现疑似伪狂犬病症,主要表现为母猪流产、产弱仔、死胎、仔猪出现神经症状等[8-10].对分离病毒的生物学特性研究显示,新分离毒株与以前分离株遗传关系较远且毒力更强,Bartha-K61弱毒疫苗免疫猪产生的中和抗体对新分离毒株的中和能力较差[8-10],这些都表明病毒可能存在一定的变异,有待作进一步的研究调查.
gE基因是伪狂犬病毒主要毒力相关基因,gE基因缺失的基因工程疫苗是包括我国在内的世界各国广泛使用的弱毒疫苗[11].在欧美等国家,多应用gE基因缺失疫苗配合gE基因鉴别诊断方法来区分自然感染猪和疫苗免疫猪[12],进而逐步实现该病的根除.Fuches等[13]将gE基因若干重叠基因片段在大肠埃希菌中融合表达,用单抗和高免血清检测,gE糖蛋白的N端33位至100位的氨基酸区段为其主要抗原表位区.Jacobs等[6]同样采用若干重叠基因片段在大肠埃希菌中融合表达,并用单抗和高免血清检测发现gE基因的第157 ~ 714位核苷酸区域编码gE糖蛋白的5个主要抗原表位区.通过对gE基因亲水功能区的分析并结合有关的报道[14],本次试验设计引物时剔除蛋白胞内区、跨膜区和信号肽,扩增gE基因的主要抗原表位区,即从54位氨基酸到237位氨基酸.应用大肠埃希菌表达系统表达gE基因主要抗原表位区,并以表达的重组蛋白代替gE全长蛋白建立间接ELISA诊断方法.
本研究建立的gE184-ELISA检测方法具有良好的特异性、敏感性及可重复性,且与IDEXX ELISA试剂盒符合率可达到93.1%,具有良好的应用前景. gE184-ELISA检测方法能很好地鉴别自然感染猪和疫苗免疫猪,因此与gE基因缺失疫苗配合使用,可达到净化PRV的目的.
| [1] |
殷震, 刘景华. 动物病毒学[M]. 北京: 科学出版社, 1997: 988-1009.
(  0) 0) |
| [2] |
JÖNS A, GRANZOW H, KUCHLING R, et al. The UL49.5 gene of pseudorabies virus codes for an O-glycosylated structural protein of the viral envelope[J]. J Virol, 1996, 70(2): 1237-1241. (  0) 0) |
| [3] |
JACOBS L, MULDER W A, VAN OIRSCHOT J, et al. Deleting two amino acids in glycoprotein gI of pseudorabies virus decreases virulence and neurotropism for pigs, but does not affect immunogenicity[J]. J Gen Virol, 1993, 74(Pt10): 2201-2206. (  0) 0) |
| [4] |
VAN OIRSCHOT J T, GIELKENS A J, MOORMANN R J, et al. Marker vaccines, virus protein-specific antibody assays and the control of Aujeszky's disease[J]. Vet Microbiol, 1990, 23(1/2/3/4): 85-101. (  0) 0) |
| [5] |
ELBERS A R W, BRAAMSKAMP J, DEKKERS L J M, et al. Aujeszky's disease virus eradication campaign successfully heading for last stage in The Netherlands[J]. Vet Q, 2000, 22(2): 103-107. DOI:10.1080/01652176.2000.9695034 (  0) 0) |
| [6] |
JACOBS L, MELOEN R H, GIELKENS A L, et al. Epitope analysis of glycoprotein Ⅰ of pseudorabies virus[J]. J Gen Virol, 1990, 71(Pt4): 881-887. (  0) 0) |
| [7] |
孙磊磊, 程艺, 梁梓森, 等. 伪狂犬病毒EPO基因的克隆及其在大肠杆菌中的表达研究[J]. 中国畜牧兽医, 2012, 39(6): 57-60. DOI:10.3969/j.issn.1671-7236.2012.06.013 (  0) 0) |
| [8] |
童武, 张青占, 童光志. 免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J]. 中国动物传染病学报, 2013, 21(3): 1-7. DOI:10.3969/j.issn.1674-6422.2013.03.001 (  0) 0) |
| [9] |
刘洪斌, 张智明, 丁国杰, 等. 猪伪狂犬病毒DQ株的分离鉴定与生物学特性研究[J]. 中国兽药杂志, 2013, 47(9): 14-17. (  0) 0) |
| [10] |
彭金美, 安同庆, 赵鸿远. 猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J]. 中国预防兽医学报, 2013, 35(1): 1-4. DOI:10.3969/j.issn.1008-0589.2013.01.01 (  0) 0) |
| [11] |
HEFFNER S, KOVACS F, KLUPP B G, et al. Glycoprotein gp50-negative pseudorabies virus:A novel approach toward a nonspreading live herpesvirus vaccine[J]. J Virol, 1993, 67(3): 1529-1537. (  0) 0) |
| [12] |
GUT M, JACOBS L, TYBOROWSKA J, et al. A highly specific and sensitive competitive enzyme-linked immunosorbent assay (ELISA) based on baculovirus expressed pseudorabies virus glycoprotein gE and gI complex[J]. Vet Microbiol, 1999, 69(4): 239-249. DOI:10.1016/S0378-1135(99)00115-7 (  0) 0) |
| [13] |
FUCHES W, RZIHA H J, LUKÀCS N, et al. Pseudorabies virus glycoprotein gI:In vitro and in vivo analysis of immunorelevant epitopes[J]. J Gen Virol, 1990, 71(Pt5): 1141-1151. (  0) 0) |
| [14] |
TIRABASSI R S, ENQUIST L W. Role of the pseudorabies virus gI cytoplasmic domain in neuroinvasion, viru lence, and posttranslational N-linked glycosylation[J]. J Virol, 2000, 74(8): 3505-3516. DOI:10.1128/JVI.74.8.3505-3516.2000 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36