猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea vi rus,PEDV)引起的一种高度接触性肠道传染病,以腹泻、呕吐、脱水和对哺乳仔猪高致死率为主要特征[1].PED最初爆发于英国,随后在包括我国在内的世界多个地区爆发流行[2-4].2013年,美国也首次报道了PEDV的存在[5],并呈扩大之势,2014年亦有持续的爆发与流行[6],加之世界各地的流行情况依旧,PED对世界养猪业造成了持续的影响,并导致严重的经济损失.PEDV属于冠状病毒科Coronviridae冠状病毒属Coronavims成员,是有囊膜、不分节段的单股正链RNA病毒,基因组大小约28 kb,全基因组编码至少7个开放阅读框,其中S基因编码的S蛋白,是位于病毒粒子表面的纤突糖蛋白,在病毒侵入宿主细胞和介导中和抗体产生的过程中发挥重要生物学作用[7-8].COE(CO-26K equivalent)基因位于S基因序列的1495~1914 bp位置,COE蛋白是一个重要的抗原表位[9],可作为疫苗与诊断试剂研究的候选蛋白[10].鉴于PED的严重危害,建立一种廉价高效、特异性强的检测方法,对于基层PED的防控十分必要.本研究分别建立了PEDV全病毒和融合表达的COE蛋白间接ELISA检测方法,以期为PED的防控提供参考.
1 材料与方法 1.1 抗原与血清PEDV分离株GD-1株由华南农业大学基因工程实验室分离并保存,融合表达的重组PEDV部分结构蛋白TrxA-COE由华南农业大学基因工程实验室构建、表达及纯化,冻存于- 80 ℃条件下备用.PEDV阳性、阴性血清和疑似PED临床血清样品,及口蹄疫病毒(FMDV)、猪瘟病毒(CSFV)、猪圆环病毒(PCV)和猪繁殖与呼吸综合征病毒(PRRSV)阳性血清均由广东省温氏研究院惠赠.
1.2 主要试剂兔抗猪IgG辣根过氧化物酶标记抗体、BSA等为广州美津生物技术有限公司产品,底物TMB为广州健阳生物科技有限公司产品.
1.3 纯化PEDV全病毒ELISA方法的建立 1.3.1 抗原最佳包被浓度与抗体最佳稀释度的确定采用点阵滴定法,将70.00 μg·mL-1的PEDV全病毒抗原2倍梯度稀释至2 -5倍,并与不同稀释度(1:40、1:80、1:160、1:320、1:640、1:1 280)的血清组成方阵,计算P/N值,确定抗原最佳包被浓度与抗体最佳稀释度.
1.3.2 封闭液和稀释液的选择以最适抗原浓度包被,分别以10 g·L-1的BSA、50 g·L-1的脱脂奶粉和体积分数为10%的胎牛血清作为封闭液,以1 g·L-1的BSA、10 g·L-1的脱脂奶粉和体积分数为5%的胎牛血清作为稀释液,对3个不同样品分别进行3次测定,计算P/N值,以选择最适的封闭液和稀释液.
1.3.3 酶标二抗最佳工作浓度的确定以选定的最适条件包被、封闭,加入最佳稀释度的标准阳性和阴性血清,将酶标二抗作系列稀释(1:500、1:1 000、1:2 000、1:3 000、1:5 000、1:10 000),确定酶标二抗的最佳工作浓度.
1.3.4 抗体与酶标二抗最佳孵育时间的确定按最适条件操作,抗原抗体反应时间、抗原抗体复合物与酶标二抗反应时间分3组(30、30 min)、(60、60 min)、(90、90 min)进行,同一样品进行3次测定,计算P/N值,确定最佳抗原抗体反应时间及抗原抗体复合物与酶标二抗反应时间.
1.4 纯化TrxA-COE融合蛋白ELISA方法的建立抗原最佳包被浓度与抗体最佳稀释度的确定:采用点阵滴定法,将35.00 μg·mL-1的TrxA-COE重组抗原2倍梯度稀释至2 -5倍,并与不同稀释度(1:40、1:80、1:160、1:320、1:640、1:1 280)的血清组成方阵,计算P/N值,确定抗原、抗体的最佳稀释度.
其他反应条件的优化方法与PEDV全病毒ELISA方法的优化方法一致.
1.5 判断标准的确定结果判定按照P/N≥2.1的样品判定为阳性; 1.5≤P/N<2.1的样品判定为可疑; P/N<1.5的样品判定为阴性.
1.6 重复性试验针对建立的2种不同的ELISA方法,分别随机抽取6份待检血清,以确定的最适条件进行6次重复检测,计算检测结果的变异系数.
1.7 特异性试验针对建立的2种不同的ELISA方法,分别以确定的最适条件进行反应,分别加入FMDV、CSFV、PCV和PRRSV阳性血清,以及PEDV阳性、阴性血清进行检测,确定检测方法的特异性.
1.8 保存期及稳定性试验针对建立的2种不同的ELISA方法,分别将制备好的5块酶标板于4 ℃条件下保存0、15、30、90、180 d,取6份血清样品(4份阳性,2份阴性)进行检测,以确定其保存期及稳定性.
1.9 临床应用试验针对建立的2种不同的ELISA方法,分别对收集的广东省多个地区223份血清样品进行检测,以此对新建立的间接ELISA方法作初步应用效果评价,了解广东地区猪场PEDV血清抗体阳性率,并比较2种方法的符合率.
2 结果 2.1 纯化PEDV全病毒ELISA最适条件纯化后的PEDV全病毒蛋白质量浓度为2.8 mg·mL-1.经间接ELISA反应条件的优化,确定PEDV全病毒抗原最佳稀释度为1:160,最佳包被质量浓度为17.5 μg·mL-1; 最佳封闭液为10 g·L-1的BSA,抗体最佳稀释液为1 g·L-1的BSA; 血清抗体最佳稀释度为1:160;酶标二抗最佳稀释倍数为1:5 000;一抗与酶标二抗的最佳孵育时间均为60 min.
2.2 纯化TrxA-COE融合蛋白ELISA最适条件纯化后的TrxA-COE融合蛋白质量浓度为0.7mg·mL-1.经间接ELISA反应条件的优化,确定TrxA-COE抗原最佳稀释度为1:40,最佳包被质量浓度为17.5 μg·mL-1; 最佳封闭液为10 g·L-1的BSA,抗体最佳稀释液为1 g·L-1的BSA; 血清抗体最佳稀释度为1:160;酶标二抗最佳稀释倍数为1:5 000;一抗与酶标二抗的最佳孵育时间均为60 min.
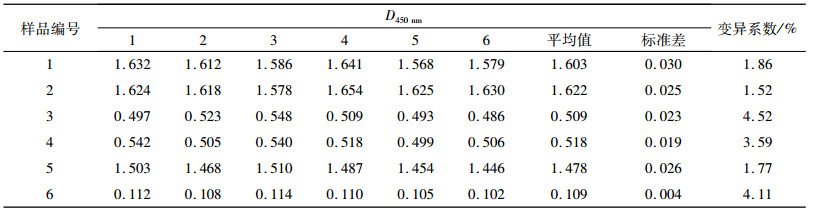
2.3 重复性试验结果 2.3.1 纯化PEDV全病毒ELISA方法重复性试验结果纯化PEDV全病毒ELISA方法重复性试验结果(表 1)显示变异系数均小于4.60%,表明该方法具有良好的重复性.
|
|
表 1 纯化PEDV全病毒ELISA方法重复性试验结果 Table 1 Results of the repeated test of PEDV ELISA |
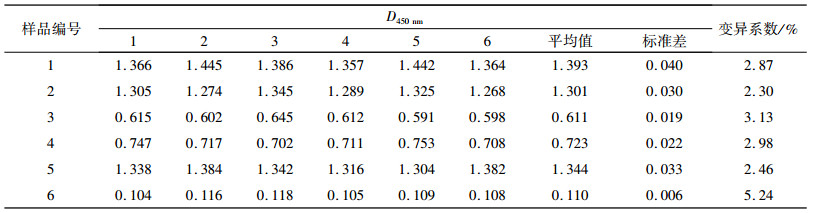
纯化TrxA-COE融合蛋白ELISA方法重复性试验结果(表 2)显示变异系数均小于5.30%,表明该方法重复性良好.
|
|
表 2 纯化TrxA-COE融合蛋白ELISA方法重复性试验结果 Table 2 Results of the repeated test of TrxA-COE ELISA |
用已知阳性的FMDV、CSFV、PCV、PRRSV参考血清和PEDV阳性及阴性血清进行纯化PEDV全病毒ELISA交叉反应,除PEDV阳性血清呈阳性外,其他5种血清均呈阴性,表明所建立的方法具有较好的特异性.
2.4.2 纯化TrxA-COE融合蛋白ELISA方法特异性试验结果用已知阳性的FMDV、CSFV、PCV、PRRSV参考血清和PEDV阳性及阴性血清进行纯化TrxA-COE融合蛋白ELISA交叉反应,除PEDV阳性血清呈阳性外,其他5种血清均呈阴性,表明所建立的方法具有较好的特异性.
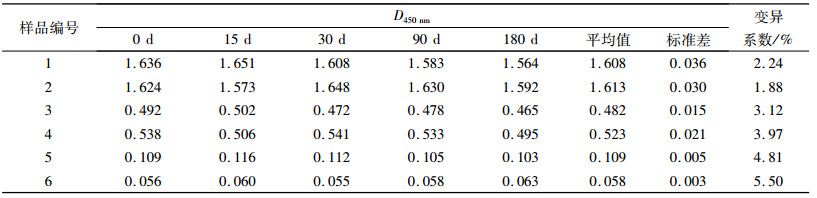
2.5 保存期及稳定性试验结果 2.5.1 纯化PEDV全病毒ELISA方法保存期及稳定性试验结果将纯化PEDV全病毒包被的5块酶标板于4 ℃条件保存,放置0、15、30、90、180 d后检测,6份血清样品(4份阳性,2份阴性)检测结果如表 3,结果显示此方法的稳定性良好,保存期至少可达180 d.
|
|
表 3 纯化PEDV全病毒ELISA方法保存期及稳定性试验结果 Table 3 Results of the storage life and stability test of PEDV ELISA |
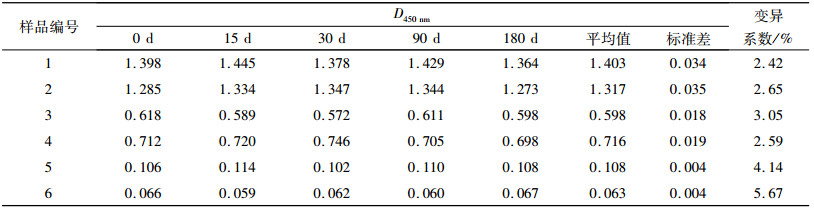
将纯化TrxA-COE融合蛋白包被的5块酶标板于4 ℃条件保存,放置0、15、30、90及180 d后检测,6份血清样品(4份阳性,2份阴性)检测结果如表 4,结果同样显示出此方法良好的稳定性和较长的保存期.
|
|
表 4 纯化TrxA-COE融合蛋白ELISA方法保存期及稳定性试验结果 Table 4 Results of the storage life and stability test of TrxA-COE ELISA |
应用本研究建立的PEDV全病毒抗原ELISA检测方法,检测了采集于广东省多个地区不同时间、不同猪场、不同日龄的223份血清,血清样品总阳性率为97.3% (217 /223);应用本研究建立的TrxA-COE抗原ELISA检测方法,检测了同样的223份血清,血清样品总阳性率为98.6% (220 /223).2种方法检测的阳性率均较高且相近,说明所建立的2种ELISA方法均具有良好的检出率和很高的符合率.
3 讨论PEDV在被发现后直至今日,不但没有被有效控制,反而成了影响全世界养猪业的重大疾病,造成巨大的经济损失.然而目前对于PED仍没有有效的治疗手段[11],疫苗预防是主要的措施,这就需要快速高效的检测技术对疫情进行监控,以及对免疫猪群的抗体水平进行检测,从而制定合理的免疫程序.然而,猪流行性腹泻在临床症状上很难与猪传染性胃肠炎、轮状病毒病和大肠埃希菌病等区分,容易导致误诊,目前较快捷、可批量检测的诊断方法主要有ELISA和RT-PCR等方法,ELISA方法不受PCR仪等仪器设备的限制,有利于在临床检测中推广[12].本研究以华南农业大学基因工程实验室分离的PEDV野毒株GD-1株细胞毒灭活纯化后的全病毒作为包被抗原,建立了一种间接ELISA抗体检测方法,具有较高的特异性、较好的稳定性和重复性,以及较高的临床样品检出率.但全病毒抗原由于受病毒培养和纯化等方面的技术限制,存在制备过程繁琐、成本高、易散毒及纯化难度较大等缺点[13],因此本试验又根据PEDV引起机体产生抗体的特性,采用大肠埃希菌表达了S蛋白的核心抗原COE蛋白,并利用此重组融合蛋白作为包被抗原,建立了另一种间接ELISA抗体检测方法.2种方法对临床样品检测的阳性率相近,说明所建立的2种ELISA方法均具有良好的检出率和很高的符合率,为PEDV的血清学抗体检测提供了简易高效的方法,具有临床应用价值.同时,这一检测结果也反映了我们的样品收集地区PED防控的严峻形势,加强对该病的监控和免疫预防任务艰巨.
| [1] |
PENSAERT M B, DE BOUCK P. A new coronavirus-like particle associated with diarrhea in swine[J]. Arch Virol, 1978, 58(3): 243-247. DOI:10.1007/BF01317606 (  0) 0) |
| [2] |
TAKAHASHI K, OKADA K, OHSHIMA K. An outbreak of swine diarrhea of a new-type associated with coronavirus-like particles in Japan[J]. Nihon Juigaku Zasshi, 1983, 45(6): 829-832. DOI:10.1292/jvms1939.45.829 (  0) 0) |
| [3] |
SUN R Q, CAI R J, CHEN Y Q, et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China[J]. Emerg Infect Dis, 2012, 18(1): 161-163. DOI:10.3201/eid1801.111259 (  0) 0) |
| [4] |
SONG D, PARK B. Porcine epidemic diarrhoea virus:A comprehensive review of molecular epidemiology, diagnosis, and vaccines[J]. Virus Genes, 2012, 44(2): 167-175. DOI:10.1007/s11262-012-0713-1 (  0) 0) |
| [5] |
HUANG Y W, DICKERMAN A W, PINEYRO P, et al. Origin, evolution, and genotyping of emergent porcine epidemic diarrhea virus strains in the United States[J]. MBio, 2013, 4(5): e00737-13. (  0) 0) |
| [6] |
WANG L, BYRUM B, ZHANG Y. New variant of porcine epidemic diarrhea virus, United States, 2014[J]. Emerg Infect Dis, 2014, 20(5): 917-919. DOI:10.3201/eid2005.140195 (  0) 0) |
| [7] |
KOCHERHANS R, BRIDGEN A, ACKERMANN M, et al. Completion of the porcine epidemic diarrhoea coronavirus (PEDV) genome sequence[J]. Virus Genes, 2001, 23(2): 137-144. DOI:10.1023/A:1011831902219 (  0) 0) |
| [8] |
KANG T J, SEO J E, KIM D H, et al. Cloning and sequence analysis of the Korean strain of spike gene of porcine epidemic diarrhea virus and expression of its neutralizing epitope in plants[J]. Protein Expr Purif, 2005, 41(2): 378-383. DOI:10.1016/j.pep.2005.02.018 (  0) 0) |
| [9] |
CHANG S H, BAE J L, KANG T J, et al. Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J]. Mol Cells, 2002, 14(2): 295-299. (  0) 0) |
| [10] |
董丽娜, 高凤山, 许崇波, 等. 表达猪流行性腹泻病毒COE基因的重组乳酸菌的构建与鉴定[J]. 畜牧兽医学报, 2008, 39(12): 1743-1747. DOI:10.3321/j.issn:0366-6964.2008.12.018 (  0) 0) |
| [11] |
KEHRLI M E, STASKO J, LAGER K M. Status report on porcine epidemic diarrhea virus in the United States[J]. Anim Front, 2014, 4(1): 44-45. DOI:10.2527/af.2014-0006 (  0) 0) |
| [12] |
SUO S, REN Y, LI G, et al. Immune responses induced by DNA vaccines bearing Spike gene of PEDV combined with porcine IL-18[J]. Virus Res, 2012, 167(2): 259-266. DOI:10.1016/j.virusres.2012.05.007 (  0) 0) |
| [13] |
吴忆春. 猪繁殖与呼吸综合征病毒重组M蛋白间接ELISA抗体检测方法的建立及应用[J]. 中国畜牧兽医, 2013, 40(7): 51-55. DOI:10.3969/j.issn.1671-7236.2013.07.013 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36