二甲氧苄啶(Diaveridine,DVD),商品名敌菌净, 化学名2,4-二氨基-5-(3',4'-二甲氧基苄基)嘧啶[1].二甲氧苄啶具有广谱抗菌作用,对多数革兰阳性菌和阴性菌有效,包括大肠埃希菌、梭菌属、沙门菌、巴氏杆菌属、金黄色葡萄球菌、炭疽杆菌等,对肺炎链球菌、淋病奈瑟菌、脑膜炎奈瑟菌的抗菌作用不明显,对铜绿假单胞菌无作用,单独使用容易引起耐药性[2-3].二甲氧苄啶为化学合成的动物专用抗菌增效剂,一般不单独使用,常与磺胺类药物联合应用[4].由于抗菌增效剂与磺胺类药物是对细菌或虫体叶酸代谢途径中2个不同的位点产生阻断作用[5],两者连用,使磺胺类药物的药效显著增强,降低两药的用量,减少毒副作用的发生,可用于防治鸡球虫、鸡白痢、禽霍乱及仔猪白痢[6].二甲氧苄啶与磺胺类药物合用的注册制剂使用广泛[7-8],但却没有明确的使用规定和安全标准, 食品残留专家委员(JECFA)会和欧洲药品局(EMEA)等也均未对二甲氧苄啶进行过任何评价[9].在我国,关于二甲氧苄啶在食品动物体内的动力学与残留研究甚少,本文建立了二甲氧苄啶在猪组织中的高效液相色谱检测方法,研究了二甲氧苄啶在猪体内的残留消除规律,为二甲氧苄啶在兽医临床上的用药和制定休药期提供理论参考.
1 材料与方法 1.1 仪器和试剂高效液相色谱仪:美国Dionex公司, Ultimate 3000系列,配备自动进样器,四元泵,在线脱气泵,柱温箱,紫外检测器,Chromeleon色谱工作站.电子分析天平:日本/岛津AUW120D型,精度0.001 mg.超纯水系统:美国Millipore公司,Milli-Q型.高速冷冻离心机:美国Beckman-Coulter公司, Avanti® J-26 XP型.移液器:德国Eppendorf公司,Eppendorf Re search型,20~200、100~1 000、1 000~5 000 μL. MCX固相萃取柱:安普公司.
二甲氧苄啶标准品(质量分数99.8%, 批号H0311108),购自中国兽医药品监察所.二甲氧苄啶原料药,由大华农动物保健有限公司提供.甲醇、乙腈为色谱纯,OCEANPAK公司产品; 乙酸乙酯、甲醇、为国产分析纯.
1.2 二甲氧苄啶标准溶液配制准确称取10.02 mg二甲氧苄啶对照品于10 mL容量瓶中,用甲醇溶解、定容,得到1 mg·mL-1的标准储备液,置于-20 ℃冰箱中保存.临用前用乙腈-磷酸二氢钾缓冲盐溶液[V(乙腈):V(磷酸二氢钾) =16:84]配成0.5、1.0、2.5、5.0、10.0、25.0、50.0、100.0 μg·mL-1的系列质量浓度的二甲氧苄啶标准工作液.
1.3 动物试验与采样32头健康猪,2头为空白对照,其余的随机分为6组.按体质量以5 mg·kg-1剂量混饲给药,每天给药2次,连续给药7 d,分别在给药后第6、24、96、168、240和336小时宰杀1组猪,分别采集每头猪的肌肉、肝脏、肾脏和脂肪组织,做好标记、匀浆,保存于-20 ℃冰箱,待测.
1.4 样品测定 1.4.1 组织样品前处理准确称取匀浆组织样品各1.0 g,置于15 mL离心管中,加入2 mL KOH溶液(2 mol·L-1)调节pH,然后加入5 mL乙酸乙酯涡旋混匀,超声10 min,振荡10 min,于4 ℃条件下8 000 r·min-1离心10 min,转移上清液,残渣用乙酸乙酯重复提取1次,合并上清液,将上述合并提取液过Anpel MCX固相萃取小柱进行净化,最后以5 mL体积分数为4%氨化甲醇洗脱,洗脱液于40 ℃条件下氮气吹干, 加1 mL的流动相溶液复溶, 复溶液过0.22 μm滤膜,进行HPLC测定.
1.4.2 液相色谱条件色谱柱: Hypersil BDS C18柱(4.6 mm ×250 mm,5 μm); 流动相:乙腈-磷酸二氢钾溶液[pH =3,V(乙腈) : V(磷酸二氢钾) = 16:84];检测波长:二甲氧苄啶的最大吸收波长为240 nm; 柱温: 25 ℃; 流速: 1.0 mL·min-1; 进样量: 20 μL.
1.4.3 检测限和定量限准确称取1.0 g空白匀浆组织于15 mL离心管中,分别加入100 μL不同质量浓度的二甲氧苄啶标准工作液,旋涡混匀,使得样品中二甲氧苄啶质量分数分别为20、25、30、35、40、50 μg·kg-1,每个质量分数做5个重复,按照“1.4.1”方法处理样品,“1.4.2”HPLC条件进行检测.以信噪比(S/N)>3的最低浓度作为方法的检测限,以S/N>10的最低浓度作为方法的定量限.
1.4.4 标准曲线与线性范围准确称取1.0 g空白试样于15 mL离心管中,加入100 μL二甲氧苄啶标准系列溶液,旋涡混匀,静置30 min,使得样品中二甲氧苄啶质量分数为40、50、100、250、500、1 000 μg·kg-1.按照组织样品提取净化方法处理后,进行HPLC测定.将二甲氧苄啶的色谱峰面积(A)与相对应的药物浓度(C)作线性回归,求得标准曲线方程和相关系数.
1.4.5 回收率和变异系数准确称取1.0 g空白试样于15 mL离心管中,将一定量的二甲氧苄啶标准液旋涡混匀,制得低、中、高3个浓度水平的样品,静置30 min, 按组织样品提取净化方法处理, 进行HPLC测定.每个浓度设5个重复,共做3个批次,计算不同组织中二甲氧苄啶的回收率和变异系数.
2 结果与分析 2.1 方法学验证在本试验建立的二甲氧苄啶检测条件下, 药物色谱峰形较佳,与组织中其他组分分离良好,二甲氧苄啶在猪肌肉、肝脏、肾脏、脂肪中的检测限为20 μg·kg-1,定量限为40 μg·kg-1,保留时间5.5 min左右; 猪组织中二甲氧苄啶在40~1 000 μg·kg-1范围内呈现良好的线性关系(r>0.99).二甲氧苄啶在猪不同组织中的回收率在66.97%~84.20%,批内变异系数在3.63%~9.34%, 批间变异系数在5.07%~7.07%.该方法能够满足二甲氧苄啶在猪可食性组织中的残留检测要求.
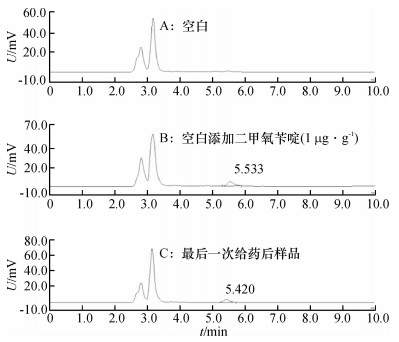
2.2 色谱图由图 1可见,在本研究建立的色谱条件下,二甲氧苄啶与其他组分分离良好,保留时间在5.5 min左右.
|
图 1 猪肾脏中二甲氧苄啶色谱图 Figure 1 Chromatograms of diaveridine in the pig kidney |
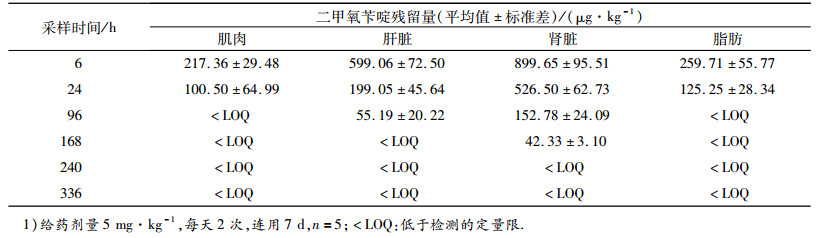
将冷冻组织样品自然解冻,根据“1.4”建立的方法,对不同屠宰时间采集的肌肉、肝脏、肾脏和脂肪组织分别进行测定,以测得的组织样品药物峰面积代入标准曲线计算出药物浓度.具体见表 1.结果显示:二甲氧苄啶在肾脏的残留量最高,其次为肝脏、脂肪和肌肉,说明二甲氧苄啶主要经肾脏代谢.停药后0 d,二甲氧苄啶在上述4种组织内的质量分数均低于40 μg·kg-1(方法的定量限为40 μg·kg-1),二甲氧苄啶在4种组织中残留量持续时间长短为肾脏>肝脏>脂肪>肌肉.
|
|
表 1 猪口服二甲氧苄啶后组织中残留量1) Table 1 Mean residues in pig tissues afteroral administration of diaveridine |
由于我国目前还没有制定二甲氧苄啶动物可食性组织中的最高残留限量,日本肯定列表规定二甲氧苄啶在禽组织中的最大残留限量(MRLs)为50 μg·kg-1,根据此规定,本试验暂定二甲氧苄啶的最高残留限量为50 μg·kg-1,根据试验所得组织药物浓度-时间数据采用WT1.4软件处理, 计算出肌肉、脂肪、肾脏、肝脏的休药期分别为4.78、5.26、7.61、6.75 d.根据计算结果建议二甲氧苄啶在猪体内的休药期为8 d.
3 讨论与结论二甲氧苄啶是弱碱性化合物,调节pH使组分在水相中处于中性分子状态或达到两性分子的等电点,水溶性降低,易被有机溶剂萃取,而且乙酸乙酯和二甲氧苄啶的极性相近[10],基于以上原理,选用乙酸乙酯作为提取液,结果表明提取效率较高.对于基质复杂的样品,单纯的液液萃取很难确保分析时排除样品基质干扰, 王炼等[11]、蒋原等[12]均使用MCX固相萃取小柱来达到净化的目的,经试验确定采用Anpel MCX固相萃取小柱净化.二甲氧苄啶在动物组织中残留检测方法目前主要有同位素示踪和色谱法,本研究建立了猪组织中二甲氧苄啶残留量的高效液相色谱检测方法,组织样品采用乙酸乙酯沉淀蛋白质,经MCX固相萃取小柱净化,用高效液相色谱检测,该方法取得较好的回收率,能满足猪组织中二甲氧苄啶残留检测的要求.
休药期是指食品动物从停止给药到许可屠宰或动物产品(奶、蛋))许可上市的间隔时间.最高残留限量(MRLs)即药物或其他外源化合物从用药动物体内排出或减少到人在使用其组织或产品后不会危害人体健康的药物浓度.在食品安全评价中,药物在试验动物以及靶动物中的代谢和残留研究处于核心地位,通过对其在动物体内的吸收、分布、排泄和代谢的研究,结合毒理学研究的结果,可以确定其残留靶组织和残留标示物,制定其残留限量等标准,制定该药的休药期,从而更好地指导临床合理用药,避免药物残留,保障人类的食品安全.
我国农业部尚未制定二甲氧苄啶动物可食性组织中的最高残留限量,日本肯定列表规定二甲氧苄啶在禽肌肉、脂肪、肝脏、肾脏等组织中最高残留限量均为50 μg·kg-1[13],我国农业部和欧盟等都对二甲氧苄啶的同类药物甲氧苄啶(TMP)在动物组织中的最高残留限量做出了规定,我国规定甲氧苄啶的标志残留物是其原型药物,其在牛、猪和禽的肌肉、肝脏、肾脏、脂肪中的最大残留限量为50 μg·kg-1; 在马的肌肉、肝脏、肾脏、脂肪中的最大残留限量为100 μg·kg-1[14].因此,本试验按照二甲氧苄啶在猪体内的最高残留限量为50 μg·kg-1计算二甲氧苄啶在猪的休药期.
试验结果表明:猪内服二甲氧苄啶(按体质量5 mg·kg-1,每天2次,连用7 d)后,二甲氧苄啶在猪体内消除较快,肾脏中二甲氧苄啶的质量分数于第10天低于检测方法的定量限(40 μg·kg-1),肝脏、脂肪、肌肉依次在第7、4、4天低于40 μg·kg-1.文丽华[15]应用放射性同位素示踪技术研究了二甲氧苄啶在猪、鸡和大鼠体内的分布和残留消除规律,结果表明,二甲氧苄啶在肾脏及肝脏中的残留量持续时间长于肌肉和脂肪中的残留量.郝增坤[16]通过磺胺氯吡嗪钠、二甲氧苄啶溶液在鸡体内的残留消除试验也表明,二甲氧苄啶在肾脏和肝脏中的残留持续时间最长,其次为肌肉和脂肪.根据在猪体内的消除规律研究数据,结合WT1.4休药期软件计算结果,建议二甲氧苄啶按体质量以5 mg·kg-1内服(每天2次,连用7 d)时在猪体内的休药期为8 d.
| [1] |
陈丽, 杨长志, 刘永, 等. 高效液相色谱法测定动物源性食品中敌菌净残留量[J]. 化学工程师, 2008, 159(12): 50-53. DOI:10.3969/j.issn.1002-1124.2008.12.017 (  0) 0) |
| [2] |
凌明亮. 氟甲砜霉素及抗菌增效剂对早期断奶仔猪的联合效应[J]. 当代畜牧, 2005(12): 45-47. (  0) 0) |
| [3] |
YOSHIMURA H. Mutagenicity of the coccidiostat diaveridine in the Salmonella/mammalian microsome assay[J]. Mutat Res, 1991, 261(2): 149-152. DOI:10.1016/0165-1218(91)90061-P (  0) 0) |
| [4] |
吕惠序. 猪场如何正确使用磺胺类药物及抗菌增效剂[J]. 兽医导刊, 2012(2): 42-45. DOI:10.3969/j.issn.1673-8586.2012.02.017 (  0) 0) |
| [5] |
王国永, 赵振升, 张可煜, 等. 甲氧苄啶、二甲氧苄啶与磺胺氯吡嗪钠联用的抗球虫效果比较[J]. 中国家禽, 2008, 30(8): 27-29. (  0) 0) |
| [6] |
苏士佳. 二甲氧苄啶对Wistar大鼠的毒理学研究[D]. 武汉: 华中农业大学, 2011.
(  0) 0) |
| [7] |
顾春海. DVD与SD治疗猪弓形体病的效果观察[J]. 江苏农业科学, 1979(4): 59-61. (  0) 0) |
| [8] |
曹殿军, 刘宝全, 田雅君. 几种常用药物对自然感染IBDV雏鸡死亡率的影响[J]. 中国畜禽传染病, 1995(4): 57-58. (  0) 0) |
| [9] |
ONO T, SEKIYA T, TAKAHASHI Y, et al. The genotoxicity of diaveridine and trimethoprim[J]. Environ Toxicol Pharmacol, 1997, 3(4): 297-306. DOI:10.1016/S1382-6689(97)00026-4 (  0) 0) |
| [10] |
林海丹, 林峰, 吴映璇. 高效液相色谱法测定动物源性食品中甲氧苄胺嘧啶药物残留[J]. 检验检疫科学, 2003, 13(5): 5-6. DOI:10.3969/j.issn.1674-5354.2003.05.002 (  0) 0) |
| [11] |
王炼, 杨元, 高玲, 等. 动物性食品中11种兽药残留量的高效液相色谱(HPLC)法测定[J]. 中国卫生检验杂志, 2004, 14(3): 276-278. DOI:10.3969/j.issn.1004-8685.2004.03.006 (  0) 0) |
| [12] |
蒋原, 沈崇钰, 姚义刚, 等. 动物源性食品中磺胺类药物增效剂残留的高效液相色谱-串联质谱法测定[J]. 分析测试学报, 2009, 28(7): 834-837. DOI:10.3969/j.issn.1004-4957.2009.07.016 (  0) 0) |
| [13] |
罗浩师. 动物性食品中甲氧苄啶和二甲氧苄啶残留量的测定[D]. 北京: 中国农业科学院, 2013.
(  0) 0) |
| [14] |
中华人民共和国农业部. 中华人民共和国农业部公告: 第235号: 动物性食品中兽药最高残留限量[EB/OL]. [2014-04-15]. http://www.moa.gov.cn/zwllm/tzgg/gg/200302/t20030226_59300.htm.
(  0) 0) |
| [15] |
文丽华. 二甲氧苄啶在猪、鸡和大鼠体内的处置研究[D]. 武汉: 华中农业大学, 2013.
(  0) 0) |
| [16] |
郝增坤. 磺胺氯吡嗪钠-二甲氧苄啶溶液在鸡的残留消除研究[D]. 扬州: 扬州大学, 2012.
(  0) 0) |
 2015, Vol. 36
2015, Vol. 36