重金属污染日益严重,已经成为全球性的环境问题[1],研究重金属在植物体内的亚细胞分布及化学形态的特征,有助于了解植物对重金属的富集和解毒机制,植物对重金属的抗性可通过避性和耐性2种途径来实现[2].而对重金属的耐性,又包括排斥(Exclusion)和富集(Accumulation) 2种途径,前者指重金属被植物吸收后又被排出体外,或者重金属在植物体内的运输受阻; 后者主要指重金属在植物体内以不具生物活性的解毒形态存在,如结合到细胞壁、进入液泡、与有机酸或蛋白质络合等[3].有研究发现铅大部分存在于侧柏和国槐2种树种叶片细胞内的细胞壁上[4]. Graz等[5]研究秋茄Kandelia obovata Yong幼苗中白腐菌(White-rot fungus) Pb等金属亚细胞分布顺序为:细胞壁 > 可溶部分 > 细胞核.小白菜根系、叶片和叶柄细胞中可溶性成分Cd含量均较高,表明细胞内Cd主要积累于液泡中[6].已有研究表明重金属经过植物吸收、转运后,会以不同的化学结合形态存在于不同的器官组织中,借以限制其在植物体内的移动,从而减轻其对植物的毒害[7-8].
大花萱草Hemerocallis fulva和金娃娃萱草Hemerocallis×hybrida‘stella deoro’都是较好的观赏花卉,应用价值很高,且对重金属均有一定的耐性,但是在重金属污染研究方面鲜见报道,因此,本试验选取大花萱草和金娃娃萱草为材料,研究铅镉胁迫下其体内铅镉的组织分布和亚细胞分布及形态,旨在揭示铅镉在这2种植物中的生物化学行为及迁移转化规律,以期为植物修复重金属污染提供参考依据.
1 材料与方法 1.1 材料及处理2013年5月初于吉林农业大学基地采集大花萱草、金娃娃萱草,选取长势一致且健康的种苗进行盆栽控制试验,以园土+草炭+珍珠岩(质量比6: 3: 1)作为盆栽基质,土壤样品采回后经自然风干、磨碎、过筛、混匀,盆直径12 cm、高21 cm,装土3.5 kg,盆下垫托盘.每盆1株苗木,设置1个对照处理,每个处理20个重复,5月底对各供试材料进行土壤Pb (600 mg· kg-1)、Cd(40 mg·kg-1)污染处理,将分析纯Pb(NO3) 2配制成105 g·L-1、CdCl2·2.5H2O配制成7 g·L-1的污染溶液各1 L,用针头在每个处理盆土壤中注入20 mL污染溶液,根据每盆土壤水分状况,定期浇水,使持水量保持在60%.为了排除因人为原因改变土壤性状带来的误差,试验过程中未加入化肥、有机肥等肥料物质.
1.2 萱草对Pb、Cd的吸收特性在加入重金属后按0、8、16、24、32、40 d的时间间隔收获植株,沿土面剪取植株地上部,将地上部和根系分别用自来水和去离子水冲洗干净,沥去水分后,先在105℃下杀青30 min,然后于70℃烘至恒质量,磨碎并充分混匀. Pb、Cd含量采用浓HNO3- HClO4(体积比为5: 1)法消化、用石墨炉原子吸收分光光度计测定.
1.3 Pb、Cd在萱草体内细胞分布研究在加入重金属培养64 d后,分离植株地上、地下部分,采用差速冷冻离心法,参考文献[9-10]的方法稍作改进.准确称取鲜样0.400 0 g于预冷的研钵中,加入在4℃下预冷的8 mL提取剂[0.25 mol·L-1蔗糖+ 50 mmol · L-1 Tris-HCl缓冲液(pH 7.5) + 1.0 mmol·L-1二硫赤鲜糖醇],将研磨成的匀浆倒入10 mL的离心管中,在冷冻离心机上以4 000 r·min-1的转速离心10 min,将上清液分离,离心管中的沉淀再按以上方法提取2次后,下层沉淀即为细胞壁及其破碎残渣部分(F1);将3次离心提取得到的上清液合并于16 000 r·min-1冷冻离心40 min,下层沉淀为细胞膜及细胞器部分(F2);上清液则为液泡及细胞可溶性部分(F3).全过程均在4℃下进行.
1.4 萱草体内Pb、Cd化学形态研究在加入重金属64 d后,用化学试剂逐步提取法,对植株地上、地下部分Pb、Cd的化学形态进行分析,参考文献[11]的方法稍加改进.准确称取鲜样1.000 0 g于研体中,加入10 mL提取剂,将研磨成的匀浆转入20 mL离心管中,在25℃下恒温振荡22 h后,于4 000 r·min-1的转速离心15 min.将上清液分离,向离心管的沉淀中再加入5 mL的提取剂,在25℃恒温振荡1 h后,于4 000 r·min-1的转速离心15 min.合并2次离心后的上清液于20 mL的容器中,采用下列5种提取剂依次逐步提取: φ为80%乙醇溶液,去离子水,1 mol·L-1氯化钠溶液,φ为2%醋酸溶液,0.6 mol · L-1盐酸溶液,最后为残留态.
将差速离心法及化学试剂逐步提取法分离的上清液和沉淀于电热板上70℃蒸发至近干后,加入浓硝酸+高氯酸(体积比5: 1)的混合液5 mL进行消煮直至溶液澄清,然后用少量去离子水定容后用石墨炉原子吸收测定仪测定Pb、Cd含量.
1.5 数据分析用Excel和DPS软件进行数据统计和方差分析.
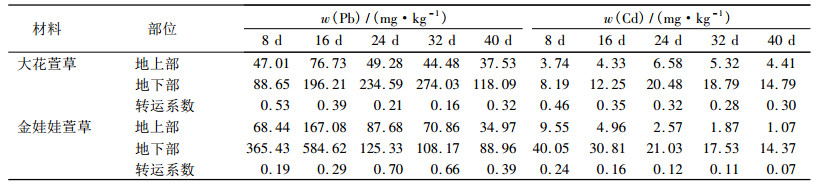
2 结果与分析 2.1 萱草对Pb、Cd的吸收特性由表 1可知,大花萱草随Pb、Cd处理时间的延长,Pb、Cd含量均先升高后下降; Pb、Cd的吸收过程中均出现1个峰值,但是有一定的差异.大花萱草的地上部Pb积累在第16天达到最大值,而地下部在第32天达到最大值,分别为76.73和274.03 mg·kg-1; Cd积累量在第24天时达到最大,地上部和地下部分别为6.58和20.48 mg·kg-1.金娃娃萱草地上部和地下部Pb积累在第16天达到最大值,分别为167.08和584.62 mg·kg-1; 地上、地下部Cd积累均在第8天最多,为9.55和40.05 mg·kg-1.金娃娃萱草积累Pb、Cd的最大值均比大花萱草大. 2种植物地下部Pb、Cd含量总体高于地上部.
转移系数(Translocation factor,TF)是指地上部与地下部同种重金属元素含量的比值[12],用来评价植物将重金属从地下向地上部运输和富集的能力.转移系数越大,则重金属从根系向地上部器官转运能力就越强.由表 1可见,随着Pb、Cd处理时间的增加,2种萱草对Pb、Cd的转运系数变化不一致.大花萱草对Pb、Cd的转运系数均有逐渐减小的趋势,最大值均为处理后第8天,分别为0.53和0.46.金娃娃萱草对Pb的转运系数呈先升高后降低的趋势,在第24天时最大为0.70;对Cd的转运系数呈减小趋势,最大值出现在第8天,为0.24.
|
|
表 1 不同Pb、Cd处理时间对2种萱草Pb、Cd含量的影响 Table 1 Pb and Cd contents of two types of Hemerocallis plants after different treatment time |
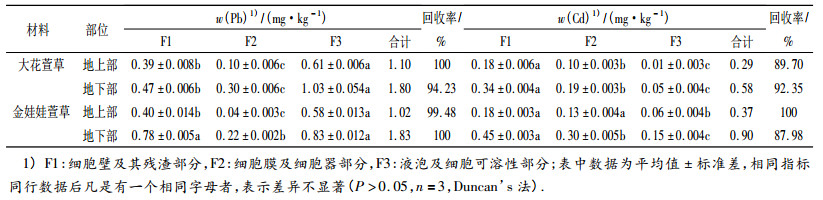
由表 2可知: 2种萱草地上、地下部亚细胞Pb含量均为:液泡及细胞可溶性部分 > 细胞壁及其残渣部分 > 细胞膜及细胞器部分.大花萱草地上、地下部的细胞可溶性部分和细胞器Pb含量均高于金娃娃萱草; 而金娃娃萱草地上、地下部细胞壁Pb含量则高于大花萱草. Cd含量为:细胞壁及其残渣部分 > 细胞膜及细胞器部分 > 液泡及细胞可溶性部分,2种植物在各部位中的Cd含量均是金娃娃萱草高于大花萱草.
|
|
表 2 2种萱草地上、地下部分亚细胞Pb、Cd含量1) Table 2 The subcellular Pb and Cd contents in above and below ground parts of two types of Hemerocallis plants |
2种萱草地上部和地下部总Pb含量:大花萱草 > 金娃娃萱草; 总Cd含量:金娃娃萱草 > 大花萱草. 2种萱草地上部、地下部亚细胞组分Pb和Cd含量回收率均大于87%.
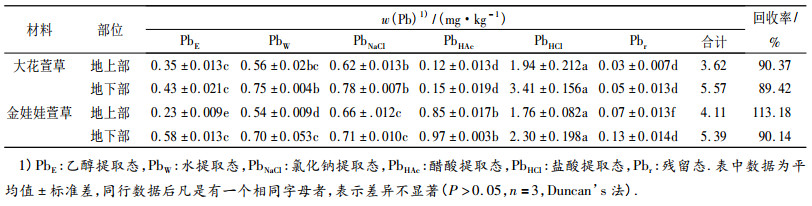
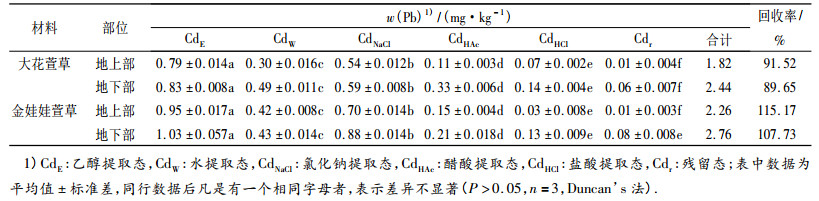
2.3 萱草中Pb、Cd的化学形态分析从表 3可知,大花萱草地上、地下部各种化学形态Pb含量大小为PbHCl > PbNaCl > PbW > PbE > PbHAc > Pbr; 金娃娃萱草地上、地下部Pb含量大小为PbHCl > PbHAc > PbNaCl > PbW > PbE > Pbr.由表 4可看出,大花萱草和金娃娃萱草地上、地下部各种化学形态Cd含量大小均为CdE > CdNaCl > CdW > CdHAc > CdHCl > Cdr; 2种萱草地上、地下部分各种化学形态Pb、Cd含量的回收率均大于87%.
|
|
表 3 2种萱草地上、地下部分各化学形态铅含量 Table 3 The Pb contents of different chemical forms in above and below ground parts of two types of Hemerocallis plants |
|
|
表 4 2种萱草地上、地下部分各化学形态镉含量 Table 4 The Cd contents of different chemical forms in above and below ground parts of two types of Hemerocallis plants |
一般而言,在植物将根部土壤中的重金属吸收并将其运输和累积到植株地上部分的整个过程中调控环节和调控位点有很多[13],细胞膜势(Membrane potential)是控制植物组织中重金属浓度的重要因素之一[14].植物吸收重金属的过程中,跨膜质运输是一个非常重要的调节机理,它主要取决于金属离子跨根细胞的内、外流间的动态平衡.从本研究时间动力学吸收特性来看,2种萱草地下部分Pb、Cd含量总体高于地上部分,植物根部是植物积累重金属的主要器官,可限制重金属向植物的地上部转移,减少重金属对地上部的毒害[15].随Pb、Cd处理时间的延长,2种植物的Pb、Cd含量均先升高后下降,这与应蓉蓉等[16]的研究结果一致.在整个Pb、Cd的吸收过程中均出现1个峰值,这是由于重金属离子跨根细胞的内流和外流速率达到平衡,吸收的重金属转运到了地上部,随培养时间的延长根系重金属含量不再增加,但是2种萱草对Pb、Cd吸收达到最大值的时间有一定的差异,2种萱草对Pb吸收基本上都是在第16天达到最大值; 对Cd吸收大花萱草在第24天时达到最大吸收量,而金娃娃萱草在第8天就达到最大值.这说明镉离子在金娃娃萱草中的跨根细胞的内外流速率比在大花萱草中先达到平衡,这可能与金属被植物体富集时重金属在植物体内的活化程度有关,也可能与植物本身对重金属的吸收机制不同有关.
转移系数可判断植物对重金属转移的能力,其值越大,转移能力就越强,说明该金属向地上部分转移的越多,滞留在根系的越少.随着Pb、Cd处理时间的延长,2种萱草对重金属由地下部分向地上部分转移的能力均减小,将重金属固持在地下部位,限制其向地上部分的转移,能够减轻重金属对光合组织的损伤,从而缓解重金属对植物生命活动的影响.
3.2 铅、镉在2种萱草中的亚细胞分布Pb、Cd在2种萱草中的亚细胞分布存在差异,进入2种萱草地上、地下部分的Cd大部分分布于细胞壁中,其次是细胞器部分,少量进入细胞可溶性部分,因此,大部分的Cd与细胞壁结合处于不活跃的形态.有研究表明,Cd被植物吸收后,大部分被储存在细胞壁中,其次是储存在细胞可溶性部分[17].植物的细胞壁表面带有较多的基团,可能会与重金属阳离子结合使其处在膜外; 其次,细胞壁中较多的磷可能会与Cd形成不溶性的磷酸盐[18].在Cd处理下细胞壁对重金属离子进行络合、螯合[19],细胞光合作用和呼吸作用的重要场所———叶绿体和线粒体结合的Cd较少,这有利于细胞正常发挥重要的生理机能,防止叶绿体和线粒体中的重要离子被Cd2+置换后影响光合作用和呼吸作用的效率.
有研究表明菜豆中大部分的Cd存在于细胞质中,只有少部分结合在细胞壁或细胞器组分中[10]. Cosio等[20]发现绝大多数的Cd主要存在于超积累植物天蓝遏蓝菜Thlaspi caerulescens细胞的细胞质中.这种分布与本试验2种萱草亚细胞Pb含量分布一致,为液泡及细胞可溶性部分 > 细胞壁及其残渣部分 > 细胞膜及细胞器部分. Zenk[21]认为,重金属在植物细胞内除细胞壁吸附外,大部分积累于液泡,使植物细胞免除毒害.导致Pb、Cd在2种宿根花卉中分布差异的原因可能与Pb、Cd处理水平不同有关,也有可能与不同植物对Pb、Cd的耐性差异有关.
3.3 2种萱草体内铅、镉结合形态重金属被植物吸收后以不同的化学结合形态存在于不同的部位.不同的提取剂提取的化合物形态不同.如乙醇主要提取无机盐、氨基酸盐等可溶盐; 去离子水主要提取水溶性有机酸盐等; 氯化钠提取与蛋白质结合或吸附态以及果胶酸盐等; 醋酸提取难溶于水的磷酸盐; 盐酸提取草酸盐等.乙醇和去离子水提取态生物毒性和移动性最高,最容易使植物受到毒害; 氯化钠提取态毒性与移动性中等; 醋酸与盐酸提取态生物毒性与移动性均最低[22].
He等[23]发现,在突变型水稻根系中Cd主要以水提取态和乙醇提取态存在,茎和叶中则以氯化钠提取态为主.然而在苎麻Bechmeria nivea L. [24]根部中却发现Cd主要以水提取态和NaCl提取态2种形态存在,茎和叶片中则以CdHCl和CdW形态为主,周芙蓉等[4]发现在侧柏和国槐中Pb主要以氯化钠、醋酸和盐酸提取态为主,水提取态和乙醇提取态所占比例很低.对水稻体内的重金属化学形态分布研究发现,Pb在根部以醋酸或盐酸提取态为主,可达总量的80%以上[25].
大花萱草地上、地下部分的PbHCl和PbNaCl所占百分比最高; 金娃娃萱草地上、地下部分的PbHCl和PbHAc所占百分比最高,Pb以盐酸和醋酸提取态等毒性和移动性最低的形态为主存在于2种萱草中,随着植株体内Pb的累积量增加对其毒害作用加强,植株自身形成一种毒害防御机制,即将高毒性形态Pb转化为低毒性形态的Pb大量贮存.然而Cd在2种萱草体内的化合形态分布却与Pb不同,均以乙醇提取态所占百分比最高,乙醇提取态是生物毒性高和移动性很强的形态,说明在2种萱草中Cd有着很大的移动潜力,为了降低其毒害作用,随时准备被转移到相应的部位贮存.
2种萱草Pb、Cd的化学形态分布特征,与其他植物的分布特征存在一定的差异.出现这些不同结果可能与植物对重金属忍耐与解毒机制不同有关.
| [1] |
XU Qinsong, MIN Haili, CAI Sanjuan, et al. Subcellular distribution and toxicity of cadmium in Potamogeton crispus L.[J]. Chemosphere, 2012, 89: 114-120. DOI:10.1016/j.chemosphere.2012.04.046 (  0) 0) |
| [2] |
BAKER A M. Metal tolerance[J]. New Phytol, 1987, 106: 93-111. (  0) 0) |
| [3] |
NI T H, WEI Y Z. Subcellular distribution of cadmium in mining ecotype Sedum alfredii[J]. Acta Bot Sin, 2003, 45(8): 925-928. (  0) 0) |
| [4] |
周芙蓉, 王进鑫, 张青, 等. 侧柏和国槐叶片中铅的化学形态与分布研究[J]. 农业环境科学学报, 2012, 31(11): 2121-2127. (  0) 0) |
| [5] |
GRAZ M, PAWLEGA B P, WILKOLAZKA A J. Growth inhibition and intracellular distribution of Pb ions by the white-rot fungus Abortiporus biennis[J]. Intl Biodeter Biodegr, 2011, 65: 124-129. DOI:10.1016/j.ibiod.2010.08.010 (  0) 0) |
| [6] |
李德明, 朱祝军. 镉在不同品种小白菜中的亚细胞分布[J]. 科技通报, 2004, 20(4): 278-282. DOI:10.3969/j.issn.1001-7119.2004.04.003 (  0) 0) |
| [7] |
刘云惠, 魏显有. 土壤中铅镉的作物效应研究[J]. 河北农业大学学报, 1999, 22(1): 24-28. (  0) 0) |
| [8] |
ANGELOVA V, IVANOV K, IVANOV R. Effect of chemical forms of lead, cadmium, and zinc in polluted soil on their uptake by tobacco[J]. Plant Nutr, 2004, 27: 757-773. DOI:10.1081/PLN-120030609 (  0) 0) |
| [9] |
GABBRIELLI R, PANDDFINI T, VERGNANO O, et al. Comparison of two serpentine species with different nickel tolerance strategies[J]. Plant and Soil, 1990, 22: 271-277. (  0) 0) |
| [10] |
WEIGEL H J, JÄGER H J. Subcellular distribution and chemical form of cadmium in bean plant[J]. Plant Physiol, 1980, 65: 480-482. DOI:10.1104/pp.65.3.480 (  0) 0) |
| [11] |
PERRONNET K, SCHWARTZ C, GERARD E, et al. Distribution of cadmium and zinc in the hyperaccumulator Thlaspi caerulescens grown on multicontaminated soil[J]. Plant and Soil, 2003, 249: 19-25. DOI:10.1023/A:1022560711597 (  0) 0) |
| [12] |
SUN T H, LI P J, ZHOU Q X. Formation mechanism of soil contamination and remediation technologies[M]. Beijing: Science Press, 2005.
(  0) 0) |
| [13] |
MARSCHNER H. Mineral nutrition of higher plants[M]. 2ed. San Diego, CA: Academic Press, 1995.
(  0) 0) |
| [14] |
CLARKSON D T, LÜTTGE U. Mineral nutrition: Divalent cations, transport and compartmentation[J]. Progress in Botany, 1989, 23: 552-560. (  0) 0) |
| [15] |
潘秀, 刘福春, 柴民伟, 等. 镉在互花米草中积累、转运及亚细胞的分布[J]. 生态学杂志, 2012, 31(3): 526-531. (  0) 0) |
| [16] |
应蓉蓉, 杜锁军, 胡鹏杰, 等. 长柔毛委陵菜对锌的吸收动力学特性[J]. 应用生态学报, 2008, 16(6): 1349-1354. (  0) 0) |
| [17] |
于辉, 杨中艺, 杨知建, 等. 不同类型镉积累水稻细胞镉化学形态及亚细胞和分子分布[J]. 应用生态学报, 2008, 19(10): 2221-2226. (  0) 0) |
| [18] |
SELA M, TEL-OR E, FRITZ E. Localization and toxic effects of cadmium, copper and uranium in Azolla[J]. Plant Physiol, 1988, 88(1): 30-36. DOI:10.1104/pp.88.1.30 (  0) 0) |
| [19] |
王宏镔, 王焕校, 文传浩, 等. 镉处理下不同小麦品种几种解毒机制探讨[J]. 环境科学学报, 2002, 22(4): 523-528. DOI:10.3321/j.issn:0253-2468.2002.04.022 (  0) 0) |
| [20] |
COSIO C, DESANTIS L, FREY B, et al. Distribution of cadmium in leaves of Thlaspi caerulescens[J]. J Exper Bot, 2005, 56(412): 765-775. DOI:10.1093/jxb/eri062 (  0) 0) |
| [21] |
ZENK M H. Heavy metal detoxification in high plants: A review[J]. Gene, 1996, 179(1): 21-30. DOI:10.1016/S0378-1119(96)00422-2 (  0) 0) |
| [22] |
许嘉琳, 鲍子平, 杨居荣. 农作物体内铅、镉、铜的化学形态研究[J]. 应用生态学报, 1991, 2(3): 244-248. DOI:10.3321/j.issn:1001-9332.1991.03.010 (  0) 0) |
| [23] |
HE Junyu, ZHU Cheng, REN Yanfang, et al. Uptake, subcellular distribution, and chemical forms of cadmium in wild-type and mutant rice[J]. Pedosphere, 2008, 18(3): 371-377. DOI:10.1016/S1002-0160(08)60027-2 (  0) 0) |
| [24] |
WAND Xin, LIU Yunguo, ZENG Guangming, et al. Subcellular distribution and chemical forms of cadmium in Bechmeria nivea L.[J]. Environ Exp Bot, 2008, 62: 389-395. DOI:10.1016/j.envexpbot.2007.10.014 (  0) 0) |
| [25] |
朱海江. 水稻对重金属铅的吸收积累特征及其农艺调控研究[D]. 杭州: 浙江大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10335-2004076094.htm
(  0) 0) |
 2015, Vol. 36
2015, Vol. 36