罗尔阿太菌Athelia rolfsii是担子菌门阿太菌属的一种真菌,无性世代为齐整小核菌,白色菌落,菌丝呈放射状生长,能分泌多糖[1-2].该多糖是一种非离子型、水溶性的同聚多糖,包含β-D-(1→3)-吡喃葡萄糖基和β-D-(1→6)-吡喃葡萄糖基线性链[3-4].具有水溶性、组织相容性、增稠性[5]、抗水解能力及在高温下保持黏度的特性,广泛应用于食品[6]、药品、石油采收、陶瓷、纸张、绘画、化妆品、抗肿瘤、抗微生物及抗病毒等方面[7].
目前罗尔阿太菌多糖的研究主要集中在多糖的物理化学特性、分子构象、抗肿瘤活性、免疫活性及药物缓释方面[8-9],但鲜见通过选育菌种提高产糖量的报道.原生质体融合技术广泛应用于菌种选育,具有重组频率高、遗传物质完善、易获得性状优良的融合菌等优点.陈合等[10]利用原生质体融合技术选育出高产灵芝多糖的灵芝菌; 靳挺等[11]利用原生质体融合技术选育出高产茁霉多糖的出芽短梗霉.Gunashree等[12]利用原生质体融合技术成功地将黑曲霉和曲霉菌进行了融合.本研究以菌株AY6657741为试验材料,采用原生质体融合技术选育多糖高产草酸低产的菌株,为提高多糖产量奠定理论基础.
1 材料与方法 1.1 试验材料罗尔阿太菌菌株AY6657741,由吉林农业大学发酵工程实验室分离和保藏.经紫外和亚硝基胍复合诱变获得突变菌株Ar-1和Ar-2.
溶壁酶(≥200 U·mg-1)购自上海楷洋生物技术有限公司; 纤维素酶(≥10 000 U·mg-1)、蜗牛酶(≥ 2 000 U·mg-1)、KCl、NaCl,聚乙二醇(PEG) 6000等试剂均购自北京鼎国昌盛生物技术有限公司.
PDA斜面培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,121 ℃灭菌20 min.
种子培养基:葡萄糖20 g,酵母浸粉1.0 g,K2HPO4 1.0 g,MgSO4·7H2O 0.25 g,NaNO3 3.0 g,KCl 0.5 g,加蒸馏水定容至1 L,pH 4.55,121 ℃灭菌20 min.
发酵培养基:玉米淀粉35 g,玉米黄浆50 mL,K2HPO4 1.0 g,MgSO4·7H2O 0.25 g,NaNO3 3.1 g,KCl 0.5 g,柠檬酸0.4 g,加蒸馏水定容至1 L,pH 4.55,121 ℃灭菌20 min.
低渗培养基:蛋白胨5.0 g,琼脂15 g,牛肉浸膏3.0 g,葡萄糖10 g,酵母浸粉1.0 g,马铃薯200 g,蒸馏水定容到1 L,pH 4.55,121 ℃灭菌20 min.
双层再生培养基:低渗培养基中加入渗透压稳定剂(0.4 mol·L-1的KCl、NaCl、蔗糖、MgSO4) [13],上层琼脂15 g,下层琼脂5 g,pH 4.55,121 ℃灭菌20 min.
1.2 生长曲线的测定将A.rolfsii AY6657741菌株接种于250 mL种子培养基中,29 ℃、200 r·min-1空气浴振荡培养72 h,转接入发酵培养基中,接种量为7%,29 ℃、200 r·min-1培养162 h.期间每6 h取出3瓶培养基,分别用HCl调节pH至7.0,用蒸馏水稀释3倍,8 000 r·min-1离心15 min.弃上清液留菌丝体,80 ℃烘干菌丝体至恒质量,称菌丝体干质量,获得菌体生长曲线.
1.3 菌悬液的制备取斜面培养菌株,无菌水冲洗,涡旋器振荡混匀,用无菌擦镜纸滤去菌丝体片段,用无菌水稀释至终浓度为1.0 × 105 mL-1,转接入种子培养基中,29 ℃、200 r·min-1振荡培养55 h[14].
1.4 原生质体制备及条件 1.4.1 原生质体制备与再生取培养55 h的种子发酵液9 mL,取1 mL涂布于PDA培养基上,29 ℃条件下培养.其余8 mL菌悬液中加入1 mL 5.56 mmol· L-1的β-巯基乙醇,静置30 min.6 500 r·min-1离心15 min,弃上清液留菌丝体,渗透压稳定剂洗涤2次.加入1 mL的酶液,32 ℃条件下60 r·min-1振荡酶解,渗透压稳定剂洗涤2次,去酶液,6 500 r·min-1离心15 min,弃上清液留原生质体.原生质体保存于渗透压稳定剂中,取1 mL涂布于低渗培养基,1 mL涂布于双层再生培养基上,29 ℃条件下培养.按公式计算原生质体的形成率和再生率.
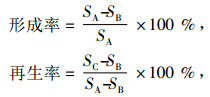
|
式中,SA、SB、SC分别为PDA培养基、低渗培养基、双层再生培养基上的菌落面积(cm2).
1.4.2 原生质体制备条件的选择破壁酶:选用培养55 h的菌悬液,0.4 mol·L-1的KCl作为高渗稳定剂,3.1 mg·mL-1的酶,32 ℃酶解55 min,分别选择7组酶进行单因素试验.其中,第1组为纤维素酶(pH 5.0),第2组为蜗牛酶(pH 5.8),第3组为溶壁酶(pH 5.4),第4组为复合酶(纤维素酶φ为2%、蜗牛酶φ为4%、溶壁酶φ为2%,pH 5.5),第5组为复合酶(纤维素酶φ为2%、蜗牛酶φ为2%、溶壁酶φ为4%,pH 5.5),第6组为复合酶(纤维素酶φ为4%、蜗牛酶φ为2%、溶壁酶φ为2%,pH 5.5),第7组为复合酶(纤维素酶φ为2%、蜗牛酶φ为2%、溶壁酶φ为2%,pH 5.5).
酶浓度:选用培养55 h的菌悬液,0.4 mol·L-1的KCl作为高渗稳定剂,分别选择1.3、2.2、3.1、4.0、4.9和5.8 mg·mL-1的第5组复合酶,32 ℃条件下酶解55 min,进行单因素试验.
酶解温度:选用培养55 h的菌悬液,0.4 mol·L-1的KCl作为高渗稳定剂,3.1 mg·mL-1的第5组复合酶酶解55 min.分别选择26、28、30、32、34和36 ℃进行单因素试验.
酶解时间:选用培养55 h的菌悬液,0.4 mol·L-1的KCl作为高渗稳定剂,3.1 mg·mL-1的第5组复合酶32 ℃条件下分别振荡酶解25、35、45、55、65、75和85 min进行单因素试验.
pH:选用培养55 h的菌悬液,0.4 mol·L-1的KCl作为高渗稳定剂,3.1 mg·mL-1的复合酶(纤维素酶φ为2%、蜗牛酶φ为2%、溶壁酶φ为4%) 32 ℃酶解55 min.pH分别选择3.5、4.5、5.5、6.5、7.5、8.5进行单因素试验.
渗透压稳定剂:选用培养55 h的菌悬液,3.1 mg·mL-1的第5组复合酶,32 ℃酶解55 min.分别选择0.4 mol·L-1的NaCl、蔗糖、KCl、MgSO4进行单因素试验.
在上述单因素试验基础上,以原生质体形成率和再生率为指标,通过正交试验L16 (45) (表 1)确定原生质体制备的最佳条件.
|
|
表 1 原生质体制备正交试验因素水平表 Table 1 Protoplast preparation orthogonal factor level table |
将制备好的Ar-1和Ar-2原生质体悬浮液等体积混合,均分为2份,记为Ⅰ和Ⅱ,Ⅰ用于紫外灭活,Ⅱ用于热灭活.
从Ⅰ中取1 mL涂布于双层再生培养基上,29 ℃条件下培养.余下部分均分为6组,分别在紫外光下灭活1、3、5、7、9和11 min,各取1 mL涂布于再生双层培养基上,29 ℃避光培养.
从Ⅱ中取1 mL涂布于双层再生培养基上,29 ℃条件下培养.余下部分均分为21组,分别于45、55和65 ℃的恒温水浴锅中保温15、25、35、45、55、65和75 min,各取1 mL涂布于再生双层培养基上,29 ℃条件下培养.按公式计算原生质体灭活率.
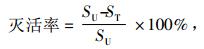
|
式中,SU表示未经紫外和热灭活的再生菌落面积(cm2),ST表示经紫外和热灭活后的再生菌落面积(cm2).
1.6 原生质体融合 1.6.1 原生质体融合分别取“1.5”中不同方法灭活的原生质体悬液,等体积混合均匀,6 500 r·min-1离心15 min,弃上清液留原生质体.加入PEG6000促融,30 ℃水浴处理,不同时间段取出.0.4 mol·L-1的KCl洗涤2次,去除PEG6000,重悬于KCl中,取1 mL涂布于再生双层培养基上,29 ℃培养,按公式计算原生质体的融合率.
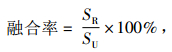
|
式中,SR、SU分别表示融合子菌落面积和未灭活的原生质体再生菌落面积(cm2).
1.6.2 原生质体融合条件的选择PEG6000浓度:向2 mL灭活后的原生质体悬液中分别加入4 mL 0.25、0.30、0.35、0.40、0.45和0.50 g · mL-1的PEG6000在30 ℃条件下融合25 min.
融合时间:向2 mL灭活后的原生质体悬液中分别加入4 mL 0.4 g·mL-1的PEG6000,在30 ℃条件下分别融合10、15、20、25、30和35 min.
融合温度:向2 mL灭活后的原生质体悬液中分别加入4 mL 0.4 g·mL-1的PEG6000分别在26、28、30、32、34和36 ℃条件下融合25 min.
1.7 融合子的筛选再生培养基上长出融合子后,挑选长势良好的融合子传代5次,划线法接种于PDA斜面培养基上,29 ℃条件下培养.转接入种子培养基中,29 ℃、200 r·min-1空气浴振荡培养.再转接入发酵培养基中,接种量为7%,29 ℃、200 r·min-1空气浴振荡培养5.5 d.测定发酵液中多糖及草酸产量,最终筛选出1株多糖产量高且草酸产量低的融合菌株.多糖含量的测定采用蒽酮硫酸法[15],草酸含量的测定采用分光光度法[16-17].
2 结果与分析 2.1 罗尔阿太菌生长曲线通过测定菌体生长曲线得知30~80 h菌体生长旺盛,为罗尔阿太菌生长对数生长期,此时制备原生质体,可得到较高的原生质体形成率和再生率[18].因此选用培养55 h的菌体用于原生质体制备.
2.2 原生质体制备条件 2.2.1 制备条件对原生质体形成率和再生率的影响由图 1a可知在添加单一种类酶中,第3组溶壁第4期李鸿梅,等:原生质体融合选育高产多糖的罗尔阿太菌菌株93酶的去壁和再生效果最好,原生质体的形成率为71.343%,再生率为9.003%.而第1组纤维素酶和第2组蜗牛酶的形成率和再生率都偏低.第4、5、6和7组复合酶的形成率和再生率都高于单一酶,尤其是第5组复合酶原生质体的形成率为92.765%,再生率为18.869%,效果最好.
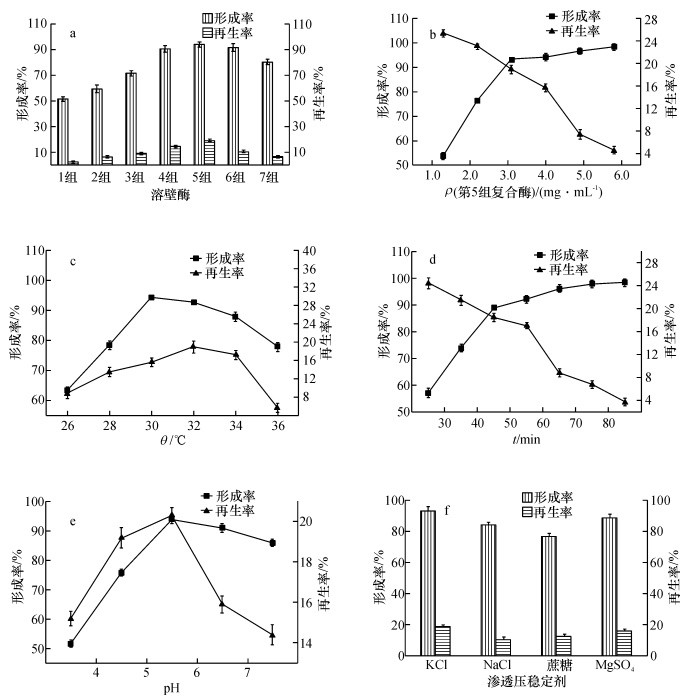
|
图 1 制备条件对原生质体形成率和再生率的影响 Figure 1 Effects of preparation conditions on the formation and regeneration rates of protoplast |
由图 1b可知随着复合酶浓度的增加,原生质体的形成率逐渐增加,再生率逐渐降低.原因可能是随着复合酶浓度的增加,细胞壁与酶分子接触机会增加,细胞壁被酶解的几率增大,因此形成率增大.但当复合酶浓度过高时,不仅细胞壁被酶解,细胞膜也遭到严重破坏,致使原生质体再生困难,造成再生率下降.当复合酶为3.1 mg · mL-1时,原生质体的形成率为93.133%,再生率为18.932%,综合效果较好.
由图 1c可知当温度为30 ℃时,原生质体的形成率最高,为92.767%.当温度为32 ℃时,原生质体再生率最高.这是由于酶在其最适温度下才能发挥最高活力,温度低,只能酶解部分细胞壁,原生质体形成率和再生率都不高.温度高不利于原生质体的形成,导致形成率和再生率下降.考虑到原生质体再生是原生质体灭活的关键,温度采用32 ℃.
由图 1d可知随着酶解时间的延长,原生质体形成率逐渐提高,而再生率逐渐下降.原因可能是酶解时间越长细胞壁被水解的越完全,使原生质体形成率提高,但酶解时间过长时,酶在酶解细胞壁的同时也会损伤细胞膜,使原生质体再生困难,导致原生质体再生率下降,当酶解时间为55 min时,原生质体形成率为92.134%,再生率为17.332%,综合效果较好.
由图 1e可知,pH 5.5时原生质体的形成率和再生率均达最大值.这可能是由于pH 5.5处于蜗牛酶(5.0~5.8)、纤维素酶(4.0~5.5)、溶壁酶(5.4 ~ 6.0)的适宜范围内,酶解效果好,因此原生质体形成率和再生率最高.
由图 1f可知KCl作为渗透压稳定剂破壁效果均优于MgSO4、NaCl和蔗糖,原生质体形成率和再生率分别为93.501%和18.867%.利用spss16.0软件进行单因素方差分析,结果表明Sig为0.000,差异极显著,按照显著性水平P<0.05分成3列(KCl、NaCl和蔗糖、MgSO4),三者之间有着显著差异,其中NaCl和蔗糖之间差异不显著.这可能是由于KCl作为渗透压稳定剂更易避免原生质体膨胀破裂.因此采用KCl作为渗透压稳定剂进行原生质体制备.
2.2.2 原生质体制备最佳条件的选择原生质体制备正交试验结果见表 2.由表 2可以看出,极差R的分布大小依次为复合酶浓度(A)>酶解时间(C)>酶解温度(B)>渗透压稳定剂(E)>pH(D).这表明复合酶浓度对原生质体形成率和再生率影响最大,pH影响最小.原生质体制备最佳组合条件为A2B2C3D2E3,即0.4 mol·L-1的KCl作为渗透压稳定剂,复合酶3.1 mg·mL-1,pH 5.5、32 ℃条件下酶解55 min,原生质体形成率为93.534%,再生率为18.921%.
|
|
表 2 原生质体制备正交试验结果 Table 2 The results of protoplast preparation orthogonal test |
紫外灭活和热灭活对原生质体致死率的影响如图 2所示,由图 2a可以看出随着紫外照射时间的延长,原生质体致死率升高.紫外照射5 min,原生质体致死率达98.6%,照射6 min,原生质体致死率达100%,因此6 min为紫外灭活最佳时间.
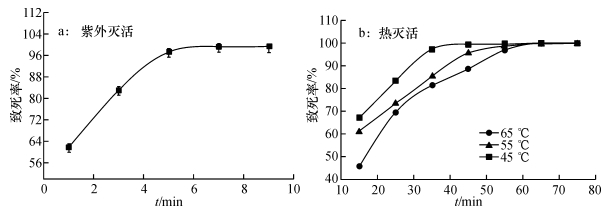
|
图 2 紫外灭活和热灭活对原生质体致死率的影响 Figure 2 Effects of UV-inactivated and heat-inactivated treatments on death rate of protoplasts |
由图 2b可以看出,45 ℃热处理60 min,55 ℃热处理55 min,65 ℃热处理40 min,原生质体致死率均达100%.为了在最短时间内达到灭活目的,选择65 ℃热处理40 min.
2.4 融合条件对原生质体融合率的影响融合条件对原生质体融合率的影响见图 3,由图 3a可以看出,随着PEG6000浓度的增加,原生质体融合率先增加后降低.当PEG6000为0.4 g·mL-1时,原生质体融合率为6.792%.原因可能是PEG6000在原生质体融合过程中既作为诱导剂又作为稳定剂,浓度低时诱导作用不明显,浓度高时原生质体不稳定易破裂,致使原生质体融合率降低.
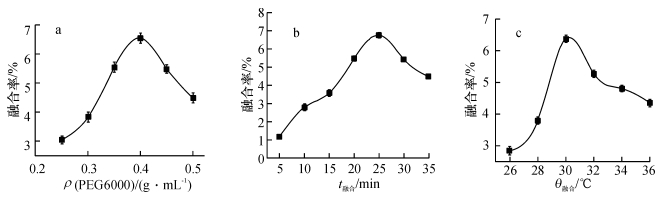
|
图 3 融合条件对原生质体融合率的影响 Figure 3 Effects of fusion conditions on protoplast fusion rates |
由图 3b可以看出,随着融合时间的增加,原生质体融合率先增加后降低.当融合时间为25 min时,原生质体融合率为6.543%.可能原因是融合时间短,原生质体融合不完全.融合时间长,PEG6000会对细胞造成毒害作用,致使原生质体融合率降低.
由图 3c可以看出,随着融合温度的增加,原生质体融合率先增加后降低.当融合温度为30 ℃时,原生质体融合率为6.452%.原因可能是融合温度低时达不到融合条件,融合温度高时抑制PEG6000作用,致使原生质体融合率降低.
2.5 融合子的筛选 2.5.1 原生质体融合子形态原生质体融合子形态见图 4,原生质体经紫外和热处理灭活后,致死率为100%,在双层再生培养基上不再生长.原生质体融合后在再生培养基上长出融合子,最初是1个白色圆形的点,随后菌丝向外萌发生长,通常需要6~9 d.
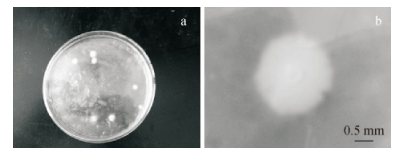
|
图 4 原生质体融合子形态 Figure 4 The form of protoplast fusant a、b分别表示再生培养基上长出的融合子及其具体形态 |
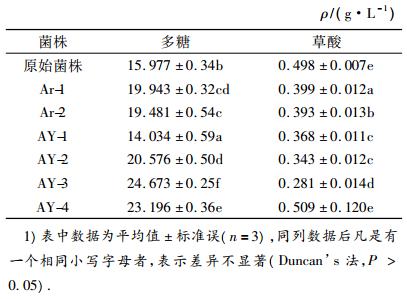
经原生质体融合筛选出了4个菌株,分别命名为AY-1、AY-2、AY-3、AY-4,在发酵培养基中培养5.5 d后测得多糖及草酸产量见表 3.
|
|
表 3 筛选菌株的多糖和草酸产量1) Table 3 Polysaccharide and oxalic acid yields of screened strains |
由表 3可以看出,经原生质体融合选育的菌株中,除菌株AY-1的多糖产量下降外,其他菌株多糖产量都高于Ar-1和Ar-2,菌株AY-3和AY-4多糖产量较高,分别比原始菌株的产糖量提高了54.42%和45.18%.此外,菌株AY-3草酸产量最低,为0.281 g·L-1,比原始菌株的草酸产量降低了43.57%.菌株AY-1、AY-2、AY-3、AY-4多糖产量均与原始菌株差异显著(P<0.05).草酸产量除菌株AY-4与原始菌株差异不显著外(P>0.05),菌株AY-1、AY-2、AY-3均与原始菌株差异显著(P<0.05).菌株AY-3的多糖产量、多糖产量变化、草酸产量、草酸产量变化均与其他菌株差异显著(P<0.05),为最佳产糖菌株.
3 讨论与结论真菌原生质体融合技术不仅打破了微生物种界界限,还能保持完整的遗传物质,从而完成菌株基因重组,重组后的融合子具有双亲遗传性状,能够表现出双亲的优良性状.本研究中以罗尔阿太菌菌株AY6657741为原始菌株,诱变株Ar-1和Ar-2为双亲菌株,以玉米淀粉和玉米黄浆为培养基,采用原生质体融合技术选育的罗尔阿太菌菌株多糖产量高达24.673 g·L-1.本试验中多糖产量与Shrikant等[19]的研究相比,产糖量提高了10.54%.这表明原生质体融合技术能较好地提高罗尔阿太菌分泌多糖的能力,为今后进一步提高多糖产量奠定了基础.
本试验中采用紫外照射和热处理方法灭活双亲原生质体,但紫外处理和热处理在一定条件下有可逆性,因此融合培养后的菌株具有不稳定性,其性状特征可能很快失去,所以必须传代数次保证其性状的稳定性.另外在发酵过程中发现,伴随多糖的产生,会生成草酸,使发酵液pH由4.55很快降至2.00左右,从而抑制了多糖的分泌,当草酸产量高于0.368 g·L-1时,多糖产量就会受到影响.采用原生质体融合技术选育出的菌株AY-3满足了草酸低产,多糖高产的要求.
目前高产罗尔阿太菌多糖生产专利技术由Cargill公司拥有,我国只能依赖进口.本研究中获得的菌株AY-3可为我国获得拥有自主知识产权的罗尔阿太菌多糖工艺技术奠定了一定的理论基础.今后的研究将进一步探讨AY-3生产多糖的工艺,以期为该糖工业化生产奠定基础.
| [1] |
王雅, 黄思良, 何鹏鹏, 等. 芝麻白绢病病原菌的分离鉴定及其生物学特性[J]. 中国油料作物学报, 2013, 35(1): 84-91. (  0) 0) |
| [2] |
喻璋, 张猛. 半知菌分属图册[M]. 北京: 科学出版社, 2009: 222.
(  0) 0) |
| [3] |
TOMMASINA C, ANTONIO P, MARIO G, et al. Scleroglucan: A versatile polysaccharide for modified drug delivery[J]. Molecules, 2005, 10(1): 6-33. DOI:10.3390/10010006 (  0) 0) |
| [4] |
KIRAN M, SHRIKANT A, PARAG S, et al. A comparison of artificial neural network (ANN) and response surface methodology (RSM) in fermentation media optimization: Case study of fermentative production of scleroglucan[J]. Biochem Eng J, 2008, 41(3): 266-273. DOI:10.1016/j.bej.2008.05.009 (  0) 0) |
| [5] |
FATINA J I, SINERIZ F, MPLINA O E, et al. Isolation and physicochemical characterization of soluble scleroglucan from Sclerotium rolfsii, rheological properties, molecular weight and conformational characteristics[J]. Carbohydr Polym, 2001, 44(1): 41-50. DOI:10.1016/S0144-8617(00)00189-2 (  0) 0) |
| [6] |
SEPKHYUN L, GUIYING S, ERIC L, et al. Small highyielding binary Ti vectors PLSU with co-directional replicons for Agrobacterium tumefaciens-mediated transformation of higher plants[J]. Plant Sci, 2012, 187(6): 49-58. (  0) 0) |
| [7] |
VINARTA S C, MOLINA O E, FIGUEROA L I C, et al. A fu rther insight into the practical applications of exopolysaccharides from Sclerotium rolfsii[J]. Food Hydrocolloid, 2006, 20(5): 619-629. DOI:10.1016/j.foodhyd.2005.05.006 (  0) 0) |
| [8] |
NORA J, SILVANA C, Julia I, et al. Investigation on the fi lm-forming properties of lab fermenter scale produced scleroglucans from Sclerotium rolfsii ATCC 201126[J]. Carbohydr Polym, 2011, 86(1): 45-50. DOI:10.1016/j.carbpol.2011.03.054 (  0) 0) |
| [9] |
SHRIKANT A, REKHA S, PARAG S, et al. Production of scleroglucan from Sclerotium rolfsii MTCC 2156[J]. Bioresour Technol, 2006, 97(8): 989-993. DOI:10.1016/j.biortech.2005.04.037 (  0) 0) |
| [10] |
陈合, 胡云红, 秦俊哲, 等. 灵芝菌原生质体融合条件研究[J]. 食品科学, 2007, 28(2): 173-176. DOI:10.3321/j.issn:1002-6630.2007.02.043 (  0) 0) |
| [11] |
靳挺, 武玉学, 王建平. 出芽短梗霉原生质体形成和再生研究[J]. 食品与发酵科技, 2012, 48(2): 32-35. (  0) 0) |
| [12] |
GUNASHREE B S, VENKATESWARAN G. Enhanced phytase production through interspecific protoplast fusion of Aspergillus niger CFR 335 and Aspergillus ficuum SGA 01 auxotrophic mutants[J]. Enzyme Microb Technol, 2010, 46(7): 562-567. DOI:10.1016/j.enzmictec.2010.03.006 (  0) 0) |
| [13] |
刘文芳, 郭成金. 白灵菇原生质体制备与再生研究[J]. 天津师范大学学报:自然科学版, 2012, 32(1): 88-92. (  0) 0) |
| [14] |
邱静, 罗水忠, 姜绍通, 等. 高产L-乳酸米根霉的原生质体制备与再生条件研究[J]. 食品科学, 2011, 32(9): 174-178. (  0) 0) |
| [15] |
张惟杰. 复合多糖生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 1999: 11-13.
(  0) 0) |
| [16] |
徐大好. 啤酒中草酸含量的测定[J]. 中国酿造, 2008, 192(15): 79-82. (  0) 0) |
| [17] |
闫文娟, 李泰辉, 姜子德. 比色法测定广东虫草虫草酸含量[J]. 食用菌实验技术, 2010(5): 74-78. (  0) 0) |
| [18] |
冯学珍, 郑媛, 王跃军, 等. 紫外诱变原生质体选育溶菌酶高产菌株的研究[J]. 渔业科学进展, 2009, 30(4): 90-95. DOI:10.3969/j.issn.1000-7075.2009.04.014 (  0) 0) |
| [19] |
SHRIKANT A, PARAG S, REKHA S, et al. Enhanced production of scleroglucan by Sclerotium rolfsii MTCC 2156 by use of metabolic precursors[J]. Bioresour Technol, 2007, 98(2): 410-415. DOI:10.1016/j.biortech.2005.12.013 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36