2. 华南农业大学 生物材料研究所,广东 广州 510642
2. Institute of Biomaterial, South China Agricultural University, Guangzhou 510642, China
水杨醛类Schiff碱是由水杨醛类化合物上的活泼醛基与伯氨缩合形成的一类含有亚胺基-RC=N-的化合物.这类化合物具有抗菌、抗病毒、抗癌、抗氧化等药理活性.氨基酸Schiff碱具有多个N、O原子,是一类重要的生物配体,其分子含有活泼的氨基酸基团,引入其他不同的结构和活性基团,尤其与过渡金属形成配合物后,很多生物活性得到加强,而且这类配合物广泛应用于载氧体模型化合物、抗癌、抑菌化合物以及仿酶催化物等方面[1].这类配合物通过促进生物体内的O2-·分解,对肿瘤、病菌等有一定的抑制作用[2].
绝大部分小分子药物通过血液循环到达治疗靶点,而小分子药物能与血液中富含的血清白蛋白相互作用而影响药效,BSA常用于研究小分子药物与蛋白质大分子的相互作用[3].
5-氯甲基水杨醛[5-(chloromethyl) salicylaldehyde,Cmsa]是一种用途广泛的取代型的水杨醛,笔者曾对它的合成方法进行了改进[4],并报道了它与L-苯丙氨酸(L-phenylalanine,L-Phe)形成的Schiff碱及其部分金属配合物的抗菌活性[5]. L-酪氨酸(L-Tyrosine,L-Tyr)是一种芳香族氨基酸,是神经递质的前体之一,可以增加体液内神经递质,特别是多巴胺和去甲肾上腺素的含量,医药上用作治疗甲状腺功能亢进,也可作为食品添加剂.本文在甲醇溶剂中合成了5-氯甲基水杨醛缩L-酪氨酸Schiff碱配体及其Mn(Ⅱ)配合物,对配体和配合物的组成、结构进行了表征,测定了它们的抗菌活性、SOD活性及其与BSA的相互作用.本研究有助于拓宽抗菌药物和SOD模拟物的研究范围,为探索和开发新型的抗菌药物及抗氧化药物奠定一定的理论和试验基础.
1 材料与方法 1.1 材料大肠埃希菌(Escherichia coli,G-)和金黄色葡萄球菌(Staphylococcus aureus,G+)均由广东省植物分子育种重点实验室(华南农业大学)提供并自行保藏.平板培养基为50 g·L-1的MH琼脂,液体培养基w = 2.5%的MH肉汤粉.
Vario EL元素分析仪,德国ELEMENTAR公司; AVATAR 360型FT-IR光谱仪,美国Nicolet公司; UV-2550型紫外可见分光光度计,日本Shimadzu公司; RF-5301PC型荧光分光光度计,日本Shimadzu公司; DGT-60型差热热重分析仪,日本Shimadzu公司.
Cmsa根据文献[4]自行制备,熔点为85~86 ℃. L-Tyr、MH琼脂、MH肉汤、酪蛋白、核黄素(VB2)、氯化硝基四氮唑蓝(NBT)均为国产分析纯试剂,牛血清白蛋白(BSA)为Sigma公司分装试剂,试验用水为二次蒸馏水.
1.2 方法 1.2.1 5-氯甲基水杨醛缩酪氨酸Schiff碱配体(Cmsatyr)和Mn(Ⅱ)配合物(MnCmsatyr)的合成Cmsatyr的合成参照文献[6],边搅拌边将50 mL溶有5 mmol的L-Tyr和10 mmol KOH的无水甲醇溶液滴加到20 mL溶有5 mmol 5-氯甲基水杨醛(Cmsa)的无水甲醇溶液中,50 ℃搅拌反应1 h,旋转蒸发溶剂至约30 mL,然后加入30 mL异丙醇,出现大量黄色沉淀,静置、抽滤、无水乙醚洗涤2次,真空干燥后得产品,产率为81.0%.
MnCmsatyr的合成参照文献[6],边搅拌边将10 mL溶有1 mmol Mn(CH3COO)2的无水甲醇溶液滴加到25 mL溶有1 mmol上述Schiff碱配体的无水甲醇溶液中,70 ℃搅拌1 h,旋转蒸发溶剂至约10 mL,加入10 mL异丙醇,静置过夜,析出大量的黄褐色沉淀,抽滤、无水乙醚洗涤2次,真空干燥后得产品,产率为63.2%.
1.2.2 抗菌活性和SOD活性测定抗菌活性的测定采用滤纸片法测定配体和配合物对E.coli和S.aureus的抑菌圈大小[5],试验结果为3次平行试验的均值,相对平均偏差均在5%以内.
采用改进的核黄素(VB2)光还原NBT法检测模拟物的SOD活性[7].将盛有3.00 mL空白反应液且光径为1 cm的比色皿于25 ℃恒温,待光强稳定后对比色皿进行照射,第1次照射60 s,以后每次照射30 s,测D560 nm.同样方法测定空白液中加入不同浓度SOD或SOD模拟物溶液后的D560 nm.试验重复3次.
1.2.3 与BSA的相互作用以50 mmol·L-1,pH 7.4的Tirs/HCl缓冲溶液配制BSA溶液.移取8.0 × 10-7 mol·L-1的BSA 3.00 mL于1 cm石英比色池中,用微量注射器逐次加入配合物溶液进行荧光滴定(滴定剂累加体积<50 μL),每次加入溶液后混合均匀,25 ℃作用5 min,于激发波长280 nm、激发和发射缝宽均为5.0 nm、高灵敏度、快速扫描的条件下,在RF-5301荧光分光光度计上记录290~450 nm的发射光谱.
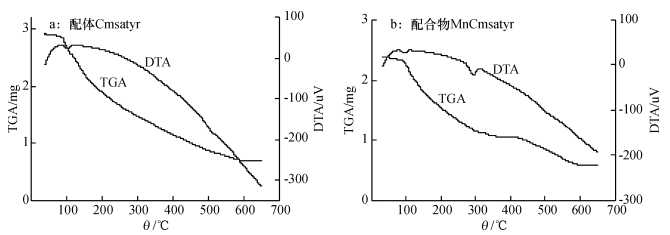
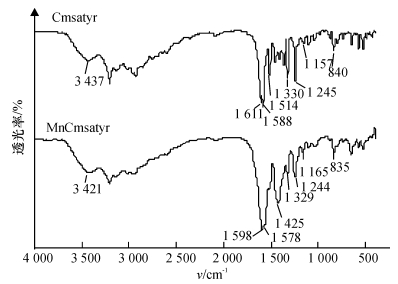
2 结果与分析 2.1 配合物MnCmsatyr的组成与结构表征目标配体Cmsatyr的元素分析结果为(括号内为计算值): C 44.01% (44.17%),H 4.34% (4.59%),N 3.02% (3.06%); 目标配合物MnCmsatyr的元素分析结果为(括号内为计算值): C 43.81% (43.73%),H 4.06% (4.15%),N 2.69% (2.60%).可见配体和配合物的元素分析试验值和计算值是吻合的.试验测得该配体和配合物在DMSO中的摩尔电导率分别为102.0和67.8 S·cm2·mol-1,根据Geary的观点[8],可判断该配体为2:1型电解质,配合物为1:1型电解质.图 1为该配体和配合物的差热-热重图,配体和配合物都在90~120 ℃出现吸热峰,这是脱去结晶水而产生的脱水峰,图中配体和配合物的脱水失质量率分别为11.87%和6.52%,与它们的理论脱水失质量率11.65%和6.92%接近,表明配体含有3分子结晶水、配合物含2分子结晶水.该配体和配合物的红外图(图 2),在3 400 cm-1附近宽吸收峰表明配体和配合物中存在水分子,对比发现νC=N峰位由1 611 cm-1红移至1 598 cm-1,ν-COO-as也由1 588 cm-1红移至1 578 cm-1,Cmsa的νAr-O由1 157 cm-1蓝移至1 165 cm-1,而Tyr的νAr-OH峰在1 245 cm-1处未发生移动,表明来自Tyr的-COO-和Cmsa的酚氧基与Mn (Ⅱ)发生配位,而Tyr中的酚羟基并未与Mn(Ⅱ)发生配位.配体和配合物中ν-COO-s峰位未见移动,基本位于1 330 cm-1处.据文献[9-10]报道,Δv (ν-COO-as-ν-COO-s)值大于200 cm-1时,可判断羧基为单齿配位方式,显然图 2中配体和配合物的Δv值均大于200 cm-1,表明配体中的羧基为单齿配位方式.
|
图 1 配体Cmsatyr和配合物MnCmsatyr的差热-热重图 Figure 1 TG-DTA plots of Cmsatyr and MnCmsatyr |
|
图 2 配体Cmsatyr和配合物MnCmsatyr的FT-IR图 Figure 2 FT-IR spectra of Cmsatyr and MnCmsatyr |
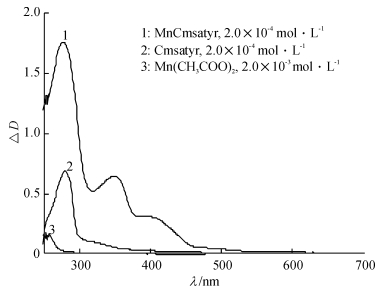
以二甲基亚砜(DMSO)为溶剂测定了该配体和配合物及金属盐Mn(CH3COO)2在室温下的UV-Vis光谱,见图 3.配体和配合物分别在279和277 nm处出现1个归属于苯环π→π*跃迁吸收峰[5],金属盐Mn(CH3COO)2在257 nm处出现1个归属于CH3COO-的n→π*跃迁吸收峰.另外,配体在300 nm附近存在1个肩峰,这是由C=N键的N原子p轨道的孤对电子与苯环大π键发生p-π共轭而产生的n→π*跃迁吸收峰,但在配合物中该峰红移至348 nm,红移幅度较大,表明配合物中C=N键上的N原子与中心金属离子Mn(Ⅱ)发生了配位[5-6].与配体相比,配合物在400 nm附近出现1个新峰,归属于配体与金属离子间的L→M跃迁峰,另外配合物各吸收峰的摩尔吸光系数也明显高于配体,这些进一步证实Cmsatyr与Mn(Ⅱ)发生了配位.
|
图 3 25 ℃下配体Cmsatyr和配合物MnCmsatyr的紫外-可见谱图 Figure 3 Ultra-vis spectra of Cmsatyr and MnCmsatyr at 25 ℃ |
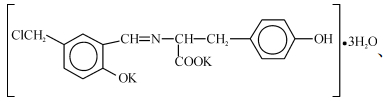
综合上述分析结果,得出配体Cmsatyr和配合物MnCmsatyr的分子组成分别为K2L·3H2O(L = C17H14NO4Cl2-)和K[MnL(CH3COO)]·2H2O,它们的分子结构式分别如下:
|
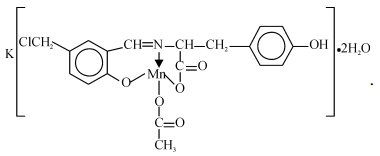
|
由于氨基酸种类和合成方法不同,该配体与配合物的组成和结构与笔者前期报道的5-氯甲基水杨醛缩苯丙氨酸Schiff碱配体及其过渡金属配合物[5]的明显不同,但Schiff碱配体均表现为三齿配体.
2.2 配合物的抗菌活性采用滤纸片法测定了配体Cmsatyr和配合物MnCmsatyr均为0.50 mg·mL-1时它们对E.coli和S.aureus的抗菌效果(图 4),溶剂DMSO和金属盐Mn(CH3COO)2对E.coli和S.aureus的抑菌圈直径均为6.5 mm,几乎无抗菌作用.配体Cmsatyr和配合物MnCmsatyr对E.coli的抑菌圈直径分别为7.6、9.3 mm,对S.aureus的抑菌圈直径分别为7.5、7.9 mm.对这2种细菌均表现一定的抗菌效果,配合物MnCmsatyr不仅抗菌活性强于配体Cmsatyr,而且对革兰阴性菌E.coli的抗菌活性明显高于对革兰阳性菌S.aureus,抗菌谱表现出一定的选择性.由于抑菌圈直径小于10 mm表示抑菌效果弱[5],因此,上述抑菌圈直径数据说明配体Cmsatyr和配合物MnCmsatyr抑菌能力弱.
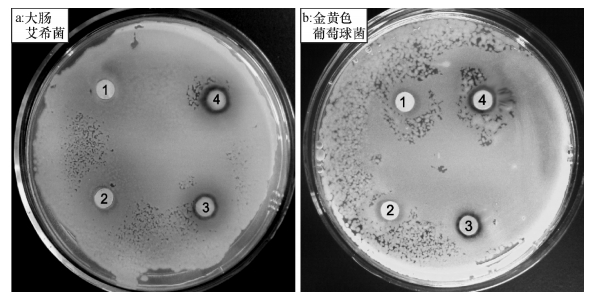
|
图 4 配体Cmsatyr和配合物MnCmsatyr对大肠埃希菌和金黄色葡萄球菌的抑菌圈图 Figure 4 Bacteriostasis circles of Cmsatyr and MnCmsatyr against Escherichia coli and Staphylococcus aureus 1: DMSO; 2: Mn(CH3 COO) 2; 3: Cmsatyr; 4: MnCmsatyr. |
绝大多数天然Mn-SOD酶分子活性中心的金属离子Mn(Ⅱ)为五配位方式,与3个组氨酸(His)、1个天冬氨酸(Asp)及1个H2O配位,图 5显示了天然Mn-SOD分子中Mn (Ⅱ)的配位特点[11-12].据报道,Schiff碱配合物可作为SOD模拟物,具有SOD活性[2, 13],配合物MnCmsatyr的组成和结构表明中心金属离子Mn(Ⅱ)为四配位方式,当配合物溶于水后,由于水分子参与配位可能使得模拟物具有与天然MnSOD类似的结构,因此推测该配合物具有SOD活性.
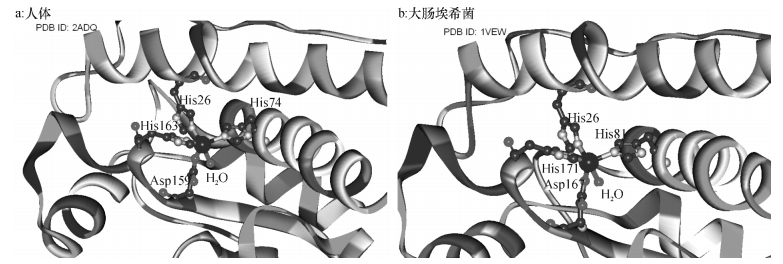
|
图 5 来自人体和大肠埃希菌的天然Mn-SOD的活性中心结构 Figure 5 Active-site structure of native Mn-SOD from human and Escherichia coli |
采用改进的核黄素(VB2)光还原NBT法测定了配体Cmsatyr和配合物MnCmsatyr的SOD活性,测定机理为:在光照下,VB2与四甲基乙二胺作用产生O2-·,O2-·可以使NBT还原为蓝紫色的化合物甲籫,其λmax为560 nm; 当存在SOD或其模拟物时,能够与NBT竞争O2-·,从而抑制NBT还原为蓝紫色化合物.试验未能测出配体Cmsatyr的SOD活性,图 6为测定配合物MnCmsatyr的SOD活性时D560 nm随时间的变化趋势图,线性相关系数R大于0.99,说明该试验结果可信.根据公式计算模拟物的抑制率(η):
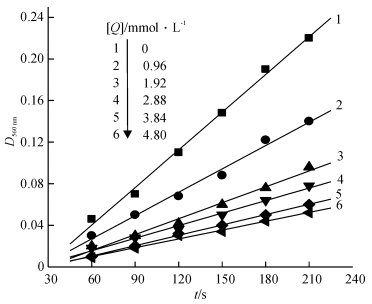
|
图 6 25 ℃下配合物MnCmsatyr的D560 nm受时间影响图 Figure 6 Plot of D560 nm for the complex along with the time at 25 ℃ |
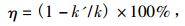
|
式中,k'和k分别为加入和不加模拟物后D560 nm与t直线的斜率.
图 7为配合物MnCmsatyr的抑制率η随其浓度[Q]变化的曲线图,由此求得抑制率η为50%时配合物的浓度,即半数抑制浓度IC50值为1.62 μmol·L-1.根据公式计算配合物的催化速率常数:
|
图 7 25 ℃下配合物MnCmsatyr抑制率与浓度关系 Figure 7 Relationship between the inhibition rate (η) and concentration of the complex at 25 ℃ |
|
式中,KN为6.0 × 104 L·mol-1·s-1,[NBT]和[Q]分别为氯化硝基四氮唑蓝和SOD或配合物的浓度(mol·L-1),ρ为k'/k比值.求得Kcat为3.46 × 106 L·mol-1·s-1.
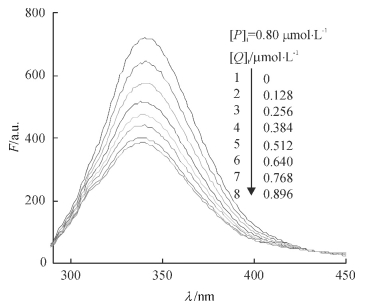
2.4 配合物与BSA的相互作用固定BSA的总浓度,测定了不同浓度配合物MnCmsatyr对生物大分子BSA的荧光猝灭曲线,见图 8,发现随着配合物溶液浓度的增加,BSA的内源性荧光强度有规律地降低,峰位置及峰形基本保持不变,这说明配合物MnCmsatyr与BSA之间发生的作用并未导致BSA的蛋白质结构发生破坏.假设配合物MnCmsatyr对BSA的荧光猝灭过程为动态猝灭,则其作用过程应遵循Stern-Volmer方程:
|
图 8 25 ℃ MnCmsatyr-BSA体系的荧光猝灭曲线 Figure 8 Fluorescence quenching spectra of MnCmsatyr-BSA system at 25 ℃ |
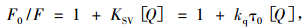
|
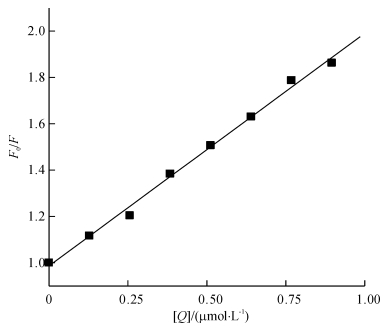
式中,F0、F为加入配合物前后BSA溶液的荧光发射强度; [Q]为配合物的浓度(mol · L-1); KSV为Stern-Volmer猝灭常数(L·mol-1); kq为由扩散控制的双分子动态猝灭速率常数(L·mol-1·s-1); τ0是内源生物大分子的荧光寿命,通常取τ0 = 10-8 s[15].以F0/F对[Q]作图(图 9),图中线性回归的相关系数R为0.998,直线斜率KSV为1.39 × 106 L·mol-1.由公式kq = Ksv/τ0计算得kq为1.39 × 1014 L· mol-1·s-1,显然该值远远大于各类猝灭剂对生物大分子扩散碰撞过程的最大kq (2.0 × 1010 L· mol-1·s-1)[16],这意味着配合物MnCmsatyr对BSA的荧光猝灭不是动态猝灭,故推测静态猝灭是BSA发生荧光猝灭的主要原因[17],即配合物MnCmsatyr与BSA结合形成新的基态复合物.
|
图 9 25 ℃下MnCmsatyr-BSA体系的Stern-Volmer关系图 Figure 9 Stern-Volmer plot of MnCmsatyr-BSA system at 25 ℃ |
对于静态猝灭过程,存在如下关系式[18]:

|
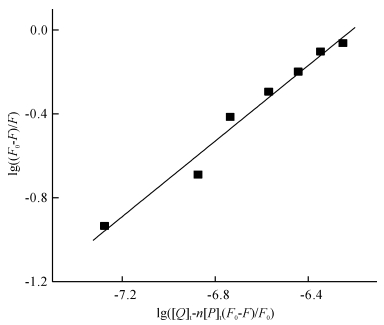
式中,KA为结合常数,n为结合位点数,[Q]t和[P]t分别为是配合物和蛋白质的总摩尔浓度.lg[(F0-F)/F]与lg([Q]t-n[P]t(F0-F)/F0)之间存在线性关系,由直线的斜率和截距可得出n和KA.可以先假设n为1,比较直线的斜率与1是否相等或非常接近,若相差较大,则以该斜率值作为n值,再次通过线性关系获得新的斜率值,经过多次迭代可得到准确的n和KA.图 10为经过5次迭代后得到的lg((F0-F)/F)与lg([Q]t-n[P]t (F0-F)/F0)线性关系图,线性相关系数R为0.986,由直线的斜率和截距计算得到的n为0.901,KA为1.62 × 106 L·mol-1.
|
图 10 25 ℃下MnCmsatyr-BSA体系的lg((F0-F)/F)与lg([Q]t-n[P]t(F0-F)/F0)关系图 Figure 10 The relationship graph of lg((F0-F)/F) and lg([Q]t-n[P]t(F0-F)/F0) plot in MnCmsatyrBSA system at 25 ℃ |
荧光能量转移分为辐射能量转移和非辐射能量转移,辐射能量转移会导致荧光光谱变形[17].图 8中的荧光猝灭曲线并未发生变形,这只能说明MnCmsatyr对BSA的荧光猝灭不是通过辐射能量转移的方式发生的,因为生成复合物和非辐射能量转移都可导致荧光猝灭.根据Förster能量转移理论,能量转移效率E、给体与受体间的距离r、临界能量转移距离R0(E = 50%)、给体的荧光发射光谱与受体的吸收光谱间的重叠积分J之间的关系如下[17, 19]:
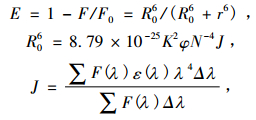
|
式中,K2为偶极空间取向因子,可取受体和给体各向同行的平均值2/3; φ为给体的量子产率,取BSA的荧光量子产率为0.15; N为介质的折射系数,取1.336[20]; ε(λ)为给体在波长为λ时的摩尔吸光系数.
图 11为25 ℃下受体MnCmsatyr的紫外光谱与给体BSA的荧光光谱重叠图,根据公式求得重叠积分J为3.789 × 10-15 cm3·L·mol-1.由MnCmsatyr与BSA摩尔比为1:1时体系的荧光强度求得能量转移效率E为0.441,根据公式计算出R0为3.19,r为3.32 nm.显然,BSA与MnCmsatyr之间的距离r小于8 nm,且0.5R0<r<1.5R0,符合能量转移理论[21],表明MnCmsatyr与BSA能发生非辐射能量转移.
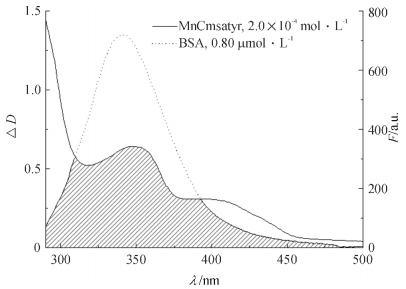
|
图 11 25 ℃条件下MnCmsatyr紫外光谱与BSA荧光光谱重叠图 Figure 11 Overlapping between the UV-vis absorption spectrum of MnCmsatyr and fluorescence emission spectrum of BSA at 25 ℃ |
本文合成了新的Schiff碱配合物MnCmsatyr,其中Mn(Ⅱ)与Schiff碱配体的亚胺基N、酚基O、羧基O及乙酸根的羧基O形成四配位方式,该配合物为1: 1型电解质.据文献报道,Schiff碱及其配合物通常具有抗菌活性[1, 5],配合物MnCmsatyr也不例外,该配合物不仅表现出比其Schiff碱配体更高的抗菌活性,而且对革兰阴性菌E.coli表现出抗菌选择性,但从抑菌圈直径大小来看,该配合物的抗菌活性仍较弱.通常配体与金属离子配位后抗菌活性增强与以下原因有关:一是配位后配体的共轭效应、脂溶性增强,更容易透过生物膜到达靶标部位,发挥更好的抗菌作用; 二是中心金属离子的配位会增强药物与受体之间的电子迁移能力而提高抗菌效果[22].配合物MnCmsatyr与前期报道的5-氯甲基水杨醛缩苯丙氨酸锰配合物[5]相比,在组成上的主要差异是Schiff碱配体中的氨基酸成分不同,前者中的L-Tyr比后者中的L-Phe多了1个-OH,表现在抗菌活性方面的差异是前者对E.coli和S.aureus的抑菌圈直径均较后者大,该结果初步表明Schiff碱配体上引入吸电子基团-OH有利于提高Schiff碱配合物的抗菌活性.
配合物MnCmsatyr与天然SOD酶活性中心的结构相似,这决定着该配合物具有催化超氧阴离子自由基(O2-·)发生歧化反应的SOD活性.IC50和Kcat是用来反映SOD活性大小的2个指标,IC50越小,Kcat越大,则SOD活性越高.与文献报道的SOD模拟物相比,配合物MnCmsatyr的SOD活性比文献[23-24]中的系列Mn-SOD模拟物的低,与文献[25-26]中几个Schiff碱配合物的相当,但与天然CuZn-SOD的IC50 (0.0147 μmol·L-1)[10, 16]和天然Mn-SOD的Kcat (8.00 × 108 L·mol-1·s-1)[17]相差2个数量级.考虑到配合物的相对分子质量(520.9)远低于天然SOD的相对分子质量(CuZn-SOD,32 000[10, 27]; MnSOD,42 000~85 000[28]),若将IC50和Kcat中相应mol·L-1单位换算成g·L-1,则配合物MnCmsatyr的IC50和Kcat值与天然SOD的相差不大.由此可见,配合物MnCmsatyr具有良好的SOD活性,可作为Mn-SOD模拟物.
血清白蛋白在紫外光照射下能发出荧光,是因为它的结构中含有色氨酸Trp、酪氨酸Tyr及苯丙氨酸Phe 3种芳香族氨基酸.Phe的荧光往往不易观察到,而Trp与Tyr常常用作蛋白的内源荧光探针,天然蛋白质的内源荧光主要表现为分子内Trp残基的发射.药物分子对蛋白质的荧光猝灭机制通常可分为动态猝灭、静态猝灭[17].动态猝灭是指猝灭剂在荧光寿命期间扩散至荧光物且相互作用而导致荧光物由激发态返回到基态,不发射光子; 静态猝灭是由于猝灭剂和荧光物质发生反应,形成不发荧光的配合物引起的[17].血清白蛋白是大多数药物的体内载体,研究表明配合物MnCmsatyr能够通过静态猝灭机理有效猝灭BSA的内源荧光,且与给体间可发生非辐射能量转移.其结合位点数n为0.901、结合常数KA分别为1.62 × 106 L·mol-1.n值与文献报道的大多数小分子化合物与BSA的结合位点数(约为1)接近,但KA值与文献中小分子化合物与BSA的结合常数KA值相比[19, 21]是较大的,这表明配合物MnCmsatyr与BSA的结合牢固程度较高,意味着该配合物若作为药物分子可被蛋白质运输和储存,而且具有良好的药效持久性,呈现出作为药物应用的潜质.
目前尚未明确配合物MnCmsatyr的抗菌活性是否与其SOD活性或与蛋白质的作用有直接关系,本研究结果将为后续设计和筛选高效低毒的抗菌药物及SOD模拟物提供一定的科学研究基础及理论依据,同时也为这类药物的开发和应用提供了一些筛选和评价的参考依据.
| [1] |
刘玉婷, 张洁心, 尹大伟. 氨基酸schiff碱及其金属配合物的性能研究进展[J]. 氨基酸和生物资源, 2008, 30(3): 51-54. DOI:10.3969/j.issn.1006-8376.2008.03.013 (  0) 0) |
| [2] |
乔艳红, 孙命. 邻香兰素-氨基酸席夫碱及其配合物对O2-·的抑制作用[J]. 化学研究与应用, 2003, 15(4): 583-584. DOI:10.3969/j.issn.1004-1656.2003.04.048 (  0) 0) |
| [3] |
BUJACZ A. Structures of bovine, equine and leporine serum albumin[J]. Acta Cryst D, 2012, 68(10): 1278-1289. DOI:10.1107/S0907444912027047 (  0) 0) |
| [4] |
熊亚红, 梁毅, 陈洁霞, 等. 5-氯甲基水杨醛合成方法的改进[J]. 广州化工, 2009, 37(9): 97-98. DOI:10.3969/j.issn.1001-9677.2009.09.031 (  0) 0) |
| [5] |
熊亚红, 梁毅, 陈祖强, 等. 5-氯甲基水杨醛缩苯丙氨酸过渡金属(Ⅱ)配合物的合成及抗菌活性[J]. 华南农业大学学报, 2013, 34(1): 111-116. (  0) 0) |
| [6] |
史卫良, 陈德余. 水杨醛酪氨酸铜配合物合成和EPR波谱[J]. 物理化学学报, 2001, 17(2): 181-184. DOI:10.3866/PKU.WHXB20010219 (  0) 0) |
| [7] |
自俊青, 邓希贤. 氮蓝四唑光照法实验操作的改进及效果[J]. 北京师范大学学报:自然科学版, 1998, 34(1): 101-104. (  0) 0) |
| [8] |
GEARY W J. The use of conductivity measurements in organic solvents for the characterization of coordination compounds[J]. Coord Chem Rev, 1971, 7(1): 81-122. DOI:10.1016/S0010-8545(00)80009-0 (  0) 0) |
| [9] |
谢海泉, 党元林, 卓立宏. 过渡金属氨基酸席夫碱配合物的合成[J]. 合成化学, 2007, 15(3): 362-364. DOI:10.3969/j.issn.1005-1511.2007.03.030 (  0) 0) |
| [10] |
廖升荣, 乐学义, 卢其明, 等. 1, 10-邻菲咯啉-铜(Ⅱ)-氨基酸配合物的合成、表征及其SOD活性[J]. 华南农业大学学报, 2006, 27(3): 122-124. DOI:10.3969/j.issn.1001-411X.2006.03.034 (  0) 0) |
| [11] |
QUINT P, REUTZEL R, MIKULSKI R, et al. Crystal structure of nitrated human manganese superoxide dismutase: Mechanism of inactivation[J]. Free Radic Biol Med, 2006, 40(3): 453-458. DOI:10.1016/j.freeradbiomed.2005.08.045 (  0) 0) |
| [12] |
EDWARDS R A, BAKER H M, WHITTAKER M M, et al. Crystal structure of Escherichia coli manganese superoxide dismutase at 2.1-Å resolution[J]. J Biol Inorg Chem, 1998, 3(2): 161-171. DOI:10.1007/s007750050217 (  0) 0) |
| [13] |
江银枝, 陈德余, 陈伟国. 邻香草醛谷氨酸铜、锌配合物的合成、波谱及其抗O2-·性能[J]. 化学研究与应用, 1999, 11(4): 402-405. (  0) 0) |
| [14] |
罗勤慧, 沈孟长, 高伟光. 光照法研究超氧化物歧化酶及其模型物化合物与超氧离子的反应动力学[J]. 高等学校化学学报, 1990, 11(9): 928-932. DOI:10.3321/j.issn:0251-0790.1990.09.003 (  0) 0) |
| [15] |
LAKOWICA J R, WEBER G. Quenching of fluorescence by oxygen: Probe for structural fluctuations in macromolecules[J]. Biochemistry, 1973, 12(21): 4161-4170. DOI:10.1021/bi00745a020 (  0) 0) |
| [16] |
WARE W R. Oxygen quenching of fluorescence in solution: An experimental study of the diffusion process[J]. J Phys Chem, 1962, 66(3): 455-458. DOI:10.1021/j100809a020 (  0) 0) |
| [17] |
LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. 3 Ed. New York: Springer Verlag New York Inc., 2006: 278-285.
(  0) 0) |
| [18] |
BI S, DING L, TIAN Y, et al. Investigation of the interaction between flavonoids and human serum albumin[J]. J Mol Struct, 2004, 703(1): 37-45. (  0) 0) |
| [19] |
RAY A, KOLEY SETH B, PAL U, et al. Nickel(Ⅱ)-Schiff base complex recognizing domain Ⅱ of bovine and human serum albumin: Spectroscopic and docking studies[J]. Spectrochim Acta A, 2012, 92: 164-174. DOI:10.1016/j.saa.2012.02.060 (  0) 0) |
| [20] |
YUE Y Y, CHEN X G, QIN J, et al. Characterization of the mangiferin-human serum albumin complex by spectroscopic and molecular modeling approaches[J]. J Pharm Biomed Anal, 2009, 49(3): 753-759. DOI:10.1016/j.jpba.2008.12.017 (  0) 0) |
| [21] |
ZHANG H, LIU E. Binding behavior of DEHP to albumin: Spectroscopic investigation[J]. J Incl Phenom Macrocycl Chem, 2012, 74(1/2/3/4): 231-238. (  0) 0) |
| [22] |
CHOHAN Z H, ARIF M, SARFRAZ M. Metal-based antibacterial and antifungal amino acid derived Schiff bases: Their synthesis, characterization and in vitro biological activity[J]. Appl Organomet Chem, 2007, 21(4): 294-302. DOI:10.1002/(ISSN)1099-0739 (  0) 0) |
| [23] |
廖升荣, 卢其明, 刘小平, 等. Mn(Ⅱ)-氨基酸配合物的合成及其SOD活性[J]. 化学研究与应用, 2006, 18(2): 173-177. DOI:10.3969/j.issn.1004-1656.2006.02.013 (  0) 0) |
| [24] |
廖升荣, 毛小云, 何文芬, 等. Mn-SOD模拟物的合成及其SOD活性[J]. 中国农学通报, 2008, 24(2): 225-228. (  0) 0) |
| [25] |
PUGLISI A, TABBI G, VECCHIO G. Bioconjugates of cyclodextrins of manganese salen-type ligand with superoxide dismutase activity[J]. J Inorg Biochem, 2004, 98(6): 969-976. DOI:10.1016/j.jinorgbio.2004.02.012 (  0) 0) |
| [26] |
MORENO D, DAIER V, PALOPOLI C, et al. Synthesis, characterization and antioxidant activity of water soluble MnⅢ complexes of sulphonato-substituted Schiff base ligands[J]. J Inorg Biochem, 2010, 104(5): 496-502. DOI:10.1016/j.jinorgbio.2009.12.016 (  0) 0) |
| [27] |
廖升荣, 乐学义, 林庆斌, 等. Phen-铜(Ⅱ)-氨基酸配合物的合成、表征及其SOD活性[J]. 无机化学学报, 2006, 22(2): 201-206. DOI:10.3321/j.issn:1001-4861.2006.02.002 (  0) 0) |
| [28] |
HSU J L, HSIEH Y H, TU C, et al. Catalytic properties of human manganese superoxide dismutase[J]. J Biol Chem, 1996, 271(30): 17687-17691. DOI:10.1074/jbc.271.30.17687 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36

