布鲁菌病(Brucellosis)是世界范围内的重大人畜共患传染病之一,牛、羊、猪等多种动物和人均可感染该病,其导致的巨大经济损失和严重公共卫生问题一直备受人们关注.目前布鲁菌属Brucella中以马耳他型布鲁菌B.melitensis对人类的致病性最强、危害最重,在我国也最为流行[1],因此对马耳他型布鲁菌病的防控是非常必要的.临床上主要通过接种减毒活疫苗Rev.1、M5及M5-90等预防控制此病,其中M5株弱毒苗是通过将马耳他型强毒株M28由鸡体连续传代致弱而研制成功,自20世纪70年代起被广泛应用于我国,在有效控制羊布鲁菌病方面发挥了重大作用,但M5株仍具有布鲁菌弱毒苗普遍存在的残余毒力强、易引起孕畜流产、干扰血清学检测等缺点[2-3].为克服以上缺点,构建安全、稳定、易检测的基因工程疫苗势在必行.ATP结合盒式蛋白(ATP-binding cassette transporter)又称ABC转运蛋白,是细菌的一种物质转运蛋白,参与微生物体内的各种生理活动,如维持细胞内外渗透压平衡、抗原呈递、细胞分化、细菌免疫、胆固醇及脂质的运输[4].其中,锌ABC转运蛋白(ZnuABC)为ABC转运蛋白中的一种金属离子转运蛋白,研究表明高亲和力ZnuABC蛋白不仅与细菌吸收运输锌离子相关,也和多种细菌的致病力有着直接或间接的关系[5-7].Bp26蛋白是布鲁菌的外膜周质蛋白,该蛋白具有较强的免疫活性,能够有效地诱导机体产生特异性抗体.近年来,Bp26蛋白成为了布鲁菌血清学诊断的重要靶蛋白,此外,bp26基因缺失标记型疫苗株在区分布鲁菌人工免疫与野毒感染方面具有的优势使bp26基因成为现在布鲁菌基因缺失疫苗株的主要靶基因.
本研究以马耳他型布鲁菌M5株和缺失株M5- Δbp26为亲本株,利用同源重组技术对其进行改造,敲除编码锌离子转运蛋白znuABC中的znuA基因,获得了单基因缺失株M5-ΔznuA和双基因缺失株M5-Δbp26-ΔznuA.对2种缺失株的形态、生长特性、遗传稳定性进行鉴定;并通过小鼠试验比较了缺失株M5-ΔznuA、M5-Δbp26-ΔznuA及M5-Δbp26和亲本株M5的毒力和免疫原性的强弱.
1 材料与方法 1.1 菌株、质粒、载体、蛋白马耳他型布鲁菌减毒活疫苗株M5购于新疆天康畜牧生物技术股份有限公司,大肠埃希菌Escherichia coli DH5α λ pir、PRE112自杀质粒(cat,sacB,oriTRP4,oriVR6K,MCS)为华南农业大学微生物学与免疫学教研室保存;布鲁菌疫苗缺失株M5-Δbp26及布鲁菌BLS-L7/L12融合蛋白(BL蛋白)为华南农业大学微生物学与免疫学教研室构建并保存.
1.2 主要试剂KOD FX DNA Polymerase高保真酶为TOYOBO公司产品;限制性内切酶Kpn I和Sac I、T4 DNA连接酶、DNA Marker等为TaKaRa公司产品;胶回收试剂盒、小量质粒提取试剂盒为Omega公司产品;QIAamp DNA提取试剂盒为QIAGEN公司产品.
1.3 试验动物120只5 ~ 6周龄雌性Balb/c小鼠、鼠粮、垫料均购自广东省医学实验动物中心.
1.4 布鲁菌单基因缺失株M5-ΔznuA及双基因缺失株M5-Δbp26-ΔznuA的构建 1.4.1 引物合成及ΔznuA基因片段的构建按QIAamp DNA抽提试剂盒说明书提取马耳他型布鲁菌M5株基因组DNA.根据该菌株znuA基因(BMEA_B1116)左右两端序列运用Primer5.0设计2对通用引物对序列进行扩增,引物如下:F1:5′-GATGGTACCCGTCCTCGTTTGCTTGTGC-3′(KpnI),R1:5′-TCGCTGAAAGACTGCCTGT-3′;F2:5′-GCAGTCTTTCAGCGAAGCCAGAAAGGCAGAAGC-3′,R2:5′-AGAGAGCTCCAATGTCCCCTTGGTCCC-3′(Sac I).其中F1和R2的5′端分别添加Kpn I和Sac I酶切位点(斜体部分),F2的5′端添加R1中15个碱基的反向互补序列(划线部分),引物由上海立菲生物技术有限公司合成.用引物F1和R1扩增znuA基因的左端同源臂片段ZN-L,F2和R2扩增该基因右端同源臂片段ZN-R,再以获得的ZN-L和ZN-R片段回收纯化产物为模版,用引物F1、R2进行Overlap PCR扩增,获得缺失znuA基因的片段ΔznuA.
1.4.2 重组自杀质粒pRE-M5-ΔznuA的构建双酶切自杀载体PRE112和ΔznuA片段,纯化回收后用T4 DNA连接酶连接(反应体系和反应条件按说明书操作),转化大肠埃希菌DH5α λ pir,经菌落PCR鉴定、双酶切验证并基因测序正确,获得自杀性同源重组质粒pRE-M5-ΔznuA.
1.4.3 缺失株M5-ΔznuA和M5-Δbp26-ΔznuA的构建参考潘文等[8],制备M5和M5-Δbp26感受态细胞,将自杀性质粒pRE-M5-ΔznuA分别电转入2种感受态细胞,恢复质粒抗性后涂布TSA-YE-Cm平板,37 ℃培养约72 h,随机挑选单交换子,菌落PCR验证,得到2菌株的同源重组单交换子.分别挑取上述2组同源重组单交换子接种至TSB-YE中培养约20 h,菌液适当稀释后涂TSA-YE-Sucorse平板培养72 ~ 96 h,利用自杀质粒PRE112中sacB基因对蔗糖的敏感性进行筛选,经PCR验证和基因测序正确,获得M5和M5-Δbp26缺失znuA基因的同源重组双交换子,即布鲁菌单基因缺失株M5-ΔznuA和双基因缺失株M5-Δbp26-ΔznuA.
1.5 缺失株M5-ΔznuA和M5-Δbp26-ΔznuA的生物学特性及遗传稳定性鉴定 1.5.1 形态学和生化特性鉴定将2种缺失株M5-ΔznuA、M5-Δbp26-ΔznuA和亲本株M5在TSA-YE上培养约48 h,待长出单菌落后肉眼观察菌落形态.挑单菌落接种至TSB-YE中,37 ℃摇床振荡培养约24 h,用革兰染色法和科兹洛夫斯基法染色,显微镜下观察细菌形态及染色情况.通过糖发酵试验、枸橼酸盐利用试验、吲哚试验等几种生化试验,比较缺失株与亲本株之间的生化特性差异.
1.5.2 生长特性分别培养M5、M5-ΔznuA和M5-Δbp26-ΔznuA纯培养菌液,分别将各菌液浓度调整一致(D600 nm为0.6),按体积比1: 100接种至TSB-YE液体培养基中,37 ℃ 200 r·min-1振荡培养,隔4 h取1 mL菌液测定其D600 nm并做10倍系列稀释后涂布TSA-YE平板,统计3株菌72 h内菌落数,绘制生长曲线.遗传稳定性测定:M5-ΔznuA和M5-Δbp26-ΔznuA在培养基上连续传20代,隔代次进行菌落PCR鉴定,确定缺失株的体外传代稳定性.
1.6 缺失株对Balb/c小鼠的毒力测定将3种缺失株M5-Δbp26、M5-ΔznuA、M5-Δbp26- ΔznuA和亲本株M5在TSB-YE中培养约24 h,离心收集菌体,PBS清洗重悬后进行细菌计数,按108 CFU的量调整菌液浓度,再分别以每只0.2 mL腹腔接种5 ~ 6周龄雌性Balb/c小鼠各12只,空白对照组为接种等量的PBS,接种3 d内观察所有小鼠存活情况.接种后的第2、4、6、8周分别按每组3只对各组小鼠称体质量,断颈处死后无菌取脾脏称质量并研磨成匀浆,脾脏匀浆作10倍系列稀释涂布TSAYE平板,进行菌数量计数.
1.7 缺失株对Balb/c小鼠的免疫原性评估培养M5、M5-Δbp26、M5-ΔznuA、M5-Δbp26- ΔznuA 4株菌的纯培养菌液,以PBS溶液为空白对照,分别以每只5 × 105 CFU的剂量腹腔接种Balb/c小鼠,接种后8周内每隔1周每组各取3只小鼠眼窦静脉采血分离血清,作为待检样本保存备用.以布鲁菌BL融合蛋白为包被抗原进行间接ELISA检测,按照常艳等[9]建立的方法,确定最佳抗原浓度及血清稀释比例,iELISA方法检测待检血清中BL特异性抗体水平.
2 结果与分析 2.1 M5株ΔznuA片段的构建对M5株znuA基因左右端同源臂分别扩增,得到左端同源臂ZN-L片段大小为1 098 bp;右端同源臂ZN-R片段大小为1 149 bp.以ZN-L、ZN-R为模板进行overlap PCR扩增,得到缺失中间znuA基因的大小为2 247 bp的片段,与理论值相符,表明ΔznuA片段构建成功(图 1).

|
图 1 布鲁菌M5株znuA基因左右端同源臂ZN-L、ZN-R片段及ΔznuA片段的PCR扩增 Figure 1 PCR amplification of znuA gene about up homologous arms ZN-L and down homologous arms ZN-R and the ΔznuA of Brucella M5 strain M:DNA marker DL5000;1:左端同源臂ZN-L;2:右端同源臂ZN-R;3:ΔznuA片段. |
Kpn I、Sac I双酶切PRE112和ΔznuA并对两者进行连接,连接产物转化大肠埃希菌DH5α λ pir,随机挑选转化子用引物F1和R2进行菌落PCR验证,阳性克隆获得后进行质粒抽提,对其双酶切PCR验证并送交测序,酶切验证结果与ΔznuA片段大小相同为2 247 bp,测序结果与ΔzunA片段序列完全一致,表明重组自杀质粒pRE-M5-ΔznuA构建成功.
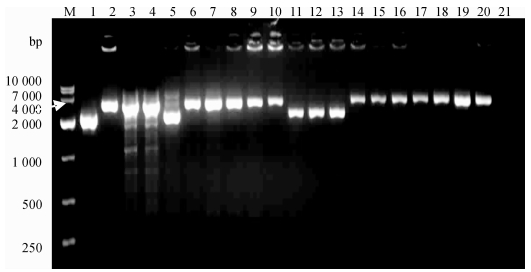
2.3 缺失株M5-ΔznuA和M5-Δbp26-ΔznuA的筛选与鉴定自杀性质粒pRE-M5-ΔznuA在1.8 kV、400 Ω、25 μF的电场强度下分别电转入M5和M5-Δbp26感受态细胞中,通过氯霉素抗性平板筛选获得的阳性克隆用引物F1/R2进行扩增,从PCR产物的凝胶电泳图中可观察到在3 180与2 247 bp处的2条片段,验证结果与预期相符(如图 2,以M5-ΔznuA为例),得到同源重组单交换子.利用pRE-M5-ΔznuA质粒中含有的sacB基因对蔗糖的敏感性,将同源重组单交换子在TSA-YE-Sucrose中培养筛选得到同源重组双交换子,PCR扩增,凝胶电泳图显示条带大小为2 247 bp,与预期结果相符(如图 3,以M5-ΔznuA为例).送测序验证正确,得到目标菌株M5-ΔznuA和M5-Δbp26-ΔznuA.

|
图 2 布鲁菌M5-ΔznuA株同源重组单交换子的PCR鉴定 Figure 2 PCR identification of homologous recombination single crossover of Brucella M5-ΔznuA strain M:DNA marker DL10000;1:M5株ΔznuA阳性对照;2:M5株znuA阳性对照;3 ~ 6:M5 ΔznuA同源重组单交换子的PCR产物;7:阴性对照. |
|
图 3 布鲁菌M5-ΔznuA株同源重组双交换子的PCR鉴定 Figure 3 PCR identification of homologous recombination double crossover of Brucella M5-ΔznuA strain M:DNA marker DL10000;1:M5株ΔznuA阳性对照2:M5株znuA阳性对照;3 ~ 20:同源重组双交换子PCR产物,其中5、11、12、13泳道为M5- ΔznuA;21:阴性对照. |
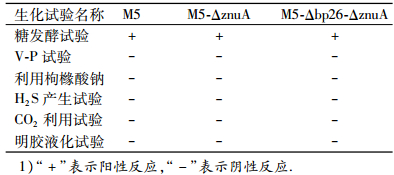
将2株缺失株和亲本株M5分别在TSA-YE培养基上划线培养72 h后,均长出无色半透明、表面圆润光滑、边缘整齐、圆形稍隆起、均质样的露滴状单菌落;在液体培养基中均匀浑浊生长,不透明;2种缺失株菌落涂片革兰染色镜检,菌体均被染成红色、单个散在的、无鞭毛无芽孢球杆状菌;科兹洛夫斯基染色镜检,2种缺失株的菌体均被染成红色,而其他的组织细胞及杂物均被染成绿色,与布鲁菌M5的染色特性一致.多种生化反应试验显示缺失株与亲本株在生长特性上没有差异(表 1).
|
|
表 1 3种菌株的生化特性鉴定结果1) Table 1 The biochemical characteristics of three Brucella mutant strains |
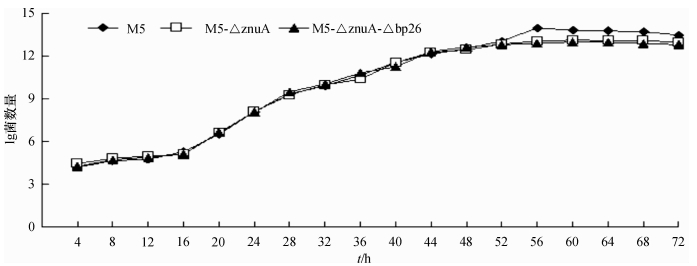
以相同的剂量在TSB-YE中分别培养M5、M5-ΔznuA和M5-Δbp26-ΔznuA菌液共72 h,每4 h吸取1 mL菌液,10倍系列稀释后涂布于TSA-YE平板,37 ℃培养48 ~ 72 h,记录平板上的菌落数,并绘制生长曲线,如图 4所示,构建的2种缺失株与亲本株的生长特性无显著性差异,表明在营养充足的条件下单基因缺失(znuA)或双基因缺失(znuA、bp26)不会影响布鲁菌的生长.M5-ΔznuA和M5-Δbp26-ΔznuA体外传代培养至20代,隔代次进行菌落PCR和基因测序,均未发生回复突变,表明2种缺失株遗传稳定性良好(图 5,仅以M5-ΔznuA为例).
|
图 4 布鲁菌M5、M5-ΔznuA及M5-Δbp26-ΔznuA株的生长曲线 Figure 4 Growth curves of Brucella M5, M5-ΔznuA and M5-Δbp26-ΔznuA strains |

|
图 5 布鲁菌M5-ΔznuA株遗传稳定性的PCR鉴定 Figure 5 PCR identification of genetic stability of Brucella M5- ΔznuA strain M:DNA marker DL10000;1:M5株ΔznuA阳性对照;2:M5株znuA阳性对照;3 ~ 12:缺失株M5-ΔznuA第2、4、6、8、10、12、14、16、18、20代菌落的PCR鉴定;13:阴性对照. |
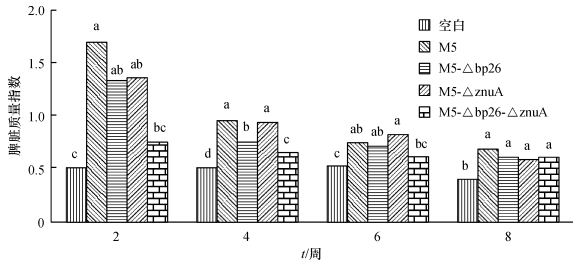
5 ~ 6周龄的雌性Balb/c小鼠,每只小鼠腹腔注射108 CFU的待测菌液,并在接种的3 d之内每天观察小鼠的精神状态直至恢复正常为止.接种后24 ~ 48 h内亲本株M5及3种缺失株M5-Δbp26、M5-ΔznuA和M5-Δbp26-ΔznuA组内小鼠暂时出现轻度的精神萎靡、被毛凌乱现象,在72 h内均恢复正常,未见死亡,对照组全部正常,表明缺失株对小鼠具有良好的安全性.接种后每个试验组每2周随机取3只小鼠,称体质量,无菌取脾称质量,以每10 g体质量中脾脏所占质量(mg)表示脾脏质量指数,如图 6所示,布鲁菌减毒活疫苗的接种均会引起小鼠脾脏的肿大,脾脏的肿大程度随着时间的延长而逐渐减弱,尤其在接种后4周,脾脏的肿胀程度明显低于接种后2周.接种后4 ~ 8周3株缺失株脾脏的质量变化与PBS的空白组比较变化不大.从图 6中,可知3种基因缺失株引起脾脏的肿胀程度均低于亲本株M5.在3种缺失突变株中,双基因缺失株M5-Δbp26-ΔznuA试验组的脾脏指数最小与亲本株M5具有显著性差异,此外,与单基因缺失株M5-ΔznuA组及M5-Δbp26组也成显著性差异.
|
图 6 接种M5、M5-Δbp26、M5-ΔznuA和M5-Δbp26-ΔznuA后小鼠脾脏质量指数测定 Figure 6 Spleen mass of mice infected with M5, M5-Δbp26, M5-ΔznuA and M5-Δbp26-ΔznuA 脾脏质量指数为每10 g体质量中脾脏所占质量(mg);图中同一时间点不同柱子上凡是有一个相同小写字母者,表示差异不显著(P<0.05,单因素方差分析). |
将上述脾脏研磨成匀浆,PBS倍比稀释后涂布于TSA-YE平板,菌落计数结果如图 7,在接种8周内可见3种缺失株在小鼠体内的脾菌数残留量均随时间而逐渐减少(被排出体外),其中亲本株M5的脾菌数残留量呈平稳降低态势,在8周时仍维持4.46lg10左右的量,高于其余3株缺失株M5-Δbp26、M5-ΔznuA和M5-Δbp26-ΔznuA约2.0lg10,有着较强的毒力;M5-Δbp26-ΔznuA在脾脏内残留菌数量最少,免疫2周时较M5低0.75lg10,并随时间呈逐渐减少趋势,8周时脾脏内所含的菌数量约2.5lg10,基本被清出小鼠体外.在接种后8周时,脾菌数残留量为M5>M5-Δbp26>M5-ΔznuA>M5-Δbp26-ΔznuA,表明单基因缺失株M5-ΔznuA和M5-Δbp26的毒力较之亲本株M5有所降低,而双基因缺失株M5-Δbp26-ΔznuA的毒力最低.

|
图 7 M5、M5-ΔznuA、M5-Δbp26、M5-Δbp26-ΔznuA接种小鼠脾脏细菌残留量测定结果 Figure 7 Test results of bacterial residue of M5, M5-ΔznuA, M5- Δbp26 and M5-Δbp26-ΔznuA in the spleen of infected mice |
M5株和M5-ΔznuA、M5-Δbp26、M5-Δbp26-ΔznuA株分别以5 × 105 CFU剂量免疫小鼠,每2周眼窦静脉采集1次血清,iELISA检测方法检测血清中抗BLS-L7/L12蛋白特异性抗体的产生量.抗原的包被浓度5 μg·mL-1、血清稀释度1: 80时为P/N最优值,测定结果如图 8,M5和M5-ΔznuA株接种小鼠诱导产生的BLS-L7/L12特异性抗体水平随时间变化趋势基本一致,且均在免疫小鼠后4周时达到峰值,此时M5抗体量略高于M5-ΔznuA,随着时间的延长,各自特异性抗体量也逐渐下降直至维持在稳定的同等水平内,表明M5-ΔznuA与M5株均能引起小鼠产生相应程度的免疫应答;而M5-Δbp26和M5-Δbp26-ΔznuA株诱导小鼠产生特异性抗体的量在第6周时达到峰值,其中前者在前4周内产生的抗体量与M5在2周内产生的抗体量几乎相同,随时间延长逐渐增加至与M5峰量几乎等值,说明bp26基因的缺失对疫苗株的免疫原性影响不大,与M5相比仅在短期免疫的过程中产生免疫应答的时间略有推迟.后者在4周内诱导小鼠产生的抗体量已与M5株相同,其峰值量则远远高于亲本株M5.
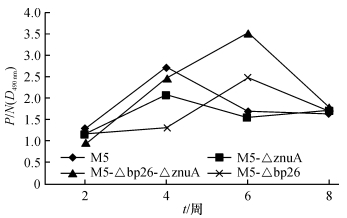
|
图 8 免疫小鼠血清中BL特异性抗体间接ELISA测定结果 Figure 8 iELISA results of antibody responses to BL in the serum of mouse immunized |
布鲁菌为细胞内寄生的兼性需氧型革兰阴性菌,可引起多种动物和人的感染,其感染动物后主要通过进入宿主细胞生存繁殖并产生毒力作用造成致病[10].布鲁菌毒力基因的存在,一方面使该菌逃避吞噬细胞的抗菌作用,成功进入宿主细胞内寄生繁殖,造成细胞损伤;另一方面也可使该菌避免宿主细胞的杀害机制从而引起长期的细胞毒性与慢性感染[10-12].因此,改造诱发布鲁菌产生毒力的基因可极大地降低该菌的细胞损伤能力,从而降低致病力.
ABC转运蛋白是一种在微生物中普遍存在的具有一系列功能的载体蛋白,对细菌获取和运输所需的各种营养物质,影响部分病原菌的致病过程等方面起到重要作用[13].锌离子作为细菌多种结构蛋白的组成成分和代谢过程的催化因子,是细菌生长所必须的微量元素.高亲和力的ZnuABC是细菌主要的锌吸收转运系统,存在于大肠埃希菌、嗜血杆菌、淋球菌、巴斯德菌、布鲁菌等多种菌体中,ZnuABC不仅参与锌的运输,还和多种病原菌的致病性相关[5, 14-18].Yang等[16-17]将流产布鲁菌Brucella abortus 2308中的znuA基因敲除,证明了ΔznuA2308菌株抵抗巨噬细胞吞噬的能力下降、对Balb/c小鼠的毒力小且免疫保护力与S19、RB51相当.在此基础上他们又构建了1株znuA和purE双基因缺失株ΔznuAΔpurE2308,该株显示出对小鼠单剂量毒力高于ΔznuA2308株,双剂量毒力与ΔznuA2308相当的特性,但无论单基因缺失株还是双基因缺失株、无论接种小鼠的剂量大小,均比S19疫苗株对小鼠的毒力要低,因此缺失株ΔznuA2308和ΔznuA-ΔpurE2308均可作为布鲁菌新型疫苗潜在候选者进行研究与开发.
本研究,以羊种布鲁菌减毒活疫苗M5株及缺失bp26基因的M5-Δbp26缺失突变株为亲本株,通过Overlap PCR方法扩增获得了缺失znuA基因的片段ΔznuA.利用含有sacB基因的自杀质粒PRE112为载体,通过等位基因交换的方法成功敲除布鲁菌的重要抗原基因znuA,构建了具有非抗性基因标记的缺失株M5-ΔznuA和M5-Δbp26-ΔznuA.构建的2株缺失株在形态、生长、培养、染色、生化等生物学特性方面与亲本株基本保持一致,且体外遗传性状稳定,为开发新型布鲁菌疫苗奠定基础.
通过对比M5-ΔznuA、M5-Δbp26株与M5株之间的脾脏菌数残留量(即小鼠康复时间)和脾脏质量指数来判断缺失株的毒力大小,发现M5-ΔznuA株比M5株毒力有明显的减小,比前人[18-19]构建的流产型布鲁菌znuA基因缺失株在HeLa细胞和巨噬细胞内的生存力低,较亲本株毒力小,杜克嗜血杆菌Haemophilus ducreyi缺失znuA基因突变株[6]构建的ΔznuA2308缺失株具有巨噬细胞内生存能力低、对Balb/c小鼠毒力小且免疫保护力与S19、RB51相当的研究结论相符.缺失株M5-Δbp26(兽医微生物学与免疫学教研室保存)的毒力检测中发现其比亲本株M5引起小鼠的炎症反应稍弱,差异并不显著,小鼠康复时间(脾菌数残留量)与亲本株M5的基本保持一致,说明M5-Δbp26株在对小鼠的毒力方面与M5株相差不大,与胡森[23]构建的1株布鲁菌bp26基因缺失株M5-90-26在安全性及免疫原性方面与亲本株相比均未发生改变,并具备从血清学角度区分人工免疫和自然感染布鲁菌的优势的研究结果一致.在对2种缺失株毒力大小进行对比的试验中我们得出M5-Δbp26株比M5株的毒力减弱程度不如M5-ΔznuA株的结论.
本研究在M5-Δbp26株的基础上又敲除了znuA基因,构建1株双基因缺失株M5-Δbp26-ΔznuA,期望为开发安全性好、毒力小、能保持良好免疫原性又能从血清学角度区分人工免疫和野毒感染的布鲁菌新型疫苗提供新的途径.研究结果表明,bp26和znuA双基因的缺失对亲本株M5的生物学特性无影响,且M5-Δbp26-ΔznuA株对小鼠的毒力远远低于亲本株,也比2株单基因缺失株要低,呈显著性差异.陈瑞花等[24]构建bp26基因缺失株M5-90Δbp26并表达了BP26蛋白,胚胎滋养层细胞侵染结果表明BP26蛋白对细胞具有毒性作用,且缺失株M5-90Δbp26的细胞毒性小于亲本株,但由于缺失株在侵染细胞后仍产生大量脱落和溶解的细胞,说明bp26基因可能是协同多种基因在布鲁菌侵染细胞的过程中发挥细胞毒性作用.本试验结果与此结论相符.
我们又通过对比M5株和3种缺失株在诱导小鼠产生特异性抗体水平方面进行了缺失株免疫原性的研究,发现M5-Δbp26-ΔznuA株诱发小鼠产生的特异性抗体水平比M5和M5-Δbp26、M5-ΔznuA株均强,具有更好的免疫原性,而bp26基因缺失株M5-Δbp26的免疫原性与亲本株基本保持一致,仅在产生免疫应答的时间上较M5株推迟了2周.推测znuA和bp26基因在机体对布鲁菌的免疫过程中可能具有一定的相关性作用.缺失株M5-ΔznuA产生的抗体量消长趋势与M5株基本一致,维持时间与脾菌数残留时间成正相关,说明该菌株也能诱导小鼠产生相应的免疫应答,保持了相对良好的免疫原性,与李先富等[25]研究的猪链球菌Streptococcus suis中ZnuA蛋白对小鼠具有良好的免疫保护作用结论基本相符.
综上所述,本研究对布鲁菌M5株进行基因改造,构建了2株基因缺失株M5-ΔznuA和M5-Δbp26-ΔznuA,进一步证实了潘文等[8]非抗性基因标记方法的可行性.在几种缺失株与亲本株的毒力、免疫原性比较方面,发现M5-ΔznuA株在毒力降低的同时保持了自身良好的免疫原性,而双基因缺失株M5-Δbp26-ΔznuA毒力最低、免疫原性最好,又基于bp26基因的缺失标记使该菌株具有能在血清学诊断方面区别人工免疫或野毒感染的优势.布鲁菌单基因缺失株M5-ΔznuA和双基因缺失株M5-Δbp26-ΔznuA的构建为布鲁菌新型疫苗的研究提供新的途径,也为研究布鲁菌Bp26蛋白与ZnuA蛋白在布鲁菌致病过程中[26]的相互关系奠定了基础.
| [1] |
SHANG D Q, XIAO D L, YIN J M. Epidemiology and con trol of brucellosis in China[J]. Vet Microbiol, 2002, 90(1/2/3/4): 165-182. (  0) 0) |
| [2] |
SCHURIG G G, SRIRANGANATHAN N, CORBEL M J. Brucellosis vaccines:Past, present and future[J]. Vet Mi crobiol, 2002, 90(1/2/3/4): 479-496. (  0) 0) |
| [3] |
BLASCO J M. A review of the use of B.melitensis Rev.1 vaccine in adult sheep and goats[J]. Prev Vet Med, 1997, 31(3/4): 275-283. (  0) 0) |
| [4] |
王华丙, 张振义, 包锐, 等. ABC转运蛋白的结构与转运机制[J]. 生命的化学, 2007, 27(3): 208-209. DOI:10.3969/j.issn.1000-1336.2007.03.006 (  0) 0) |
| [5] |
CHEN C Y, MORSE S A. Identification and characteriza tion of a high-affinity zinc uptake system in Neisseria gon-orrhoeae[J]. FEMS Microbilo Lett, 2001, 202(1): 67-71. DOI:10.1111/fml.2001.202.issue-1 (  0) 0) |
| [6] |
LEWIS D A, KLESNEY-TAIT J, LUMBLEY S R, et al. Identification of the znuA-encoded periplasmic zinc transport of Haemophilus ducreyi[J]. Infect Immun, 1999, 67(10): 5060-5068. (  0) 0) |
| [7] |
AMMENDOLA S, PASQUALI P, PISTOIA C, et al. High-affinity Zn2+ uptake system ZnuABC is required for bacterial zinc homeostasis in intracellular environments and contributes to the virulence of Salmonella enteric[J]. Infect Immun, 2007, 75(12): 5867-5876. DOI:10.1128/IAI.00559-07 (  0) 0) |
| [8] |
潘文, 王佳莹, 赵明秋, 等. 布鲁氏菌bp26基因缺失株的构建[J]. 中国兽医科学, 2011, 41(3): 280-286. (  0) 0) |
| [9] |
常艳, 王佳莹, 吴云燕, 等. 布鲁菌bp26基因的表达与bp26-间接ELISA抗体检测试剂盒的研制[J]. 中国畜牧兽医, 2013, 40(11): 21-25. DOI:10.3969/j.issn.1671-7236.2013.11.005 (  0) 0) |
| [10] |
FINLAY B, FALKOW S. Common themes in microbial pathogenicity revisited[J]. Microbiol Mol Biol Rev, 1997, 61(2): 136-169. (  0) 0) |
| [11] |
COMERCI D J, MARTINEZ-LORENZO M J, SIEIRA R., et al. Essential role of the VirB machinery in the matura tion of the Brucella abortus-containing cacuole[J]. Cell Microbiol, 2001, 3(3): 159-168. DOI:10.1046/j.1462-5822.2001.00102.x (  0) 0) |
| [12] |
WATARAI M, MAKINO S I, SHIRAHATA T. An essential virulence protein of, VirB4, requires an intact nucleoside-triphosphate-binding domain[J]. Microbiology, Brucella abortus2002, 184(5): 1439-1446. (  0) 0) |
| [13] |
GARMORY H S, TITBALL R W. ATP-binding cassette transporters are targets for the development of antibacterial vaccines and therapies[J]. Infect Immun, 2004, 72(12): 6757-6763. DOI:10.1128/IAI.72.12.6757-6763.2004 (  0) 0) |
| [14] |
PATZER S I, HANTKE K. The zinc-responsive regulator Zur and its control of the znu gene cluster-encoding the ZnuABC zinc uptake system in Escherichia coli[J]. J Biol Chem, 2000, 275(24): 321-332. (  0) 0) |
| [15] |
KIM S, WATANABE K, SHIRAHATA T, et al. Zinc uptake system(znuA locus)of Brucella abortus is essential for intarcellar survival and virulence in mice[J]. J Vet Med Sci, 2004, 66(9): 1059-1063. DOI:10.1292/jvms.66.1059 (  0) 0) |
| [16] |
YANG X, BECKER T, WALTERS N, et al. Deletion of znuA virulence factor attenuates Brucella abortus and confers protection against wile-type challenge[J]. Infect Immun, 2006, 74(7): 3874-3879. (  0) 0) |
| [17] |
YANG X H, THOMBURG T, WALTERS N, et al. ΔznuAΔpurE Brucella abortus 2308 mutant as a live vaccine candidate[J]. Vaccine, 2010, 28(4): 1069-1074. DOI:10.1016/j.vaccine.2009.10.113 (  0) 0) |
| [18] |
KIM S, WATARAI M, KONDO Y, et al. Isolation and characterization of mini-Tn5Km2 insertion mutants of Brucella abortus deficient in internalization and intracellular growth in HeLa cells[J]. Infect Immun, 2003, 71(6): 3020-3027. DOI:10.1128/IAI.71.6.3020-3027.2003 (  0) 0) |
| [19] |
SUK K, KENTA W, TOSHIKAZU S, et al. Zinc uptake system(znuA locus)of Brucella abortus is essential for intracellar survival and virulence in mice[J]. J Vet Med Sci, 2004, 66(9): 1059-1064. DOI:10.1292/jvms.66.1059 (  0) 0) |
| [20] |
GARRIDO M E, BOSCH M, MEDINA R, et al. The high affinity zinc-uptake system znuACB is under control of the iron-uptake regulator(fur)gene in the animal pathogen Pasteurella multocida[J]. FEMS Microbiol Let, 2003, 221(1): 1092-1097. (  0) 0) |
| [21] |
CAMPOY S, JARA M, BUSQUETS N, et al. Role of the high-affinity zinc uptake znuACB system in Salmonella enteric serovar typhimurium virulence[J]. Infect Immun, 2002, 70(8): 4721-4725. DOI:10.1128/IAI.70.8.4721-4725.2002 (  0) 0) |
| [22] |
YANG X, BECKER T, WALTERS N, et al. Deletion of znuA virulence factor attenuates Brucella abortus and con fers protection against wile-type challenge[J]. Infect Immun, 2006, 74(7): 3874-3879. DOI:10.1128/IAI.01957-05 (  0) 0) |
| [23] |
胡森. 马耳他布鲁氏菌M5-90 bp26基因缺失疫苗株的构建及安全性和免疫原性评估[D]. 哈尔滨: 东北农业大学, 2009.
(  0) 0) |
| [24] |
陈瑞花, 张辉, 唐利燕, 等. 布鲁氏菌外膜蛋白BP26细胞毒性作用的研究[J]. 中国农业科学, 2012, 45(16): 2406-3413. (  0) 0) |
| [25] |
李先富, 潘秀珍, 韩明月, 等. 2型猪链球菌锌转运蛋白A对小鼠免疫保护作用[J]. 中国公共卫生, 2012, 28(1): 42-44. (  0) 0) |
 2015, Vol. 36
2015, Vol. 36