2. 华南农业大学 热带亚热带生态研究所,广东 广州 510642
2. Institute of Tropical and Subtropical Ecology, South China Agricultural University, Guangzhou 510642, China
盐度是影响贝类分布和生理代谢最重要的生态因子之一.不同贝类在不同地理环境中分布,说明其可耐受盐度范围不同[1-2].贝类可以通过调节体内血淋巴渗透压来适应外界盐度改变,例如台湾鲍鱼Haliotis diversicolor supertexta和牡蛎Thais haenusstoma血淋巴中Na+、Cl-、K+浓度能够随着外界环境盐度增加而增加[2-3].盐度改变还将打乱贝类体内的渗透平衡,为了建立新的离子平衡,它们必须消耗大量能量[4],也需要启动Na泵和Cl泵等其他离子通道以及K+转移通道来共同协助[5].此外,贝类细胞内大量自由氨基酸也在渗透调节过程中扮演重要角色[6],甚至一些蛋白酶和RNA的合成在贝类盐度适应过程初期有显著变化,而在后期活力则趋于正常[5].
福寿螺Pomacea canaliculata又称大瓶螺或苹果螺,原产自亚马逊流域[7-8].作为入侵生物,其已被我国环保总局公布为首批入侵我国的16种“危害最大的外来物种”之一[7].福寿螺也是卷棘口吸虫Echinostoma revolutum、广州管圆线虫Angiostrongylus cantonensis的中间宿主,误食常引起人类群体发病事件[9].如何防治福寿螺入侵,控制其数量,减少其对农业和生态系统以及人类健康造成的危害,是科研工作者关注的热点.本研究进行了2种壳色福寿螺的急性毒性及耐盐度试验,为预测和控制福寿螺扩散提供理论依据与实践参考.
1 材料与方法 1.1 材料福寿螺(壳高20 ~ 25 mm)于2014年5月采自四川省雅安市大兴镇藕田(29 °59′N,103 °04′E),采回后区分黄壳和黑壳福寿螺暂养于实验室水族箱中,备用.
水花生Alternanthera philoxeroides和浮萍Lemna minor作为饲养材料.试验咸水用市售海水晶与曝气去氯自来水按比例配制而成,以轩泰仪手持盐度计(型号XTY5102131)进行不同盐度人工咸水配制.
1.2 方法 1.2.1 急性盐度试验试验按照周永欣等[10]编的《水生生物毒性试验方法》进行.试验共设计5个NaCl质量浓度梯度(0、5、10、15、20 g·L-1).试验在20 L的白色塑料盆中进行.配制人工咸水10 L.试验分黑壳福寿螺和黄壳福寿螺2种壳色进行.统一配置好咸水后,每个试验组随机放入25只福寿螺.每盐度每种壳色福寿螺设置3个平行组.
1.2.2 行为观察试验开始后观察福寿螺不同盐度下行为表现:逃逸数量及频率、厣开闭程度、触须反应、呼吸管和腹足伸出状况等.高盐度的试验组中,通过定时捞出厣紧闭的个体,在清水中复苏,10 min内无反应,且用镊子轻拉厣,仍不打开者,视为死亡.为了便于观察试验对象行为表现,试验期间未用网套住福寿螺.盆子四周用网防逃,记录完数据后将逃逸个体轻轻推入咸水中,死亡个体及时挑出.
暂养期间定时投喂水花生,试验前1 d停止投喂,试验期间不予投喂.试验期间不换水.随时将爬至盆壁的试验螺拨回盐水中.试验期间水温26 ~ 28 ℃,溶解氧>4 mg·L-1,pH = 8,氨态氮<0.2 mg·L-1,亚硝酸盐<0.05 mg·L-1.试验共进行96 h.
1.2.3 低盐度生长试验另配制ρ(NaCl)为0、5、10 g·L-13个梯度盐度.每个盐度梯度将2种壳色福寿螺分开进行试验,设3个重复,每个重复试验组随机放入20只螺进行1个月连续养殖.黄壳福寿螺体质量(1.310 ± 0.112)g,壳高(16.474 ± 0.990)mm;黑壳福寿螺体质量(1.298 ± 0.075)g,壳高(16.688 ± 0.759)mm.
用塑料网防逃,以保证试验对象均没入咸水中.每天投喂浮萍,每5 d随机取5只试验螺测量体质量、壳高、壳宽,记录死亡率.
1.3 数据处理半致死盐浓度(50% Lethal concentration,LC50)依据不同时间点死亡率,利用半对数坐标,采用直线内插法求得.安全浓度(Safety concentration,SC)采用下列计算公式求得:
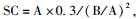
|
式中,A、B分别表示48、24 h的LC50.3个低盐度下试验螺生长数据采用SPSS16.0进行单因素(One-way ANOVA)差异显著性检验.
2 结果与分析 2.1 盐度胁迫下福寿螺的行为表现ρ(NaCl)为20和15 g·L-1(高盐度胁迫)时2种壳色福寿螺都呈现抑制状态,表现为厣壳紧闭,静卧盆底.20 g·L-1组试验螺均没有伸出腹足或触须,镊子轻触其厣无反应.ρ(NaCl)= 15 g·L-110 min后有极少数个体厣打开,伸出腹足、出现逃逸.此时,用玻璃棒轻触试验螺立即再次闭厣,并有进一步缩厣的趋势.少数个体因不断缩厣而在厣口产生微小气泡.此后几乎所有螺都处于厣紧闭的抑制状态,反应迟钝.盐度越高,闭厣程度较深,通常收缩至离厣口3 ~ 5 mm.
ρ(NaCl)=10 g·L-1(低盐度组)胁迫下,福寿螺反应稍灵敏.试验开始后,70%个体即伸出腹足爬离盐水,出现逃逸现象.未逃逸者呈现厣关闭状态,6 ~12 h后少有逃逸者,大部分静卧于盆底,少数个体可完全或者微微伸出腹足栖于水底.24 h后,多数螺厣打开(>50%),但反应迟缓,伸出触须,向下榻,左右扰动慢,腹足缓慢扭动,镊子轻触其腹足时,厣关闭较迟钝.小部分个体(15%)完全伸展腹足,在水底自由爬动.
ρ(NaCl)= 5 g·L-1的试验组中,2种壳色福寿螺与对照组表现相同,反应灵敏,活动自如.
各盐度胁迫组,试验螺螺壳表面均有或多或少的粘液分泌.
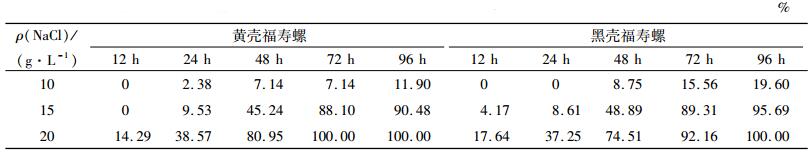
2.2 盐度胁迫下福寿螺的死亡率2种壳色福寿螺死亡率随盐度上升而升高.具体各盐度胁迫下不同时间点死亡率见表 1.对照组和ρ(NaCl)= 5 g·L-1组无个体死亡.
|
|
表 1 不同盐度胁迫下黑壳和黄壳福寿螺的死亡率 Table 1 The mortality rates of black and yellow golden apple snails under different salt stress |
从表 1可以看出,高盐度胁迫下,福寿螺开始死亡时间明显较低盐度组早,24 h死亡率即达到1 /3(黑壳福寿螺37.25%);死亡高峰出现在48 h,72 h接近全死(黑92.16%,黄100.00%),96 h全部死亡.ρ(NaCl)=15 g·L-1胁迫组,48 h后2壳色福寿螺死亡率接近50%.ρ(NaCl)= 10 g·L-1胁迫组,96 h后2壳色螺死亡率都不高,黄螺为11.90%,黑螺为19.60%.
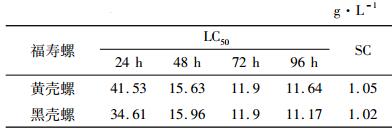
2.3 半致死盐浓度及安全盐浓度黄壳福寿螺48 h死亡率(y)与盐度(x)回归方程为:y = 4.143x -14.762(R2 = 0.842),48 h LC50 = 15.63 g·L-1;黑壳福寿螺48h死亡率与盐度回归方程为:y = 3.958x -13.152(R2 = 0.866),48 h的LC50 = 15.96 g·L-1.24 ~ 96 h 2种壳色福寿螺的半致死盐度见表 2.从表 2可以看出,2种壳色福寿螺安全盐度均较低.
|
|
表 2 黑壳和黄壳福寿螺半致死盐浓度及盐安全浓度 Table 2 The 50% lethal concentrations and safety concentrations of golden apple snails |
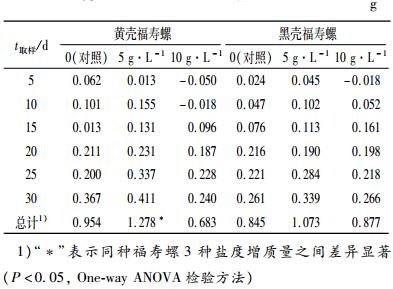
经过1个月的驯养试验,ρ(NaCl)= 0、5、10 g·L-1下黄壳福寿螺绝对增质量(表 3)为0.954、1.278和0.683 g,黑壳福寿螺绝对增质量则为0.845、1.073和0.877 g.两者均在ρ(NaCl)= 5 g·L-1人工咸水中生长最好.统计分析表明,仅黄壳福寿螺在ρ(NaCl)= 5 g·L-1的试验组中与其他2组盐度的增质量有显著差异.另外,2种壳色福寿螺在高盐度试验组中,还出现了负增长情况(表 3).
|
|
表 3 低盐度下黑壳和黄壳福寿螺的绝对增质量 Table 3 The absolute growth mass of black and yellow golden apple snails under low salts stress |
2种壳色试验螺各组均有死亡,但总体呈现盐度越高,死亡率越高的规律.最高死亡率为ρ(NaCl)= 10 g·L-1组黑壳福寿螺,达到75.0%,ρ(NaCl)=5 g·L-1组的黑壳福寿螺死亡率为17.5%,对照(0)的死亡率为5.0%;ρ(NaCl)= 0、5、10 g·L-1的黄壳福寿螺的死亡率分别为7.5%、17.5%和68.5%.
3 讨论与结论 3.1 2种壳色福寿螺的耐盐性大多数无脊椎动物属于变渗型动物,它们借助于离子调节和细胞内游离氨基酸库的启动或关闭[6],或消耗大量能量来建立新的渗透平衡.对于外界环境中盐度的极端变化(抵制水平)和中等程度变化(耐受水平),软体动物有2个相对独立的适应系统[5].前者主要是靠关闭外套腔来抵制体内外水盐交换,也可以钻入泥土中躲避不适应的环境状况[5].后者则通过相应的细胞机制进行调节[3].在一定的盐度范围内无脊椎动物体内无机离子K+、Na+、Cl-浓度随环境而变化,从而调节渗透平衡[2-3, 5].
因此,推测福寿螺在低盐胁迫时可能通过改变血淋巴渗透压来适应周围盐度的改变.而福寿螺若遇短时间的高盐度胁迫,可以关闭厣壳,也可以通过移动来躲避不利环境.这与本试验中观察到的现象一致.
甚至,在盐度胁迫时有的贝类还可以收缩或者膨胀细胞,通过细胞吸收或失去水分来改变溶质的浓度引起体质量改变,达到调节渗透压的作用[11].本研究中,福寿螺在ρ(NaCl)= 10 g·L-1的人工咸水生长试验初期即表现出负增长,说明其可能也存在这种渗透调节机制.
3.2 福寿螺耐盐性提高贝类属于变渗型动物,它们具有一定的渗透调节能力,超过调节范围常造成其免疫力降低甚至死亡.有研究表明高盐胁迫时近江牡蛎Ostrea rivularis Gould免疫力明显下降[12],文蛤Meretrix meretrix Linnaeus在高盐度海水中,死亡率大增[13].但对于这些无脊椎动物,若经过一定时间的驯养,能够提高其耐盐性.沼虾Macrobrachium rosenbergii是近年来才迁徙到淡水中生活的种类,虽然其繁殖必须回到海水,但目前它们完全能够在淡水中成功生活[14].也有由淡水向半咸水进化的无脊椎动物,小龙虾Procambarus clarkii自20世纪70年代引入我国,急性盐度毒性研究表明其96 h的LC50为23.93 g·L-1,SC为6.23 g·L-1,能够成功在盐碱地区生活[15],入侵范围逐渐扩大.台湾鲍鱼只需要3 d就能够通过改变血淋巴渗透压和离子浓度来适应升高的盐度[3].这说明在耐受水平的盐度胁迫下(非极端水平)给予一定的时间,贝类能通过调节血淋巴渗透压来适应外界环境的改变.
此外,环境中无机离子对于贝类基质蛋白形成、钙结晶体的沉积至关重要[16].有研究表明环境中增加一定的盐度(低盐)能够促进澳大利亚淡水螺Physa acuta的生长和繁殖[17].连续1个月的养殖试验结果表明,福寿螺在ρ(NaCl)为5 g·L-1时,5 d的绝对增质量最大,分别是0.411和0.339 g;ρ(NaCl)= 5 g·L-1总增质量最大.说明一定盐度能够为福寿螺生长提供更为丰富的无机离子,促进其生长.因此,推测福寿螺经过低盐胁迫,其耐盐性可能提高.
3.3 福寿螺的盐度入侵风险温度和盐度是影响河口区生物分布最重要的生态因子[2].虽然目前尚无福寿螺耐盐机制的报道,但近年来随着气候的变迁和生境的改变,在江河入海口等无机质丰富的生境已发现福寿螺的分布[18].以珠江口为例,多年平均海水盐度范围为0.003 ~ 33.08 g·L-1,呈现枯水期>平水期>丰水期的变化特征,丰水期平均盐度ρ(NaCl)不足10 g·L-1[19].该值均小于2种壳色福寿螺48 h的LC50,枯水期和平水期盐度虽可超过LC50,但福寿螺攀爬能力强,在外界环境改变时能够攀爬逃逸躲避不利环境.因此,自然生境中,河口区半咸水对福寿螺的胁迫影响还将更小.
本研究证明福寿螺属于淡水软体动物的本质,同时也揭示福寿螺可耐受一定盐度,其具体耐盐机制还需要进一步研究.本研究结果可为防控福寿螺向半咸水生境入侵扩散提供早期防控依据.
| [1] |
蔡英亚, 张英, 魏若飞. 贝类学概论[M]. 上海: 上海科学技术出版社, 1995, 97-100.
(  0) 0) |
| [2] |
HILDRETH J E, WILLIAM B S. The effects of temperature and salinity on the osmotic composition of the southern oyster drill, Thais haemastoma[J]. Biol Bull, 1980, 159(1): 148-161. DOI:10.2307/1541015 (  0) 0) |
| [3] |
CHENG Winton, YEH Shinn-pyng, WANG Chenshu, et al. Osmotic and ionic changes in Taiwan abalone Haliotis diversicolor supertexta at different salinity levels[J]. Aquaculture, 2002, 203(3/4): 349-357. (  0) 0) |
| [4] |
GILLES R. Mechanism of osmoregulation in animals[M]. New York: Wiley Interscience Chichester, 1979, 667.
(  0) 0) |
| [5] |
BERGER V J, KHARAZOVA A D. Mechanisms of salinity adaptations in marine molluscs[J]. Hydrobiologia, 1997(121): 115-126. (  0) 0) |
| [6] |
BISHOP S H, GREENWALT D E, KAPPER M A, et al. Metabolic regulation of proline, glycine and alanine accumulation as intracellular osmolytes in ribbed mussel gill tissue[J]. J Exp Zool, 1994, 268(2): 151-161. DOI:10.1002/(ISSN)1097-010X (  0) 0) |
| [7] |
李小慧, 胡隐昌, 宋红梅, 等. 中国福寿螺的入侵现状及防治方法研究进展[J]. 中国农学通报, 2009, 25(14): 229-232. (  0) 0) |
| [8] |
CUETO J A, VEGA I A, CASTRO-VAZQUEZ A. Multicellular spheroid formation and evolutionary conserved behaviors of apple snail hemocytes in culture[J]. Fish Shellfish Immun, 2013, 34(2): 443-453. DOI:10.1016/j.fsi.2012.11.035 (  0) 0) |
| [9] |
曾清香, 孙志坚, 张波, 等. 中国南方不同品系福寿螺对广州管圆线虫易感性的研究[J]. 中国人兽共患病学报, 2011, 27(7): 625-628. DOI:10.3969/j.issn.1002-2694.2011.07.010 (  0) 0) |
| [10] |
周永欣, 章宗涉. 水生生物毒性试验方法[M]. 北京: 农业出版社, 1989.
(  0) 0) |
| [11] |
BURTON R F. Ionic regulation and water balance[M]∥ SALEUDDIN A S M, WILBUR K M. The mollusca physiology. New York: Institute of Physiology University of Glasgow, 1983: 291-352.
(  0) 0) |
| [12] |
时少坤, 王瑞旋, 王江勇, 等. 盐度胁迫对近江牡蛎几种免疫因子的影响[J]. 南方水产科学, 2013, 9(3): 26-30. DOI:10.3969/j.issn.2095-0780.2013.03.005 (  0) 0) |
| [13] |
曹伏君, 刘志刚, 罗正杰. 文蛤稚贝盐度适应性的研究[J]. 海洋通报, 2010, 29(2): 156-160. DOI:10.3969/j.issn.1001-6392.2010.02.006 (  0) 0) |
| [14] |
WILDER M N, IKUTA K, ATMOMARSONO M., et al. Changes in osmotic and ionic concentrations in the hemolymph of Macrobrachium rosenbergii exposed to varying salinities and correlation to ionic and crystalline composition of the cuticle[J]. Comp Biochem Phys A, 1998, 119(4): 941-950. DOI:10.1016/S1095-6433(98)00008-7 (  0) 0) |
| [15] |
李庭古. 盐度对克氏原螯虾的存活、生长、代谢及受精卵孵化的影响[D]. 青岛: 中国海洋大学, 2007.
(  0) 0) |
| [16] |
REN G, HU X, TANG J, et al. Characterization of cDNAs for calmodulin and calmodulin-like protein in the freshwater mussel Hyriopsis curningii:Differential expression in respond to environmental Ca2+ and calcium binding of recombinant proteins[J]. Comp Biochem Phys B, 2013, 165(3): 165-171. DOI:10.1016/j.cbpb.2013.04.003 (  0) 0) |
| [17] |
KEFFORD B J, NUGEGODA D. No evidence for a critical salinity threshold for growth and reproduction in the freshwater snail Physa acuta[J]. Environ Pollut, 2005, 134(3): 377-383. DOI:10.1016/j.envpol.2004.09.018 (  0) 0) |
| [18] |
KWONG K L, WONG P K, LAU S S S, et al. Determinants of the distribution of apple snails in Hong Kong two decades after their initial invasion[J]. Malacologia, 2008, 50(1): 293-302. DOI:10.4002/0076-2997-50.1.293 (  0) 0) |
| [19] |
贾后磊, 谢健, 吴桑云, 等. 近年来珠江口盐度时空变化特征[J]. 海洋湖沼通报, 2011(2): 142-146. DOI:10.3969/j.issn.1003-6482.2011.02.020 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36