2. 桂林医学院 生物技术学院, 广西 桂林 541004;
3. 广西大学 生命科学与技术学院, 广西 南宁 530004;
4. 亚热带农业生物资源保护与利用国家重点实验室, 广西 南宁 530004
2. College of Biotechnology, Guilin Medical University, Guilin 541004, China;
3. College of Life Science and Technology, Guangxi University, Nanning 530004, China;
4. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning 530004, China
玉米Zea mays L.是我国第一大粮食作物、主要饲料作物和重要工业原料.高油玉米是20世纪人工创造的玉米新类型, 其营养品质和经济价值居禾谷类作物之首[1].开发探索高油玉米的遗传育种, 尤其是寻找、选育高油玉米新型种质是未来培育特种玉米的重要方向, 也将在调整国内农业种植结构中起着重要作用[2].微胚乳超高油玉米是吴子恺[3]选育出的一种新型超高油玉米, 其特性是玉米种子成熟时籽粒油脂含量超过20%, 胚/种子干质量比≥ 40%, 能够直接用来榨油.由于玉米籽粒的营养主要集中在胚上, 因此以大胚为显著特征的微胚乳超高油玉米除榨取玉米油之外, 进行深加工提取其他营养物质和开发出相应的功能性新型食品的市场前景极为广阔[4].三酰甘油(Triacylgycerol, TAG)是油料作物油脂的主要成分.二酰基甘油酰基转移酶(Diacylgycerol acyltransferase, DGAT)是催化三酰甘油合成最后一步反应的酶, 也是这一合成过程中唯一的关键酶和限速酶[5-11]. Zheng等[12]在高油玉米中定位了1个能够调节种子油分含量和油酸含量的主效高油QTL (qHO6), 它所编码的基因是乙酰辅酶A: DGAT1-2基因编码蛋白是决定玉米种子油脂含量的关键酶.本研究采用花粉管通道法将DGAT1-2基因导入超高油玉米自交系, 探讨DGAT1-2基因在超高油玉米中的超量表达对玉米种子油脂含量的影响, 为进一步提高超高油玉米的含油率寻找新途径.
1 材料与方法 1.1 材料超高油玉米自交系、大肠埃希菌Escherichia coli菌株DH5α等相关菌株、植物表达载体pBI121D等相关质粒由亚热带农业生物资源保护与利用国家重点实验室(广西大学)提供.植物表达载体pBI121D含DGAT1-2目的基因, 带有花椰菜花叶病毒35S启动子(CaMV 35S Promoter)、胭脂碱启动子(NOS-Promoter)、胭脂碱终止子(NOS-Terminator)、选择标记卡那霉素抗性基因NPT Ⅱ (Kan)、β-葡糖醛酸酶报告基因(β-glucuronidase, GUS).载体图谱见图 1.
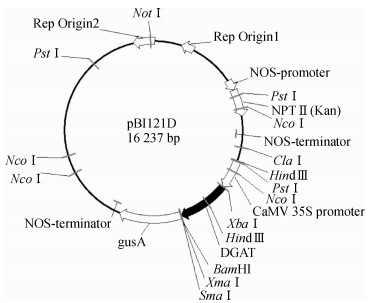
|
图 1 pBI121D植物表达载体图谱 Figure 1 The map of plant expression vector pBI121D |
挑取适量含pBI121D的DH5α单菌落于含卡那霉素(Kan) 10 mL的LB培养基中, 37℃、200 r·min-1震荡培养过夜至D600 nm=0.5;取过夜培养液5 mL接种于含Kan 500 mL的LB培养基的1 L锥形瓶中, 37℃、200 r·min-1震荡培养培养12~16 h; 将500 mL菌液分次倒入50 mL离心管中, 4℃、13 000 r·min-1离心5 min, 收集菌体; 将菌体均匀悬浮于10 mL提取液Ⅰ; 倒入20 mL提取液Ⅱ, 充分混和均匀后室温放置5~ 10 min; 加入15 mL预冷的提取液Ⅲ, 充分混匀后冰上放置10 min; 4℃、13 000 r·min-1离心20 min, 把上清液转移至另一个50 mL离心管中; 倒入等体积异丙醇, 混和均匀, 室温下放置30 min; 4℃、13 000 r·min-1离心10 min, 弃去上清液, φ为70%的乙醇溶液洗DNA沉淀2~3次, 室温倒置干燥, 然后溶于适当体积1 × TE.用ND-1000分光光度计测定质粒的浓度, 以1 × SSC溶液配制成质量浓度为500 μg·mL-1的pBI121D质粒溶液, 置于-20℃保存备用.
1.2.2 花粉管通道法转化超高油玉米在开花期选取套袋自交授粉后22、24、26 h且抽丝期一致的超高油玉米自交系雌穗, 取下雌穗的纸袋后, 剪去距穗顶部1 cm以上的苞叶和花丝, 用移液枪将pBI121D质粒溶液(500 μg·mL-1)滴在切口处, 然后再套上纸袋, 挂好标记牌.每穗滴注量均在1 mL, 2 h后重复滴注1次, 共2次, 同时滴注不含pBI121D质粒的1 × SSC溶液作对照.
1.2.3 改良CTAB法提取玉米DNA于5~6叶期剪取叶片, 每株约300 mg于2 mL EP管, 液氮浸泡后振荡粉碎, 加入750 μL 65℃预热的CTAB抽提缓冲液, 再加入30 μL φ为10%的PVP液, 最后于通风橱下加入10 μL的β-巯基乙醇, 颠倒混匀; 60~65℃恒温水浴保温1 h, 每隔10 min左右摇匀1次; 水浴后, 取出离心管, 冷却至室温; 通风橱下加入800 μL的苯酚+氯仿+异戊醇混和液(体积比25:24:1), 轻轻颠倒摇动约10 min; 12 000 r·min-1离心10 min, 将650 μL上清液转至1.5 mL的灭菌离心管中; 通风橱下加入650 μL的氯仿+异戊醇混合液(体积比24:1), 轻轻颠倒摇动约10 min; 12 000 r·min-1离心5 min, 将500 μL上清液转至1.5 mL离心管中; 加入0.6~0.8倍体积的异丙醇, 颠倒摇匀, 常温放置30 min; 12 000 r·min-1离心10 min, 取出离心管可见管底有白色沉淀出现, 弃上清液; 加900 μL预冷(-20 ℃)无水乙醇, 轻轻混匀, 置-20℃冰箱1 h; 12 000 r·min-1离心10 min, 弃上清液; 加φ为70%的乙醇溶液漂洗1次, 弃上清液; DNA沉淀干燥后, 加入200 μL 1 × TE(pH 8.0, 含RNA酶), 置于-20℃保存备用.
1.2.4 PCR检测由于DGAT1-2基因来源于玉米, 所以转基因验证利用标记抗性基因NPT Ⅱ (Kan)设计引物和探针.根据NPT Ⅱ的基因序列设计PCR引物S1-F/S1-R (5'atgagccatattcaacggga3'/5'ttagaaaaactcatcgagca3')和S2-F/S2-R (5'atgctacgttcaagcatgtaatggtgg3'/5'taaaactgcctggcacagcaattgc3'), PCR反应体系为:总体积20 μL, 其中φ为50%甘油2 μL, 10 × Buffer 2 μL、dNTP 1 μL, 引物S2-F/S2-R各0.5 μL、Taq酶0.5 μL、DNA模板2 μL, 加ddH2O至20 μL.反应条件95℃ 15 min, 95℃ 30 s、65℃ 30 s、72℃ 50 s扩增30个循环, 最后72℃延伸5 min PCR扩增.取10 μL PCR扩增产物在12 g·L-1琼脂糖凝胶上进行电泳分离, 于凝胶成像系统观察和拍照.
1.2.5 Southern杂交检测利用上述选择标记抗性基因NPT Ⅱ的引物S2-F/S2-R制备探针, 依照高效DNA地高辛标记和检测试剂盒Ⅱ (DIG High Prime DNA Labeling and Detection Starter Kit Ⅱ试剂盒, 购自Roche)的操作方法制备探针, 检测探针标记效率. Southern杂交操作步骤改良自Ausubel等[13]描述的方法:用Xba Ⅰ/Hind Ⅲ双酶切PCR检测呈阳性的转基因超高油玉米总DNA, 37℃恒温, 16 h; 加入NaAc (pH 5.2)和无水乙醇, 混匀, -80℃放置1 h, 离心后, 洗沉淀2次, 沉淀干燥后, 用适量ddH2O溶解DNA沉淀; 用10 g·L-1的琼脂糖凝胶电泳, 60 V电压6 h; 电泳后的凝胶经脱嘌呤溶液、变性液和中和液处理过后, 搭纸桥转移DNA到尼龙膜上8 h; 将转移后的尼龙膜用紫外交联仪交联[强度值:1 200(即120 000 microjoules·cm-2); 时间:3 min]后, 预杂交, 42℃ 30 min; 加入68℃变性15 min的含探针杂交溶液杂交, 42℃ 8 h; 在杂交炉中, 杂交后的尼龙膜经洗膜液Ⅰ、洗膜液Ⅱ和洗膜液Ⅲ漂洗过后, 进行免疫检测; 然后往放在保鲜膜上的尼龙膜加CSPD封口, 37℃恒温10 min; 暗室压X射线30 min, 经显影和定影后, 晾干X射线照片, 观察杂交效果, 相机照相并记录.
2 结果与分析 2.1 花粉管转化及转化植株的筛选开花期利用花粉管通道法转化超高油玉米自交系雌穗300苞, 玉米籽粒成熟时收获216苞玉米, 共获得11 352颗T1代超高油玉米籽粒.次年盆载种植T1代, 于5~6叶期采用改良CTAB法快速小量大规模提取基因组DNA, 进行PCR检测, 同时以非转基因超高油玉米总DNA、清水为负对照, 以pBI121D质粒DNA为正对照, 部分转化植株PCR检测结果见图 2和图 3.形态不正常的变异类型T1代植株均淘汰掉, 初步筛选获得形态正常的PCR呈阳性的假定转化T1代植株163株.
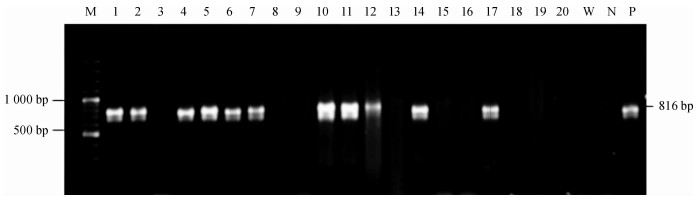
|
图 2 利用引物S1-F/S1-R PCR验证部分转化植株 Figure 2 PCR verification of some transgenic plants by primer S1-F/S1-R M:100 bp DNA分子质量标记; 1~20:转化植株总DNA为模板PCR产物; W:以水为模板PCR产物; N:以非转基因材料的超高油玉米总DNA为模板PCR产物; P:以pBI121D质粒DNA为模板PCR产物. |
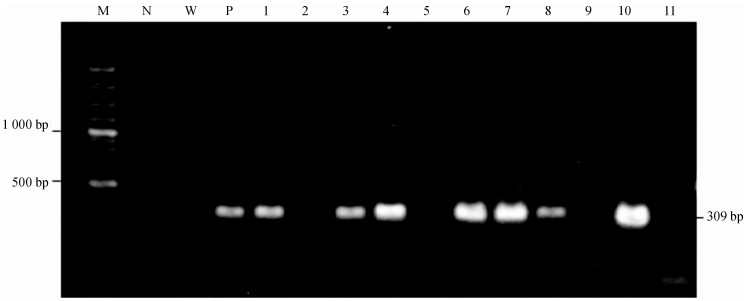
|
图 3 利用引物S2-F/S2-R PCR验证部分转化植株 Figure 3 PCR verification of some transgenic plants by primer S2-F/S2-R M:100 bp DNA分子质量标记; 1~11:转化植株总DNA为模板PCR产物; W:以水为模板PCR产物; N:以非转基因材料的超高油玉米总DNA为模板PCR产物; P:以pBI121D质粒DNA为模板PCR产物. |
提取PCR验证呈阳性的163棵转化植株的总DNA, 经Xba Ⅰ/Hind Ⅲ双酶切, 用Kan引物S2-F/ S2-R制备探针, 进一步进行Southern杂交鉴定.图 4呈现的是部分PCR呈阳性植株的Southern杂交鉴定结果(1~5号植株来至同一转化事件).结果(图 4)显示, 在检测的163株抗性植株中有29株呈阳性, 含有特异杂交条带, 且基本是单拷贝插入, 揭示在这29株转基因植株中, DGAT1-2基因已整合到受体基因组中.

|
图 4 Southern杂交鉴定部分PCR呈阳性植株 Figure 4 Southern blotting verification of partial positive transgenic plants by PCR W:水; P:正对照pBI121D; N:非转基因植株; 1~5:PCR呈阳性植株. |
29株转基因超高油玉米植株与对照非转基因植株性状无明显差异.所收获的341颗自交授粉的10苞转基因超高油玉米T2代籽粒和306颗自交授粉的5苞对照籽粒均用MQ-20型核磁共振仪(德国Bruker公司)直接测定油脂含量.将全部转基因植株与非转基因植株平均含油率进行t检验分析, 结果表明, 转基因植株平均含油率(w)为25.027 7% ± 0.200 1%, 非转基因植株平均含油率18.839 7% ± 0.887 8%.由于是盆栽种植, 没能施放足够肥料, 而且楼顶大棚种植温度过高, 自交授粉后1个月植株就已枯萎, 对照植株平均含油率显著低于其品种在大田种植的平均含油率(27%, P < 0.01), 转基因植株平均含油率比非转基因植株平均含油率显著提高了6.19% (P < 0.01).
3 讨论自1983年Zhou等[14]将目的基因通过花粉管通道法转入棉花以来, 对于该方法全球开展了许多研究工作.利用花粉管通道法, 当代就可以获得转基因种子, 然后对转基因后代进行筛选, 从而得到带有目的基因片段的转基因植株[15].花粉管通道法不用建成分化再生、原生质体培养及愈伤组织诱导等组织培养体系, 也不受基因型的制约, 能够选择任意品种作为受体导入目的基因.这项技术操作起来简单快捷, 容易掌握; 所用成本低廉, 无需太多的仪器设备, 经济实用, 易于操作大规模基因转化.花粉管通道法的缺点是受授粉时间限制, 大片段的外源DNA很难转化, 并且转基因后代会产生很多变异类型[16].本研究按10 d种植1批玉米共种植了3批, 错开玉米的开花时间, 延长了授粉时间1个月.然后采用花粉管通道法将DGAT1-2基因导入超高油玉米自交系, 经PCR验证及Southern杂交鉴定, DGAT1-2基因已整合到受体基因组中.统计分析证明转基因超高油玉米T2种子平均含油率比非转基因植株平均含油率得到极显著提高.说明应用这种方法可以有效地进行超高油玉米DGAT1-2基因的遗传转化并能使DGAT1-2基因成功超量表达, 是一种切实有效提高玉米含油率的新途径.
花粉管通道法所具有的种种优势众所周知, 在玉米自交系转基因育种中得到了越来越普遍的应用[17-20], 制约其应用的瓶颈是其转化效率低.花粉管通道法一般转化率为1.0%~10.0%[16], 本研究花粉管通道法转化率较低, 仅为1.44%.花粉管通道法转化率可能与外源DNA片段的长短、纯度、浓度、导入时间、玉米的基因型和导入时的天气情况有关.要提高花粉管通道法的转化率, 有待于今后更深入地研究.除此之外, 花粉管通道在玉米授粉后形成的生理机制、最佳转化外源DNA的时间以及可能产生的转基因后代变异等, 还没有得到完全解决, 这些问题在一定程度上限制了花粉管通道法的发展.未来, 可以进一步结合分子育种技术的理论和应用研究, 充分发挥花粉管通道法简单便捷快速实用的优势, 使玉米育种水平进一步提高.
本研究采用PCR进行转化植株的筛选, 没有采用卡那霉素筛选.因为超高油玉米籽粒表皮皱缩不易彻底灭菌, 组培法容易长菌发霉.盆栽法卡那霉素质量浓度1 500 mg·L-1时才达到70%左右的白化率.由于超高油玉米对卡那霉素的抗性较大, 因此可以考虑用其他抗生素对其转化种子进行筛选.采用PCR检测转化植株, 虽然较为繁琐, 增加许多工作量, 但结合改良CTAB法快速小量大规模提取超高油玉米基因组DNA, 大大提高了超高油玉米大规模群体基因型筛选和研究的工作效率, 能在苗期及时筛选出阳性转化植株, 不影响后期试验工作.
本研究检测的自交授粉的转基因超高油玉米T2代籽粒平均含油率比对照非转基因植株平均含油率提高6.19%, 差异极显著.尽管T2籽粒是分离的, 所获结果至少3/4来源于转基因玉米, 说明转DGAT基因能够显著提高玉米籽粒含油率, 是一种切实有效提高玉米含油量的新途径.关于转DGAT基因对于玉米含油量的提高程度, 还需进一步检测后代纯合系的玉米籽粒含油率.
致谢:感谢中国农业科学院生物技术研究所徐荣旗博士和广西大学生命科学与技术学院李有志博士对于论文的修改和指导!
| [1] |
戴忠民, 郑延海, 李华, 等. 高油玉米育种的研究进展[J]. 河南职业技术师范学院学报, 2004(3): 25-27. (  0) 0) |
| [2] |
林必博, 周济铭, 党占平, 等. 高油玉米品质研究进展[J]. 山西农业科学, 2014, 42(10): 1144-1147. DOI:10.3969/j.issn.1002-2481.2014.10.25 (  0) 0) |
| [3] |
吴子恺. 新型超高油玉米种质的选育[J]. 作物学报, 2004, 30(8): 739-744. DOI:10.3321/j.issn:0496-3490.2004.08.001 (  0) 0) |
| [4] |
戴罗杰, 郭春雨, 李飞宇, 等. 微胚乳超高油玉米的研究进展[J]. 安徽农业科学, 2009, 37(19): 8925-8927. DOI:10.3969/j.issn.0517-6611.2009.19.057 (  0) 0) |
| [5] |
CASES S, SMITH S J, ZHENG Yaowu, et al. Identification of a gene encoding an acyl CoA:Diacylglycerol acyltransferase, a key enzyme in triacylglycerol synthesis[J]. Proc Natl Acad Sci USA, 1998, 95(22): 13018-13023. DOI:10.1073/pnas.95.22.13018 (  0) 0) |
| [6] |
LARDIZABAL K D, MAI J T, WAGNER N W, et al. DGAT2 is a new diacylglycerol acyltransferase gene family:Purification, cloning and expression in insect cells of two polypeptides from Mortierella ramanniana with diacylglycerol acyltransferase activity[J]. J Biol Chem, 2001, 276(42): 38862-38869. DOI:10.1074/jbc.M106168200 (  0) 0) |
| [7] |
MEEGALLA R L, BILLHEIMER J T, CHENG Dong. Concerted elevation of acyl-coenzyme A:Diacylglycerol acyltransferase (DGAT) activity through independent stimulation of mRNA expression of DGAT1 and DGAT2 by carbohydrate and insulin[J]. Biochem Biophys Res Commun, 2002, 298(3): 317-323. DOI:10.1016/S0006-291X(02)02466-X (  0) 0) |
| [8] |
YU Yihao, GINSBERG H N. The role of acyl-CoA:Diacylglycerol acyltransferase (DGAT) in energy metabolism[J]. Ann Med, 2004, 36(4): 252-261. DOI:10.1080/07853890410028429 (  0) 0) |
| [9] |
唐桂英, 柳展基, 单雷, 等. 二酰基甘油酰基转移酶(DGAT)研究进展[J]. 中国油料作物学报, 2010, 32(2): 320-328. (  0) 0) |
| [10] |
刘凯, 江泽鹏, 叶航, 等. 油茶DGAT1基因植物表达载体的构建[J]. 林业科技开发, 2014(1): 92-94. (  0) 0) |
| [11] |
李书霞. 玉米和棉花DGAT基因家族的全基因组分析[D]. 杭州: 浙江大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10335-1015555359.htm
(  0) 0) |
| [12] |
ZHENG P, ALLEN W B, ROESLER K, et al. A phenylalanine in DGAT is a key determinant of oil content and composition in maize[J]. Nat Genet, 2008, 40(3): 367-373. DOI:10.1038/ng.85 (  0) 0) |
| [13] |
AUSUBEL F M, BRENT R, KINGSTON R E, et al. Short Protocols in Molecular Biology[M]. 5ed. New York: John Wiley and Sons, Inc., 2002, 32-37.
(  0) 0) |
| [14] |
ZHOU Guangyu, WENG Jian, ZENG Yishen, et al. Introduction of exogenous DNA into cotton embryos[J]. Meth Enzymol, 1983, 101: 433-481. DOI:10.1016/0076-6879(83)01032-0 (  0) 0) |
| [15] |
王秀芹, 刘希桂, 曲建平, 等. 农杆菌介导的玉米转基因研究进展[J]. 安徽农业科学, 2006, 34(18): 4546-4548. DOI:10.3969/j.issn.0517-6611.2006.18.023 (  0) 0) |
| [16] |
王关林, 方宏筠. 植物基因工程[M]. 2版. 北京: 科学出版社, 2002, 481-496.
(  0) 0) |
| [17] |
于海波, 张玲. 转基因玉米的研究进展[J]. 玉米科学, 2011, 19(5): 64-66. (  0) 0) |
| [18] |
董春水, 才卓. 现代玉米育种技术研究进展与前瞻[J]. 玉米科学, 2012, 20(1): 1-9. DOI:10.3969/j.issn.1005-0906.2012.01.001 (  0) 0) |
| [19] |
刘小丹, 李淑华, 徐国良, 等. 转基因玉米育种研究进展[J]. 玉米科学, 2012, 20(6): 1-8. DOI:10.3969/j.issn.1005-0906.2012.06.001 (  0) 0) |
| [20] |
任魁. 玉米育种技术研究进展探析[J]. 福建农业, 2014(10): 101. (  0) 0) |
 2015, Vol. 36
2015, Vol. 36


