2. 广西农业科学院 经济作物研究所, 广西 南宁 530004;
3. 广西作物遗传改良生物技术重点开放实验室, 广西 南宁 530007
2. Economic Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530004, China;
3. Guangxi Key Lab for Crop Genetic Improvement and Biotechnology, Nanning 530007, China
连作可使花生Arachis hypogaea产量与品质明显下降, 是导致花生减产的主要因素之一.作物产生连作障碍的主要原因包括土壤养分不平衡、化感作用、微生物群落失衡及土壤病原微生物数量增加等[1-3].作物的化感作用是指化感物质包括作物根系的分泌物以及地上茎叶淋溶、挥发释放的物质和作物本身腐解产生的物质, 对同种作物或其他作物的生长发育产生有利或不利影响.根系分泌物中的化感物质是导致作物产生连作障碍的主要因素之一, 目前已从棉花、大豆、花生、葡萄等作物[3-6]的根系分泌物中分离出化感物质.但关于花生化感物质种类的分离鉴定还较少, 花生野生种和栽培种的根系分泌物组分差异目前鲜见报道, 有关花生野生种研究主要集中在其抗病性、遗传差异和杂交利用上.本试验通过GC-MS技术分离鉴定花生野生种和栽培种根系分泌物, 并对花生根系分泌物和其中可能的化感物质进行了生物检测, 研究花生化感作用的机理, 为解决花生连作障碍提供理论依据.
1 材料与方法 1.1 材料供试花生种质共2个:花生属花生区组野生种Arachis correntina, 来自国家种质野生花生南宁分圃; 桂花22, 广西主栽花生品种之一, 由广西农业科学院经济作物研究所育成和提供.
1.2 方法 1.2.1 花生根系分泌物的收集试验于2013年11月在广西农业科学院作物遗传改良生物技术重点试验室进行.每个塑料桶盛4 L的Hoagland营养液, 上盖带孔泡沫板, 在泡沫板小孔中定植花生幼苗, 每桶定植25株. 15~30 d更换1次营养液, 共培养50 d.收集更换的营养液, 通过XAD24树脂吸附柱, 随后分别用乙醚、甲醇各200 mL洗脱, 收集洗脱液, 减压浓缩至干, 溶于10 mL丙酮(色谱纯)中, 置-20℃冰箱中备用.另以纯Hoagland营养液按上述相同方式处理, 作为对照, 检测杂质.
1.2.2 花生根系分泌物的GC-MS测定用丙酮(色谱纯)稀释所得的样品, 在Clarus 500GC-MS型气相色谱-质谱联用仪上进行化学成分分析.色谱条件:色谱柱为Stabilwax-DA 30 m × 0.32 mm × 0.25 μm石英毛细管柱, 起始温度为50℃, 保持2 min, 然后以8℃ ·min-1升温至230℃, 恒温5 min.载气为氦气, 纯度≥ 99.99%; EI离子源, 电子能量为70 eV.
1.2.3 花生幼苗生长试验生物测定参照李培栋等[3]的方法.取250 mL的三角烧瓶, 均装入100 mL的MS基本培养基, 分别加入各根系分泌物组分及1 × 10-5、1 × 10-4、1 × 10-3 mol·L-1苯甲醛、对乙基苯甲酸和阿魏酸, 同时取大小均一的健康花生种子, 无菌水浸泡5 h, 无菌操作将花生种子放在灭菌好的装有MS培养基的三角烧瓶中央, 每瓶种植2株花生, 每个处理6个重复, 25℃恒温光照培养箱培养, 20 d后取出, 测量花生幼苗的株高、根长、地上部及地下部的干物质量及叶片过氧化物酶(POD)、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量.干物质量测定方法:在105℃下杀青30 min, 之后在75 ℃烘干至恒质量, 自然冷却至室温, 分别测定其干物质量.根系分泌物生物测定, 分别设置1 mL根系分泌物组分+ 9 mL无菌水、5 mL根系分泌物组分+ 5 mL无菌水、10 mL根系分泌物组分共3个处理, 以10 mL的无菌水为对照(CK)进行花生幼苗生长试验.用无菌水配制浓度1 × 10-5、1 × 10-4、1 × 10-3 mol·L-1苯甲醛、对乙基苯甲酸和阿魏酸, 依次以A1、A2、A3, B1、B2、B3和C1、C2、C3表示, 以无菌水为对照(CK)进行花生幼苗生长试验.花生幼苗叶片酶活性的测定:过氧化物酶(POD)测定采用愈创木酚比色法, 以每1 min内D470 nm值变化0.01为1个酶活性单位(U); 超氧化物歧化酶(SOD)测定采用氮蓝四唑法测定, 以抑制氮蓝四唑(NBT)光化还原的50%为1个酶活性单位(U).丙二醛(MDA)含量测定采用巴比妥酸比色法, 花生幼苗根系活力测定采用TTC法.
1.2.4 数据处理采用SPSS17.0软件对试验所得的数值进行统计分析.
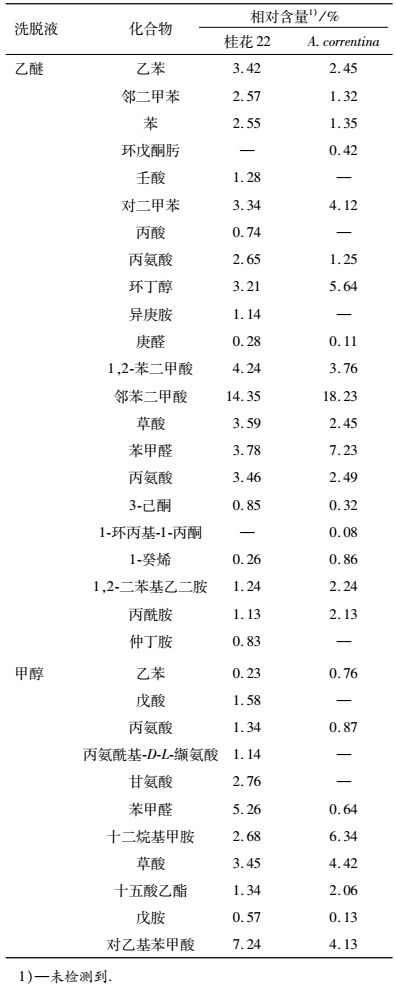
2 结果与分析 2.1 花生根系分泌物GC-MS测定结果花生根分泌物GC-MS测定结果见表 1.由表 1可看出:花生根分泌物分离鉴定出24种主要成分, 包括有机酸类、醇类、酯类、酮类、醛类、苯类、烃类、胺类、酰胺类等有机化合物, 另外还有一些烷烃类化合物和苯酚未列出.其中的水溶性有机酸、苯甲酸的衍生物、醇、酮、苯等低分子有机化合物是常见报道的根系分泌物[7].乙醚组分分离出的物质较多, 从A. correntina和桂花22根系分泌物中共分离出22种有机化合物, 2个花生品种共有的根系分泌物质有16种, 不同的组分有6种, 其中在A. correntina根系分泌物质中分离出环戊酮肟和1-环丙基-1-丙酮, 在桂花22根系分泌物质中分离出壬酸、丙酸、异庚胺、仲丁胺.甲醇有11种, 2个花生品种共有的根系分泌物质有8种, 不同的组分有3种, 分别为:戊酸、丙氨酰基-D-L-缬氨酸和甘氨酸, 这3种物质均于桂花22根系分泌物质中分离得出. 2个花生品种的根系分泌物含量较大的主要有:邻苯二甲酸、苯甲醛、草酸、对乙基苯甲酸、丙酰胺、丙氨酸、戊酸等.
|
|
表 1 花生根系分泌物GC-MS鉴定结果 Table 1 GC-MS identification results of peanut root exudates |
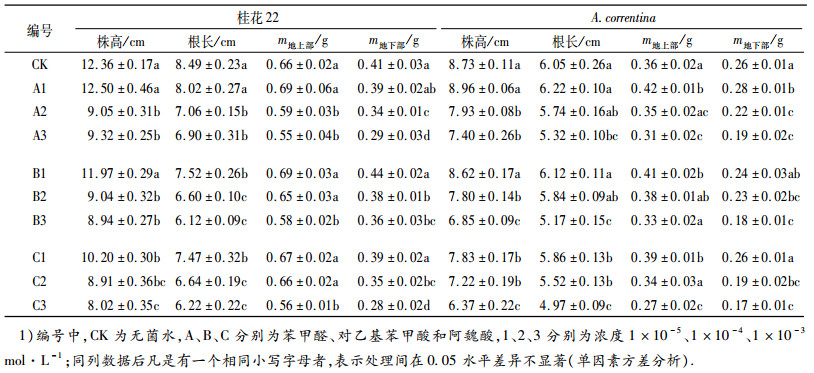
花生根分泌物对花生幼苗生物检测结果(表 2)表明, A. correntina和桂花22的根分泌物各组分对幼苗的生长均影响不大, 与对照相比未表现出显著抑制作用, 可能与分离出的物质浓度过低有关.考虑到苯甲醛及对乙基苯甲酸在2个花生品种根分泌物测定中的含量较高, 而且许多苯甲酸的衍生物被报道具有化感作用[8-9], 因此选取这2种物质进行生物检测, 另以最常见的化感物质阿魏酸作为比较.从表 2可以看出, 苯甲醛、对乙基苯甲酸、阿魏酸的低浓度处理(1 × 10-5 mol·L-1)对2个花生品种的株高、根长、地上部干质量和地下部干质量有促进作用或弱的抑制作用, 而其他2个浓度处理(1 × 10-3和1 × 10-4 mol·L-1)都存在不同程度的抑制作用.苯甲醛、对乙基苯甲酸、阿魏酸高浓度处理(1 × 10-3 mol·L-1)2个花生品种的株高、根长、地上部干质量和地下部干质量与对照相比差异均达到显著水平(P < 0.05).
|
|
表 2 苯甲醛、对乙基苯甲酸、阿魏酸对花生幼苗生长的影响1) Table 2 Effects of benzaldehyde, benzoic acid and ferulic acid on the growth of peanut seedlings |
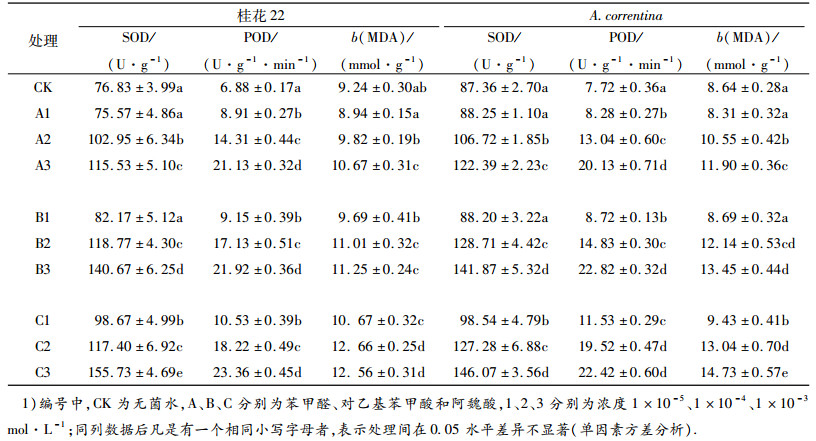
由表 3可以看出, 苯甲醛、对乙基苯甲酸、阿魏酸处理的桂花22和A. correntina幼苗叶片的SOD酶活性、POD酶活性和MDA含量与对照相比均有不同程度的增加, 说明花生幼苗受到了胁迫, 从而引发了抗氧化反应.与对照相比, 低浓度的苯甲醛处理(1 × 10-5mol·L-1)对A. correntina叶片的SOD酶活性、POD酶活性和MDA含量以及桂花22叶片的SOD酶活性和MDA含量增加幅度较小, 而1 × 10-4和1 × 10-3mol·L-1乙基苯甲酸、阿魏酸处理的2个花生品种叶片SOD酶活性、POD酶活性和MDA含量均表现出不同程度的上升趋势, 且高浓度处理(1 × 10-3 mol·L-1)与对照差异均达显著水平(P < 0.05).
|
|
表 3 苯甲醛、对乙基苯甲酸、阿魏酸对花生幼苗SOD酶、POD酶和MDA含量的影响 Table 3 Effects of benzaldehyde, benzoic acid and ferulic acid on SOD activity, POD activity and MDA content of peanut seedlings |
本试验从A. correntina和桂花22根系分泌物中共分离出24种有机化合物, 2个花生品种不同的根系分泌物质有9种, 其中在桂花22根系分泌物质中分离出的壬酸、丙酸、戊酸、丙氨酰基-D-L-缬氨酸、甘氨酸等有机酸, 均未在A. correntina中发现, 可能在A. correntina根系分泌物质中含量低而未能检测到或在花生苗期A. correntina根系未分泌出这些物质, 这些有机酸分泌物的差异是否对2个花生品种的化感作用差异有影响还需进一步研究.根系分泌物包含水溶性和脂溶性成分, 本研究仅检测了脂溶性化合物中乙醚和甲醇洗脱液的挥发性成分, 分离出的物质也较少, 还很不全面, 还需要结合HPLC-MS以及其他波谱学方法进行鉴定.本试验从花生根系分泌物中分离出苯甲醛和对乙基苯甲酸, 并确定其对花生幼苗存在化感作用, 这2种物质目前在有关花生化感作用的研究中鲜见报道.李培栋等[3]从花生连作土壤分离检测出化感物质对羟基苯甲酸、香草酸、香豆酸.刘苹等[10]从花生根系分泌物中分离出酚酸物质及脂肪酸类化合物, 但未确定这些物质对花生的化感作用.袁云云等[11]从土壤和沙培中获得的花生根系分泌物分离出十二酸、油酸和邻苯二甲酸等化感物质.在其他作物的根系分泌物或根际土壤中也分离鉴定出苯甲酸衍生物类、酚酸等化感物质.胡元森等[6]采用GC-MS技术从黄瓜水培液根分泌物中分离鉴定出的化感物质主要有苯甲酸、对羟基苯甲酸、香草酸、阿魏酸、苯丙酸等苯甲酸的衍生物.郭修武等[5]采用LC-MS法检测出葡萄根系分泌物中的化感物质含有对羟基苯甲酸和水杨酸.王芳[12]从茄子根系分泌物、残茬和重茬土壤中同时检测到邻苯甲酸的多种衍生物.柴强等[13]从鹰咀豆的根分泌物中分离出有机酸、酚、烃类、酯、酮类、醇、酰胺、苯、醛和噻唑等有机物质, 并对苯甲醛化感效应进行了研究.根系分泌物质可因收集方式、测定方法、作物种类等的不同而获得不同的测定结果.化感作用通常是由多种化感物质综合作用所导致, 本研究仅对花生根系分泌物中的苯甲醛及对乙基苯甲酸进行了鉴定, 对于低含量的物质及根系分泌物中其他未检测到的物质也可能存在化感作用, 而且这些物质间的协同化感作用还有待进一步研究.
作物幼苗生长的形态生理指标被广泛运用于化感作用的研究中, 可通过化感物质对作物幼苗生长发育的抑制程度研究其化感效应.本试验结果表明, 花生根系分泌物对花生幼苗生长的抑制作用不显著, 推测可能与花生根系分泌物的浓度过低有关.花生根系分泌物中的苯甲醛及对乙基苯甲酸对花生幼苗的生长均有一定程度的抑制作用, 且这种抑制作用与其处理浓度密切相关, 存在低浓度处理促进和高浓度处理抑制的现象; 阿魏酸随着处理浓度的增加, 表现出抑制程度越强.这与袁云云等[11]有关花生根系分泌物十二酸的研究结果一致, 也与前人在茄子[14-15]、大蒜[16]、黄瓜[17]、番茄[18]、油菜[19]等其他作物化感物质的研究结果相似.
作物自身的保护酶SOD和POD可减轻活性氧对作物的伤害, 保护作物细胞膜结构, 抵抗逆境胁迫的为害.有研究表明化感物质对植株细胞的保护酶系统有损害作用, 导致机体内活性氧动态失衡, 破坏细胞膜的稳定结构[20-22].本试验结果表明, 与对照相比, 3种化感物质苯甲醛、对乙基苯甲酸及阿魏酸不同浓度处理均增加了SOD和POD活力及MDA含量, 且都随着处理浓度的增加而增加, 说明这3种化感物质激发了花生保护酶SOD和POD的活性, 有利于减轻花生受到的逆境为害.这与酚酸对花生影响的研究结果相似[3].本试验仅研究了化感物质对花生保护酶系统的影响, 还需要对水分及矿质元素的吸收代谢、光合作用等其他生理生态指标进行综合全面的研究, 以进一步明确其作用机理.
综上所述, GC-MS鉴定花生根系分泌物中的主要物质有邻苯二甲酸、苯甲醛、草酸、对乙基苯甲酸、丙酰胺、丙氨酸、戊酸等.花生根系分泌物中的苯甲醛和对乙基苯甲酸对花生幼苗的生长有抑制作用, 抑制程度随着花生根系分泌物浓度的增加而加大.花生根系分泌物质的化感作用可能是导致花生发生连作障碍的原因之一.
| [1] |
王兴祥, 张桃林, 戴传超. 连作花生土壤障碍原因及消除技术研究进展[J]. 土壤, 2010, 42(4): 505-512. (  0) 0) |
| [2] |
王小兵, 骆永明, 李振高, 等. 长期定位施肥对红壤地区连作花生生物学性状和土传病害发生率的影响[J]. 土壤学报, 2011, 48: 725-730. DOI:10.11766/trxb200910100444 (  0) 0) |
| [3] |
李培栋, 王兴祥, 李奕林, 等. 连作花生土壤中酚酸类物质的检测及其对花生的化感作用[J]. 生态学报, 2010, 30(8): 2128-2134. (  0) 0) |
| [4] |
马凤鸣, 王安娜, 吴蕾, 等. 大豆根系分泌物的鉴定及PAL1, PAL2, C4H的克隆[J]. 作物杂志, 2011(2): 64-71. (  0) 0) |
| [5] |
郭修武, 李坤, 孙英妮, 等. 葡萄根系分泌物的化感效应及化感物质的分离鉴定[J]. 园艺学报, 2010, 37(6): 861-868. (  0) 0) |
| [6] |
刘新虎, 赵小亮, 万传星, 等. 棉花根系分泌物对棉苗生长及生理活性的影响[J]. 棉花学报, 2009, 21(4): 81-83. (  0) 0) |
| [7] |
RICE E L. Allelopathy[M]. 2ed. New York: Academy Press Inc., 1984, 151-187.
(  0) 0) |
| [8] |
BAZIRAMAKENGA R, LEROUX G D, SIMARD R R. Effects of benzoic and cinnamic acids on membrane permeability of soybean roots[J]. J Chem Ecol, 1995, 21: 1271-1285. DOI:10.1007/BF02027561 (  0) 0) |
| [9] |
阎飞, 杨振明, 韩丽梅. 植物化感作用及其作用物的研究方法[J]. 生态学报, 2000, 20(4): 692-696. DOI:10.3321/j.issn:1000-0933.2000.04.029 (  0) 0) |
| [10] |
刘苹, 江丽华, 万书波, 等. 花生根系分泌物对根腐镰刀菌和固氮菌的化感作用研究[J]. 中国农业科技导报, 2009, 11(4): 107-111. DOI:10.3969/j.issn.1008-0864.2009.04.018 (  0) 0) |
| [11] |
袁云云, 咸洪泉, 洪永聪, 等. 花生根系分泌物的鉴定及其化感效应分析[J]. 花生学报, 2011, 40(3): 24-29. DOI:10.3969/j.issn.1002-4093.2011.03.007 (  0) 0) |
| [12] |
王芳. 茄子连作障碍机理研究[D]. 北京: 中国农业大学, 2003. http://cdmd.cnki.com.cn/Article/CDMD-10019-2003092780.htm
(  0) 0) |
| [13] |
柴强, 黄高宝, 黄鹏, 等. 鹰咀豆根系分泌物的分离鉴定及典型分泌物苯甲醛的化感效应[J]. 草业学报, 2005, 14(1): 106-111. DOI:10.3321/j.issn:1004-5759.2005.01.020 (  0) 0) |
| [14] |
张凤丽, 周宝利, 王茹华, 等. 嫁接茄子根系分泌物的化感效应[J]. 应用生态学报, 2005, 16(4): 750-753. DOI:10.3321/j.issn:1001-9332.2005.04.033 (  0) 0) |
| [15] |
CHEN S L, ZHOU B L, LIN S S. Accumulation of cinnamic acid and vanillin in eggplant root exudates and the relationship with continuous cropping obstacle[J]. Afr J Biotechnol, 2011, 10(14): 2659-2665. DOI:10.5897/AJB (  0) 0) |
| [16] |
刘素慧, 刘世琦, 张自坤, 等. 大蒜根系分泌物对同属作物的抑制作用[J]. 中国农业科学, 2011, 44(12): 2625-2632. DOI:10.3864/j.issn.0578-1752.2011.12.027 (  0) 0) |
| [17] |
PRAMANIK M H R, ASAO T, YAMAMOTO T, et al. Sensitive bioassay to evaluate toxicity of aromatic acids to cucumber seedlings[J]. Allelopathy J, 2001, 18: 161-169. (  0) 0) |
| [18] |
GHAREIB H R, ABDELHAMED M S, IBRAHIM O H. Antioxidative effects of the acetone fraction and vanillic acid from chenopodium murale on tomato plants[J]. Weed Biol Manag, 2010, 10(1): 64-72. DOI:10.1111/wbm.2010.10.issue-1 (  0) 0) |
| [19] |
AHRABI F, ENTESHARI S, MORADSHAHI A. Allelopathic potential of para-hydroxybenzoic acid and coumarin on canola:Talaieh cultivar[J]. J Med Plants Res, 2011, 5(20): 5104-5109. (  0) 0) |
| [20] |
刘新虎, 赵小亮, 万传星, 张利莉. 棉花根系分泌物对棉苗生长及生理活性的影响[J]. 棉花学报, 2009(4): 81-83. (  0) 0) |
| [21] |
董章杭, 林文雄. 作物化感作用研究现状及前景展望[J]. 中国生态农业学报, 2001, 9(1): 80-83. (  0) 0) |
| [22] |
宋亮, 潘开文, 王进闯, 等. 酚酸类物质对苜蓿种子萌发及抗氧化物酶活性的影响[J]. 生态学报, 2006, 26(10): 3393-3403. DOI:10.3321/j.issn:1000-0933.2006.10.032 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36