玫烟色棒孢霉Isaria fumosorosea是一种常见的虫生真菌复合种, 其寄主包括半翅目、鳞翅目、双翅目、鞘翅目、膜翅目等, 广泛用于防治蚜虫、粉虱类害虫, 同时其也是土壤分离物的常见菌种之一[1-2].该菌在分离鉴定、致病性、代谢产物活性、生产应用及安全性等方面均有研究[3-9].该菌不仅对蚜虫Aphis spp.、小菜蛾Plutella xylostella、菜青虫Pieris rapae等重要害虫有很强的致病性, 对叶螨Tetranychidae也具有很好的杀卵效果[9].烟粉虱Bemisia tabaci是复合种, B与Q生物型是世界公认的危险性入侵害虫, 发展控制该虫的生物防治技术十分必要[10].笔者前期研究[8]发现, 从烟粉虱感病虫体上分离筛选的疑似玫烟色棒孢霉菌株IfB01对B型烟粉虱有较好的控制效果, 该菌分生孢子在浓度为1.0 ×107 mL-1时对2龄若虫致死率超过81%, 2.5 ×106 mL-1与1.25 mg·L-1螺虫乙酯混合使用则防效达到87%以上.由于该菌株表现出较高的应用价值, 笔者用形态学、分子生物学方法鉴定了该菌株, 探索该菌株以廉价的农产品为培养基质的固体发酵产孢条件, 为其生产上推广应用提供指导.
1 材料与方法 1.1 材料IfB01菌株斜面菌种, 中国典型培养物保藏中心保藏, 编号CCTCC M 2012400.
麦麸、玉米粉和米糠3种培养基材料均购自广州市天河区长寿路市场; 查氏培养基:NaNO3 2 g, K2HPO4 1 g, KCl 0.5 g, MgSO4 0.5 g, FeSO4 0.01 g, 蔗糖30 g, 琼脂20 g, 水1 L; PD培养液:马铃薯20 g, 葡萄糖10 g, 水1 L.
1.2 方法 1.2.1 形态学观察刮取IfB01菌株斜面菌种的分生孢子, 接种于查氏培养基平板上, 25℃条件下培养7 d, 观察、测定并记录菌落颜色、形状、大小, 显微镜观测其分生孢子形态与产孢结构.
1.2.2 ITS1-5.8S-ITS2 rDNA和β-微管蛋白基因同源性分析用DNA提取试剂盒(DP3112, 北京百泰克生物技术有限公司)提取供试菌株总DNA, ITS1-5.8S- ITS2 rDNA同源性分析PCR引物[11]为:ITS1 (5'-TCCGTAGGTGAACCTGCGG-3')和IST4(5'-TCCTCCGCTTATTGATATGC-3')(由广州英俊生物技术有限公司合成). PCR反应体系(25 μL):10 × Buffer 2.5 μL, 25 mmol·L-1MgCl2 2.0 μL, dNTPs(10 mmol·L-1) 2.5 μL, 上、下游引物(20 μmol·L-1)各1 μL, DNA模板1 μL, Taq酶0.5 μL, ddH2O补至25 μL.扩增条件:94℃ 3 min; 94℃ 45 s, 50℃ 45 s, 72℃ 45 s, 35个循环; 72℃延伸10 min.纯化回收产物委托广州英俊生命技术公司进行测序.测序序列BLAST搜索相似性较高的相关序列, 使用Cluster W进行多重序列比对.在MEGA 5.0中构建Neighbour-joining (NJ)系统发育树, 并用Bootstrap分析进化树稳定性, 重复1 000次.
β-微管蛋白基因同源性分析PCR引物[12]:Btla (5'-TTCCCCCGTCTCCACTTCTTCATG-3')和Btlb (5'- GACGAGATCGTTCATGTTGAACTC-3'), 扩增条件:94 ℃ 3 min; 94℃ 1 min, 58℃ 1 min, 72℃ 2 min, 35个循环; 72℃延伸8 min.其他处理同上.
1.2.3 培养基对产孢量的影响设7个处理:麦麸、玉米粉、米糠、麦麸+玉米粉、麦麸+米糠、米糠+玉米粉、麦麸+米糠+玉米粉, 各称取20 g材料(混合培养基中不同成分以等质量混合), 加10 mL蒸馏水, 充分混匀, 装入250 mL三角瓶中封口高压蒸汽灭菌备用.每处理重复3次.
接种、培养与孢子产量测定:将IfB01菌株分生孢子接种至已灭菌的PD培养液中, 终浓度为1 ×106 mL-1, 25℃条件下、150 r·min-1培养3 d, 将5 mL菌液接种至固体培养基, 移至培养箱中25℃静置培养10 d, 然后将培养物取出, 捣碎, 充分混匀, 再取1 g培养物, 加入100 mL 0.05% (w)吐温80溶液, 振荡混匀, 用血球计数板测定分生孢子浓度, 换算成1 g培养基的分生孢子产量.
1.2.4 培养基配比、含水量、接种量、金属元素和pH对产孢量的影响根据"1.2.3"的试验结果选择麦麸+玉米粉培养基继续后续试验.
配置麦麸:玉米粉质量比分别为1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1的培养基共9个处理, 每个处理重复3次, 后续处理为"1.2.3"的接种、培养与孢子产量测定.
根据培养基配比试验结果选择麦麸:玉米粉为5:5的培养基继续后续试验.
分别设置含水量(w)为32%、37%、42%、47%、52%、57%的培养基, 每个处理重复3次, 后续处理为1.2.3的接种、培养与孢子产量测定.
在培养基中添加3、4、5、6、7、8 mL菌液, 每个处理重复3次, 后续处理按"1.2.3"接种、培养与孢子产量测定.
在20 g的麦麸+玉米粉(5:5)培养基中分别添加0.2 g MgSO4、FeSO4、Na2SO4、K2SO4、CaSO4, 对照组不添加, 每个处理重复3次, 后续处理为"1.2.3"的接种、培养与孢子产量测定.
将培养基pH调节为5、6、7、8和9共5个处理.后续处理为"1.2.3"的接种、培养与孢子产量测定.
1.3 数据处理采用SPSS V17.0处理数据, 邓肯氏新复极差法比较平均数差异显著性.
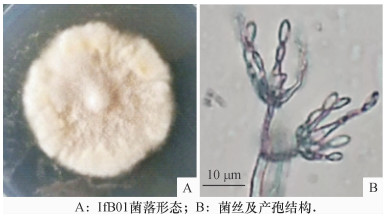
2 结果与分析 2.1 菌株IfB01的分类学鉴定 2.1.1 形态学特征在查氏培养基上, 起初菌落呈白色, 中央微隆起; 延长培养, 菌落呈不规则圆形, 产孢后, 表面呈灰色, 背面淡黄色, 培养14 d菌落直径(46.70 ± 1.30) mm(图 1A).菌丝及产孢结构见图 1B, 菌丝分隔, 无色透明, 宽度(3.30 ± 0.52) μm; 分生孢子梗长(10.83 ± 2.34) μm, 宽(2.94 ± 0.37) μm; 产孢结构复杂, 其上着生3~6个瓶梗, 瓶梗基部球形或椭圆形膨大, 向上细颈, 瓶梗长(10.90 ± 1.86) μm, 宽(3.36 ± 0.32) μm; 分生孢子透明, 光滑, 梭形至柱状, 长(5.61 ± 0.76) μm, 宽(2.01 ± 0.23) μm, 呈首尾相接的长链状.
|
图 1 IfB01菌株形态学鉴定 Figure 1 Morphological analysis of IfB01 strain |
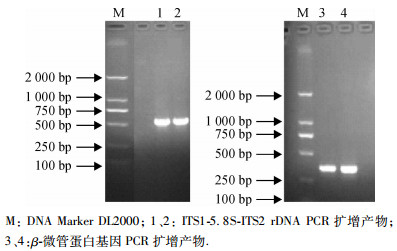
ITS1-5.8S-ITS2 rDNA基因和β-微管蛋白基因扩增结果见图 2, 产物分别约为580和320 bp.
|
图 2 PCR电泳图 Figure 2 PCR electrophoretogram M:DNA Marker DL2000; 1、2:ITS1-5.8S-ITS2 rDNA PCR扩增产物; 3、4:β-微管蛋白基因PCR扩增产物. |
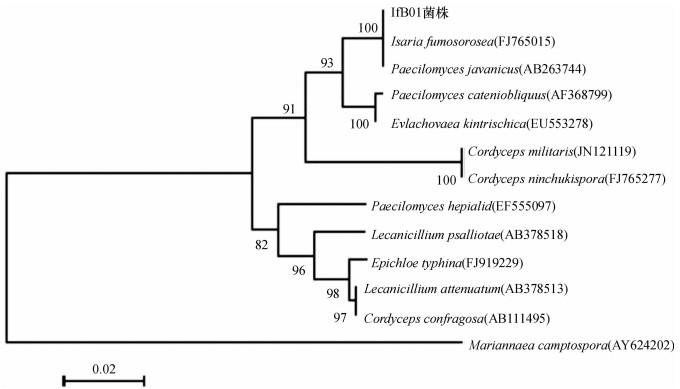
ITS1-5.8S-ITS2 rDNA特异性扩增产物经测定, 其序列共576 bp.将该段序列提交GenBank, DNA序列计算机排定结果表明, 其与1株玫烟色棒孢霉Isaria fumosorosea(登录号FJ765015)和1株爪哇拟青霉Paecilomyces javanicus(登录号AB263744)高度相似.以IfB01菌株与爪哇拟青霉、玫烟色拟青霉及一些近似菌株, 及以弯孢玛利亚霉Mariannaea elegans var. elegans(登录号AY624244)为外群, 构建其系统发育进化树, IfB01菌株与1株玫烟色棒孢霉及1株爪哇拟青霉在同一分支上, 相似性达100%(图 3).
|
图 3 ITS1-5.8S-ITS2 rDNA序列构建IfB01菌株的系统发育树 Figure 3 Phylogenetic tree of IfB01 strain based on ITS1-5.8S-ITS2 rDNA sequences |
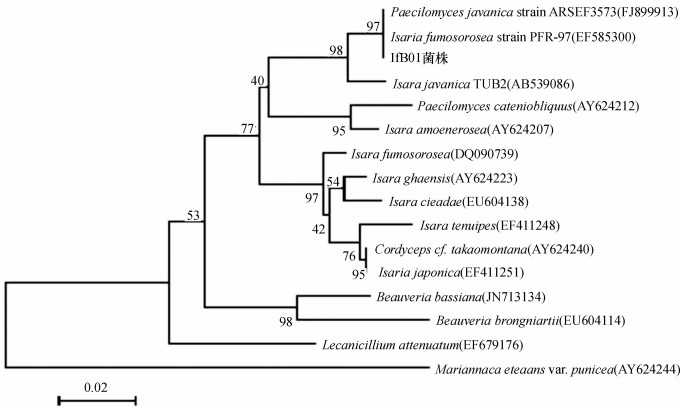
β-微管蛋白基因特异性扩增产物经测定, 其序列为319 bp.在GenBank中输入该序列段, 结果表明, 该序列与1株玫烟色棒孢霉I. fumosorosea(登录号EF585300)和1株爪哇拟青霉P. javanicus(登录号FJ899913)高度同源.同样构建其系统发育树, 该菌株与1株玫烟色棒孢霉I. fumosorosea (登录号EF585300)和1株爪哇拟青霉P. javanicus(登录号FJ899913)同属一支, 相似性达97% (图 4).
|
图 4 β-微管蛋白基因序列构建IfB01菌株的系统发育树 Figure 4 Phylogenetic tree of IfB01 strain based on β-tubulin DNA sequences |
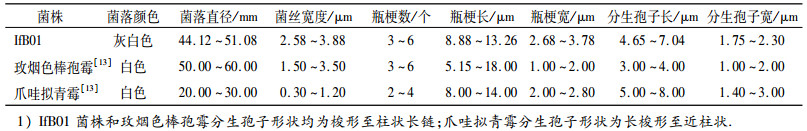
ITS1-5.8S-ITS2 rDNA区域分支发育树和β-微管蛋白DNA序列分支发育树分析均表明, IfB01菌株与玫烟色棒孢霉和爪哇拟青霉高度同源.将IfB01菌株形态学特征与玫烟色棒孢霉、爪哇拟青霉形态学特性[13]进行比较分析(表 1), 发现IfB01菌株更接近玫烟色棒孢霉, 因此, 将IfB01菌株确定为玫烟色棒孢霉.
|
|
表 1 IfB01菌株、玫烟色棒孢霉及爪哇拟青霉形态学特性1) Table 1 Morphological characteristics of strain IfB01, Isaria fumosorosea and Paecilomyces javanicus |
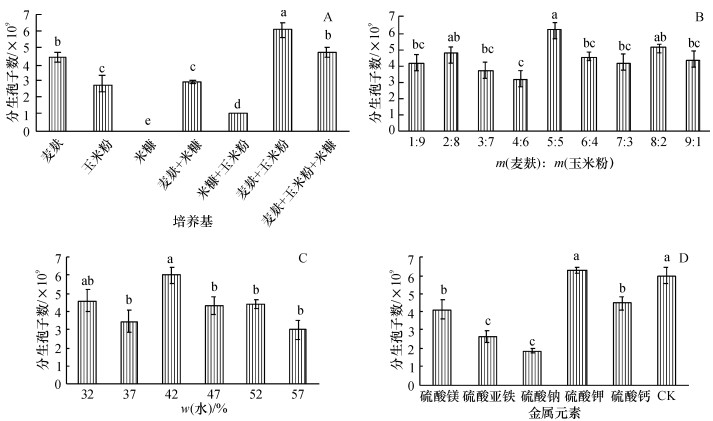
结果表明, 麦麸+玉米粉等质量混合培养基最适产孢, 其产孢量每1 g培养基最高达到6.07 ×109, 其次为麦麸+玉米粉+米糠混合培养基和单一麦麸培养基, 而米糠培养基不产孢(图 5A).
|
图 5 培养基对产孢量的影响 Figure 5 Effects of different media on conidiospore production 各图中产孢量以每1 g培养基计, 图柱上凡具有一个相同小写字母表示差异不显著(P > 0.05, Duncan' s) |
麦麸与玉米粉不同质量配比显著影响孢子产量(图 5B), 当麦麸:玉米粉质量比为5:5时, 产孢量每1 g培养基最高达6.17 ×109, 配比2:8和8:2次之, 产孢量每1 g培养基分别为4.80 ×109和5.13 ×109.
2.2.2 培养基含水量和金属元素对产孢量的影响培养基含水量对产孢量显著影响(图 5C), 当含水量(w)为42%时, 该菌株产孢量每1 g培养基为6.01 ×109, 显著高于除含水量32%外的其他处理.
金属元素对产孢量的影响结果(图 5D)表明, 除钾元素外, 镁、铁、钠、钙元素都影响产孢, 其孢子产量每1 g培养基显著低于不添加金属盐的对照处理的产孢量5.99 ×109.
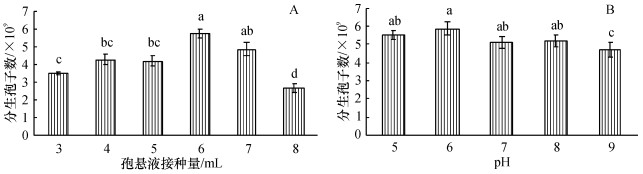
2.2.3 接种量和pH对产孢量的影响接种量对产孢有较大影响, 当接种量为20 g培养基6 mL孢悬液时, 产孢量每1 g培养基为5.75 × 109个, 显著高于除7 mL孢悬液外的其他处理(图 6A).
|
图 6 接种量与pH对产孢量的影响 Figure 6 Effects of inoculum dosages and pH on conidiospore production 产孢量以每g培养基计, 图柱上凡具有一个相同小写字母表示差异不显著(P > 0.05, Duncan' s法) |
该菌株在pH 5~8都有较好的分生孢子产量, 且无显著性差异, 说明该菌株适应酸碱变化的范围较广(图 6B).
3 讨论与结论虫生真菌的分类比较复杂, 仅凭形态学与分子生物学方法难以进行正确的分类.玫烟色棒孢霉曾经长期被当作玫烟色拟青霉Paecilomyces fumosoroseus, Luangsa-Ard等[14]研究了rDNA-ITS和β-微管蛋白基因的同源性后, 将玫烟色拟青霉属Paecilomyces的若干个种划归棒孢霉属Isaria.玫烟色棒孢霉又是一个复合种, 其遗传多样性丰富和种群结构非常复杂.根据rDNA-ITS及微卫星位点分析结果和不同寄主与地理区域, 该菌种可分成3个品系, 其中1个品系来自烟粉虱寄主[2, 15-16].本试验采用形态学与rDNA-ITS和β-微管蛋白基因分析相结合的方法, 将IfB01菌株鉴定为玫烟色棒孢霉Isaria fumosorosea, 与上述文献描述是相符的.
丝孢类昆虫病原真菌的分生孢子生产一般采用两相发酵工艺, 产孢不光对营养有要求, 还要求温湿度、酸碱度及氧气等, 且不同菌种和菌株的要求不同[17].因此, 在利用玫烟色棒孢霉防治害虫的研究中, 有必要对其培养条件进行优化, 探索分生孢子的最佳生产工艺.已有研究表明, 麦粉、麦麸皮、黄豆粉等培养基质可促进玫烟色棒孢霉产生分生孢子[18-19].本试验中, 以麦麸+玉米粉(5:5)为基质时, 产孢量最高.
本菌株产孢对酸碱度的耐受性较好, 我国南方地区酸雨污染较严重, 环境酸化倾向明显, 较好的耐酸性将有利于该菌株在自然条件下产孢, 从而提高其控害能力.矿质元素本来是真菌生长发育所必需的, 但本试验表明几种金属元素都不利于该菌株产孢, 这可能是由于所选用的培养基玉米和麦麸中已含有该菌所需的元素, 添加这些金属盐后增加了盐度或渗透压, 不利于产孢, 这需要进一步的研究.若能提高虫生真菌的耐盐性, 对于改善其在盐碱地里的生存能力是有帮助的, 进而可以提高虫生真菌在自然条件下的库存, 改善其自然种群对害虫的控制作用.
本研究通过形态学与分子生物学结合的方法, 鉴定了具有烟粉虱真菌杀虫剂潜力的IfB01菌株, 明确其为玫烟色棒孢霉I. fumosorosea, 筛选了最适于该菌株产孢的玉米粉+麦麸混合培养基, 明确麦麸:玉米粉质量配比5:5, 培养基含水量(w)为42%, 接种量为20 g培养基6 mL菌液, 以及pH 5~8时, 最适宜产孢.研究结果将为IfB01菌株的生产应用提供指导, 有利于玫烟色棒孢霉在烟粉虱生物防治中发挥更重要的作用.
| [1] |
武觐文, 王德祥. 中国虫生真菌研究与应用[M]. 北京: 中国农业科技出版社, 1993, 203-210.
(  0) 0) |
| [2] |
ZIMMERMANN G. The entomopathogenic fungi Isaria farinose (formerly Paecilomyces farinosus) and the Isaria fmosorosea spcies complex (formerly Paecilomyces fumosoroseus):Biology, ecology and use in biological control[J]. Biocontrol Sci Techn, 2008, 18(9): 865-901. DOI:10.1080/09583150802471812 (  0) 0) |
| [3] |
黄勃, 樊美珍, 李增智, 等. 利用RAPD技术对拟青霉属菌株进行分类鉴定[J]. 菌物系统, 2000, 21(1): 33-38. (  0) 0) |
| [4] |
黄振, 任顺祥. 玫烟色拟青霉分离株的生物学特性及其对烟粉虱的致病力[J]. 中国生物防治, 2004, 20(4): 248-251. (  0) 0) |
| [5] |
柴一秋, 张乐人, 张晖, 等. 几种虫生真菌代谢产物生物活性的初步研究[J]. 南京农业大学学报, 2000, 23(3): 37-40. (  0) 0) |
| [6] |
ZHOU F C, ALI S, HUANG Z. Influence of the entomopathogenic fungus Isaria fumosorosea on Axinoscymnus cardilobus (Coleoptera:Coccinellidae) under laboratory conditions[J]. Biocontrol Sci Techn, 2010, 20(7): 709-722. DOI:10.1080/09583151003714083 (  0) 0) |
| [7] |
D'ALESSANDRO C P, PADIN S, URRUTIA M I, et al. Interaction of fungicides with the entomopathogenic fungus Isaria fumosorosea[J]. Biocontrol Sci Techn, 2011, 21(2): 189-197. DOI:10.1080/09583157.2010.536200 (  0) 0) |
| [8] |
ZOU C H, LI L, DONG T Y, et al. Joint action of the entomopathogenic fungus Isaria fumosorosea and four chemical insecticides against the whitefly Bemisia tabaci[J]. Biocontrol Sci Techn, 2014, 24(3): 315-324. DOI:10.1080/09583157.2013.860427 (  0) 0) |
| [9] |
ZHANG L, SHI W B, FENG M G. Histopathological and molecular insights into the ovicidal activities of two entomopathogenic fungi against two-spotted spider mite[J]. J Invertebr Pathol, 2014, 117: 73-78. DOI:10.1016/j.jip.2014.02.005 (  0) 0) |
| [10] |
DE BARRO P J, LIU S S, BOYKIN L M, et al. Bemisia tabaci:A statement of species status[J]. Annu Reventomol, 2011, 56: 1-19. (  0) 0) |
| [11] |
燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J]. 中国卫生检疫杂志, 2008, 18(10): 1958-1961. (  0) 0) |
| [12] |
GLASS N L, DONALDSON G C. Development of primer sets designed foruse with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Appl Environ Microb, 1995, 61(4): 1323-1330. (  0) 0) |
| [13] |
LIANG Z Q, HAN Y F, CHU H L., et al. Studies on the genus Paecilomyces in China I[J]. Fungal Divers, 2005, 20: 83-101. (  0) 0) |
| [14] |
LUANGSA-ARD J J, HYWEL-JONES N L, MANOCH L., et al. On the relationships of Paecilomyces sect. Isarioidea species[J]. Mycol Res, 2005, 109(5): 581-589. DOI:10.1017/S0953756205002741 (  0) 0) |
| [15] |
GAUTHIER N, DALLEAU-CLOUET C, FARGUES J. Microsatellite variability in the entomopathogenic fungus Paecilomyces fumosoroseus:Genetic diversity and population structure[J]. Mycologia, 2007, 99(5): 693-704. DOI:10.1080/15572536.2007.11832533 (  0) 0) |
| [16] |
FARGUES J, BON M C, MANGUIN S, et al. Genetic variability among Paecilomyces fumosoroseus isolates from various geographical and host insect origins based on the rDNA-ITS regions[J]. Mycol Res, 2002, 106(9): 1066-1074. DOI:10.1017/S0953756202006408 (  0) 0) |
| [17] |
GANDARILLA-PACHECO F L, AREVALO-NIŇOK, GALÁNWONG L J, et al. Evaluation of conidia production and mycelial growth in solid culture media from native strains of entomopathogenic fungi isolated from citrus-growing areas of México[J]. Afr J Biotechnol, 2012, 11(79): 14453-14460. (  0) 0) |
| [18] |
李忠, 刘寿章, 刘爱英, 等. 玫烟色拟青霉营养需求及培养条件研究[J]. 贵州农业科学, 2004, 32(5): 15-17. DOI:10.3969/j.issn.1001-3601.2004.05.005 (  0) 0) |
| [19] |
李忠, 刘爱英, 梁宗琦. 玫烟色拟青霉的培养及固体培养基的筛选[J]. 贵州农业科学, 2002, 30(6): 27-28. DOI:10.3969/j.issn.1001-3601.2002.06.010 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36