黄瓜Cucumis sativus又名胡瓜、青瓜.我国是世界上黄瓜栽培面积最大、产量最高的国家[1].冷害是果蔬采后低温贮运的主要胁迫[2-4], 而黄瓜是典型的亚热带植物, 在贮藏温度低于10 ℃时即容易出现冷害症状, 表现为果实萎蔫变黄, 失水严重, 出现水渍状凹陷, 清新气味消失, 严重影响果实的商品价值, 从而造成严重的经济损失[5-6].
热处理和冷锻炼可以提高果实的耐冷性, 如热处理可提高枇杷[7]、番茄[8]、桃[9-10]、柑橘[11]、青椒[12]等的耐冷性, 而冷锻炼也可以提高枇杷[13]、葡萄柚[14]、鳄梨[15]、桃[16]等的耐冷性, 并且转录因子与果实冷害密切相关[17-18].虽然有报道表明, 热激转录因子参与植物的耐冷性[19-20], 但目前热激转录因子与植物的抗逆性方面的研究主要集中在热激转录因子参与植物耐热性等方面[21-22], 而有关黄瓜果实贮藏冷害与热激转录因子的关系目前鲜见报道.为此, 本文以“沃林17号”黄瓜果实为试验材料, 研究了热处理和冷锻炼处理对低温贮藏过程中黄瓜外观、品质及生理生化变化的影响, 同时克隆了黄瓜的热激转录因子CsHSFs基因, 并检测了冷害过程中这些基因的转录水平, 分析了与果实冷害相关的CsHSF7和CsHSF11蛋白的转录激活活性, 试图从生理和分子水平探讨热处理和冷锻炼处理提高黄瓜果实耐冷性的作用机理, 为热处理和冷锻炼处理在减轻果蔬冷害上的应用提供科学依据.
1 材料与方法 1.1 供试材料用于试验的“沃林17号”黄瓜购于番禺区广东省农业科学院基地.果实顺直、饱满, 粗细及成熟度基本一致, 无机械伤及病虫害.采收后立即运抵华南农业大学园艺学院实验室, 20 ℃预冷过夜, 自来水清洗晾干待用.
1.2 热处理与冷锻炼处理选取上述黄瓜果实分为3组, 采用打孔的聚乙烯薄膜袋对果实进行包装.第1组直接置于8 ℃恒温箱中贮藏, 作为冷害对照(CK);第2组用果蔬热处理保鲜机(BX-4015), 50 ℃热水处理1 min, 恢复室温后, 置于8 ℃恒温箱中贮藏(简称热处理);第3组于15 ℃预贮2 d后再转移到8 ℃恒温箱中贮藏(简称冷锻炼处理).分别在贮藏的0、3、6、9、12和15 d时取样, 进行相关生理指标的测定;所有处理取3条果实并均分为上、中、下3部分, 取部分果实切块混匀后用液氮速冻, - 80 ℃储存, 用于后续分析.
1.3 黄瓜果实生理指标的测定相对电导率:在黄瓜果实3等分处切片, 用打孔器制成厚薄均匀、大小一致的组织圆片(直径0.5 cm)置于三角锥瓶中, 双蒸水洗2次, 用滤纸吸干水分, 准确称取2.0 g圆片, 加入30 mL双蒸水, 在25 ℃条件下保温30 min, 用DDS-11c型电导率仪测C1, 加热煮沸15 min后迅速冷却, 再测C2, C1 /C2即为相对电导率, 每处理3个重复, 每个重复测3次.
可溶性固形物(TSS)含量:整个果实榨汁过滤后, 采用PR-32α(Minolta)数字折光仪直接读数, 每处理3个重复, 每个重复测3次.
叶绿素含量:参考文献[23], 采用浸提法, 每个处理3个重复, 每个重复测3次.
颜色的测定:采用日本MinoltaCR-300全自动测色色差计测量h*, 每处理3个重复, 每个重复4个果实, 分别在每根黄瓜果实的两侧面画圈固定位置进行测定, 测定每个果实对称的6个部位.
1.4 黄瓜果实RNA提取及第1链cDNA合成采用热硼酸法[24], 从黄瓜果皮和果肉混合样品中提取总RNA, 以黄瓜果实总RNA为模板, 采用Reverse Transcription M-MLV(RNase H-)试剂盒(TaKaRa公司)反转录合成第1链cDNA, 用于基因克隆和荧光定量PCR分析.
1.5 CsHSFs基因的生物信息学分析从网上登录的黄瓜基因组信息(http://cucumber.genomics.org.cn/page/cucumber/index.jsp)中挑选了21个HSF基因, 用Clustal X软件进行相似性进化分析, 并通过MEGA5.0采用邻接法(Neighborjoin)构建系统进化树.
1.6 CsHSFs基因的Real-time定量RT-PCR(qRT-PCR)分析根据进化分析结果, 选取7个不同亚族的CsHSFs(5、6、7、9、11、13、17)进行荧光定量分析.采用Primer 5.0软件筛选用于qRT-PCR的引物, 用CsActin1作为内参基因[25].qRT-PCR使用的荧光染料为TaKaRa SYBR Green Ⅰ, 使用仪器为BIO-RAD-CFX9600.20 μL qRT-PCR反应液中含有40 ng的cDNA和5 μmol·L-1基因特异引物.qRT-PCR溶液配制具体操作过程见TaKaRa SYBR Green Ⅰ试剂盒说明书, 并用相对定量软件对PCR结果的溶解曲线和标准曲线进行分析、定量.荧光定量反应程序:95 ℃预变性3 min;95 ℃变性5 s, 55 ℃退火10 s, 72 ℃延伸30 s, 40个循环.溶解曲线分析从60 ~ 95 ℃, 第1步维持45 s, 以后每升高1 ℃维持5 s.荧光定量引物见表 1.
|
|
表 1 本文所用引物序列 Table 1 The primer sequences used in this study |
挑选与黄瓜果实冷害相关的基因CsHSF7和CsHSF11, 使用Primer 5软件设计基因特异性引物, 引物序列见表 1.经过一系列的PCR扩增、产物凝胶回收、载体连接(TaKaRa pMD20-T)、转化(酵母感受态细胞TaKaRa DH5α)、蓝白斑筛选后, 送广州英潍捷基生物技术有限公司进行测序确认.
1.8 转录激活活性分析采用Matchmaker Gold Yeast Two-Hybrid System系统(Clontech)进行分析CsHSF7 /11的转录激活活性.选取合适的酶切位点, 将CsHSF7和CsHSF11基因全长基因片段及相应的区段从pMD20-T载体转移至BD载体pGBKT7载体上, 并保证构建后的重组质粒读码正确.连接BD载体时使用的是In-fusion PCR Cloning Kit(Clontech), 构建重组BD载体所需的引物见表 1.在LiAc介导下将质粒转入酵母Y2HGold菌株中, 3 d之后, 如果酵母在相应的平板上面有生长, 则挑取单克隆涂布在SD-Trp-His-Ade/Kan平板上, 3 d之后如果有生长, 则向酵母菌落上滴加x-α-Gal溶液并观察酵母颜色的变化.如果10 min后酵母变蓝, 则说明转入的重组BD质粒激活了酵母内下游报告基因的表达, 说明加入BD载体中的目的蛋白具有转录激活能力.
1.9 数据统计与分析作图采用Excel 2007、Origin7和Photoshop软件进行数据统计分析及绘图.
2 结果与分析 2.1 热处理及冷锻炼处理对黄瓜果实外观的影响在低温(8 ℃)贮藏下, 黄瓜果实3 d时出现微小凹陷的冷害症状, 6 d时开始出现明显的冷害症状, 而经过热处理和冷锻炼处理的黄瓜果实在整个贮藏期间保持了较好的外观, 至9 d时才开始出现微小的冷害症状, 表明热处理及冷锻炼处理均可提高果实低温耐冷性.
2.2 热处理及冷锻炼处理对黄瓜果实相对电导率的影响相对电导率是反映果实细胞膜透性的指标.如图 1所示, 低温(8 ℃)条件下, 随着贮藏时间的延长, 果实的相对电导率呈现上升趋势.在贮藏第9天, 经过热处理和冷锻炼处理的黄瓜果实相对电导率分别为50.70%和42.17%, 而此时对照果实达到67.55%, 说明2种处理均能减缓果实相对电导率的升高, 减轻黄瓜果实的冷害, 并且冷锻炼处理的效果比热处理明显.
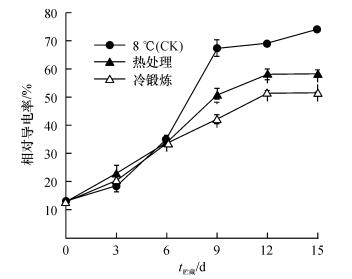
|
图 1 热处理及冷锻炼对黄瓜果实相对电导率的影响 Figure 1 Changes in relative electrolyte leakages of cucumber fruits pre-treated by heat shock and cold acclimation |
如图 2所示, 低温条件下(8 ℃), 黄瓜果实TSS和叶绿素含量总体呈逐渐下降趋势.TSS含量在各处理组间无明显差异, 表明热处理和冷锻炼处理均不影响果实的TSS含量.在叶绿素含量方面, 对照果实的叶绿素含量下降明显, 在贮藏的第6天, 叶绿素的质量分数为0.196 2 mg·g-1, 并随着贮藏时间的延长而继续下降, 到第15天下降至0.144 9 mg·g-1, 而经过热处理和冷锻炼处理的黄瓜果实的叶绿素在第6天时分别为0.217 6和0.241 4 mg·g-1, 在第15天时分别为0.160 9和0.165 4 mg·g-1, 均明显高于对照果实, 且冷锻炼处理的叶绿素含量下降比热处理慢, 说明冷锻炼和热处理均有效延缓了黄瓜果实叶绿素的降解.
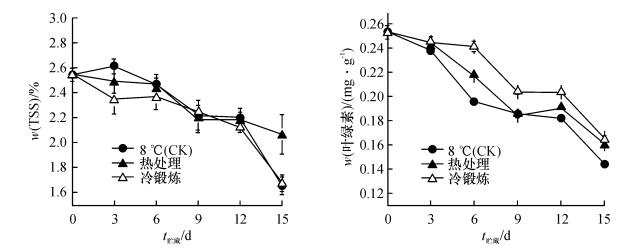
|
图 2 热处理及冷锻炼对黄瓜果实TSS和叶绿素含量的影响 Figure 2 Changes in TSS and chlorophyll contents in cucumber fruits pre-treated by heat shock and cold acclimation |
果皮颜色是影响果实商品性的重要指标之一, 如图 3所示, 冷锻炼处理的h*一直维持稳定水平, 并且在贮藏末期呈上升趋势.而热处理和对照果实的h*均呈逐渐下降的趋势, 其中下降最明显的是对照果实, 至贮藏末期对照果实的h*为120.74, 热处理的h*在整个贮藏期均高于对照.说明热处理和冷锻炼处理较好地保持了黄瓜果实的色泽.
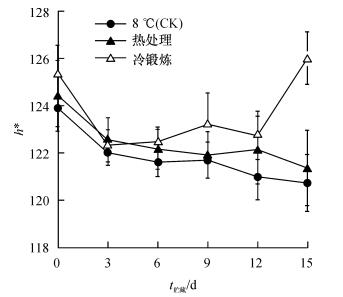
|
图 3 热处理及冷锻炼处理对黄瓜果实h*的影响 Figure 3 Changes in h* of cucumber fruits pre-treated by heat shock and cold acclimation |
为了研究黄瓜果实耐冷性的分子机理, 从黄瓜基因组序列中获得了21个HSFs氨基酸序列, 命名为CsHSF1 ~ CsHSF21, 并对其相似性进行了聚类进化分析, 结果(图 4)显示, CsHSFs可分为3大类(Ⅰ、Ⅱ和Ⅲ), 其中Ⅰ类又可以分为4个亚类(A、B、C、D): CsHSF6、10、17、20、21属于ⅠA类, CsHSF4、7属于ⅠB类, CsHSF1、5、13属于ⅠC类, CsHSF9属于ⅠD类, CsHSF3、8、11、12、14、15、16、18属于Ⅱ类, CsHSF2、19属于Ⅲ类.
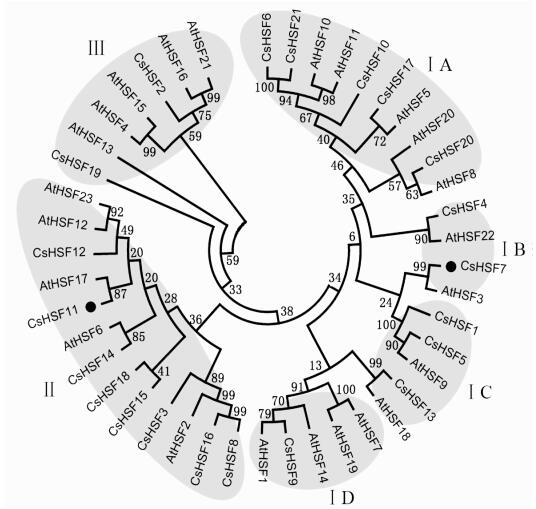
|
图 4 CsHSFs与拟南芥AtHSFs蛋白的进化关系 Figure 4 Phylogenetic tree of CsHSFs and AtHSFs from Arabidopsis |
根据CsHSFs的系统进化分析结果, 采用荧光定量方法, 检测了其中的7个不同亚族的CsHSFs基因(包括CsHSF5、6、7、9、11、13、17等)在低温下的表达特征.结果显示, 与对照相比, 热处理和冷锻炼处理在贮藏的前6 d显著提高了CsHSF7和CsHSF11的表达量, 且热处理的表达要显著高于对照及冷锻炼处理(图 5), 说明CsHSF7和CsHSF11的基因表达与热处理和冷锻炼处理诱导的果实耐冷性有关.而CsHSF5及CsHSF17的表达总体上呈下调的趋势, CsHSF6、CsHSF9和CsHSF13的表达与黄瓜果实耐冷性的增强关系不大.
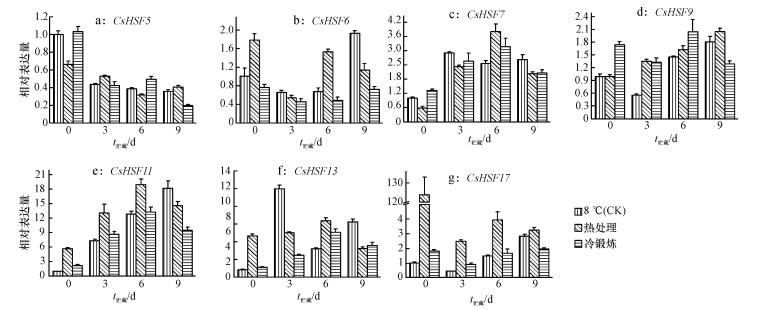
|
图 5 低温贮藏下不同预处理黄瓜果实中CsHSFs基因的表达特征 Figure 5 Expression patterns of CsHSFs genes in cucumber fruits during low temperature storage in different pretreatments |
为了深入研究CsHSF7/11基因参与调控黄瓜果实冷害的机制, 我们分析了这2个基因在酵母菌内的转录活性.将CsHSF7/11的ORF连接到GAL4系统的DNA结合域, 将构建而成的DBD-CsHSF7和DBD-CsHSF11分别转入酵母Y2HGold菌株, 确认其在SD /-Trp的培养基上能够生长, 表明各质粒都转入酵母菌中.将转化了质粒的酵母菌株接种于含有金担子素A(AbA)的营养缺陷型培养基SD /-Trp-His-Ade上, 发现转入DBD-CsHSF7和阳性对照DBD-P53 + T-antigen的酵母菌株可以正常生长且x-α-Gal活性检测变蓝, 而转入DBD-CsHSF11和阴性对照DBD-EMPTY的酵母菌株不能正常生长(图 6), 说明CsHSF7在酵母细胞中具有转录激活活性, 而CsHSF11则不具有转录激活活性.
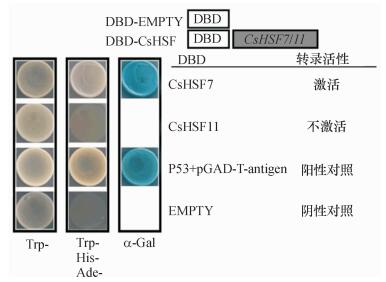
|
图 6 CsHSF7和CsHSF11在酵母细胞内的转录活性 Figure 6 Transcriptional activities of CsHSF7 and CsHSF11 in yeast cells |
目前, 控制果蔬采后冷害的方法主要有物理方法、化学方法和生物技术3大类.随着生活水平的提高, 人们希望能吃到天然、安全、营养的食品, 传统的热处理、低温贮藏方法以其安全、无污染等优点, 在果蔬保鲜应用上越来越受到重视.热处理可以减轻采后果实的冷害, 这已在枇杷[7]等果实上得到证实;冷锻炼处理减轻采后果实的冷害也已在葡萄柚[14]等果实上得到证实.本研究结果表明, 采用热处理(50 ℃1 min转移至8 ℃)和冷锻炼处理(15 ℃2 d转移至8 ℃), 可以减轻“沃林17号”黄瓜果实在8 ℃贮藏下采后冷害的影响, 并且热处理不影响果实的外观及品质, 为在生产中采用热处理及冷锻炼减轻果实冷害提供了可行的方法.
3.2 HSF参与果实耐冷性植物在各种各样的胁迫如盐胁迫、高温胁迫、干旱胁迫、低温胁迫、氧化胁迫下, 都会活化热激转录因子, 从而诱导热激蛋白的表达和积累[26-29].目前, 已从许多植物中分离出转录因子HSFs, 特别是在番茄、拟南芥和水稻等模式植物中的HSFs研究较多[30-33], 我们在对黄瓜基因组中的21个HSFs进行了系统进化分析的基础上, 检测了7个不同亚族的CsHSFs基因在低温下的表达特征, 结果显示CsHSF7和CsHSF11基因响应低温胁迫并与黄瓜果实耐冷性有关, 并分析了其转录激活活性, CsHSF7在酵母中具有转录激活活性, 而CsHSF11在酵母中不具有转录激活活性.为进一步分析HSFs基因调控黄瓜果实耐冷性机制如:HSFs是否通过与其他蛋白互作或直接与下游的功能基因的启动子结合而调控耐冷性等提供了基础.
| [1] |
王志坤, 秦智伟, 周秀艳. 黄瓜果实成熟衰老过程中几种物质的变化[J]. 中国蔬菜, 2010(12): 41-45. (  0) 0) |
| [2] |
胡位荣. 荔枝(Litchi chinensis Sonn. )果实冷害生理及冰温贮藏技术的研究[D]. 广州: 华南农业大学, 2003.
(  0) 0) |
| [3] |
王艳颖, 胡文忠, 刘程惠, 等. 低温贮藏引起果蔬冷害的研究进展[J]. 食品科技, 2010, 35(1): 72-75. (  0) 0) |
| [4] |
王平. 基于乙烯信号转导元件的采后枇杷果实冷害木质化机制研究[D]. 杭州: 浙江大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012313748.htm
(  0) 0) |
| [5] |
杨绍兰. 1-MCP处理对黄瓜冷藏期间保鲜效果的影响[J]. 中国农学通报, 2009, 25(6): 70-72. (  0) 0) |
| [6] |
MAO L, PANG H, WANG G, et al. Phospholipase D and lipoxygenase activity of cucumber fruit in response to chilling stress[J]. Postharvest Biol Tec, 2007, 44(1): 42-47. DOI:10.1016/j.postharvbio.2006.11.009 (  0) 0) |
| [7] |
吴光斌, 陈发河, 张其标, 等. 热激处理对冷藏枇杷果实冷害的生理作用[J]. 植物资源与环境学报, 2004, 13(2): 1-5. DOI:10.3969/j.issn.1674-7895.2004.02.001 (  0) 0) |
| [8] |
ZHANG X H, SHEN L, LI F J, et al. Arginase induction by heat treatment contributes to amelioration of chilling injury and activation of antioxidant enzymes in tomato fruit[J]. Postharvest Biol Tec, 2013, 79: 1-8. DOI:10.1016/j.postharvbio.2012.12.019 (  0) 0) |
| [9] |
CAO S F, HU Z C, ZHENG Y H, et al. Synergistic effect of heat treatment and salicylic acid on alleviating internal browning in cold-stored peach fruit[J]. Postharvest Biol Tec, 2010, 58(2): 93-97. DOI:10.1016/j.postharvbio.2010.05.010 (  0) 0) |
| [10] |
LAUXMANN M A, BORSANI J, OSORIO S, et al. Deciphering the metabolic pathways influencing heat and cold responses during post-harvest physiology of peach fruit[J]. Plant Cell Environ, 2014, 37(3): 601-616. DOI:10.1111/pce.2014.37.issue-3 (  0) 0) |
| [11] |
BASSAL M, EL-HAMAHMY M. Hot water dip and pre-conditioning treatments to reduce chilling injury and maintain postharvest quality of Navel and Valencia oranges during cold quarantine[J]. Postharvest Biol Tec, 2011, 60(3): 186-191. DOI:10.1016/j.postharvbio.2011.01.010 (  0) 0) |
| [12] |
王慧, 张艳梅, 王大鹏, 等. 热激处理对青椒耐冷性及抗氧化体系的影响[J]. 食品科学, 2013, 34(2): 312-316. (  0) 0) |
| [13] |
CAI C, XU C, SHAN L, et al. Low temperature conditioning reduces postharvest chilling injury in loquat fruit[J]. Postharvest Biol Tec, 2006, 41(3): 252-259. DOI:10.1016/j.postharvbio.2006.04.015 (  0) 0) |
| [14] |
MAUL P, MCCOLLUM G, GUY C L, et al. Temperature conditioning alters transcript abundance of genes related to chilling stress in 'Marsh' grapefruit flavedo[J]. Posthar-vest Biol Tec, 2011, 60(3): 177-185. DOI:10.1016/j.postharvbio.2010.06.007 (  0) 0) |
| [15] |
WOOLF A B, COX K A, WHITE A, et al. Low temperature conditioning treatments reduce external chilling injury of 'Hass' avocados[J]. Postharvest Biol Tec, 2003, 28(1): 113-122. DOI:10.1016/S0925-5214(02)00178-3 (  0) 0) |
| [16] |
JIN P, WANG K, SHANG H, et al. Low-temperature conditioning combined with methyl jasmonate treatment reduces chilling injury of peach fruit[J]. J Sci Food Agric, 2009, 89(10): 1690-1696. DOI:10.1002/jsfa.v89:10 (  0) 0) |
| [17] |
SHAN W, KUANG J F, LU W J, et al. A banana fruit NAC transcription factor MaNAC1 is a direct target of MaICE1 and involved in cold stress through interacting with MaCBF1[J]. Plant Cell Environ, 2014, 37(9): 2116-2127. DOI:10.1111/pce.2014.37.issue-9 (  0) 0) |
| [18] |
ZHAO M L, WANG J N, SHAN W, et al. Induction of jasmonate signalling regulators MaMYC2s and their physical interactions with MaICE1 in methyl jasmonate-induced chilling tolerance in banana fruit[J]. Plant Cell Environ, 2013, 36(1): 30-51. DOI:10.1111/pce.2013.36.issue-1 (  0) 0) |
| [19] |
ZHANG S, XU Z, LI P, et al. Overexpression of TaHSF3 in transgenic Arabidopsis enhances tolerance to extreme temperatures[J]. Plant Mol Biol Rep, 2013, 31(3): 688-697. DOI:10.1007/s11105-012-0546-z (  0) 0) |
| [20] |
LI H Y, CHANG C S, LU L S, et al. Over-expression of Arabidopsis thaliana heat shock factor gene (AtHsfA1b) enhances chilling tolerance in transgenic tomato[J]. Bot Bull Acad Sin, 2003, 44(2): 129-140. (  0) 0) |
| [21] |
VON KOSKULL-DORING P, SCHARF K D, NOVER L. The diversity of plant heat stress transcription factors[J]. Trends Plant Sci, 2007, 12(10): 452-457. DOI:10.1016/j.tplants.2007.08.014 (  0) 0) |
| [22] |
LIU J, SUN N, LIU M, et al. An autoregulatory loop controlling Arabidopsis HsfA2 expression: Role of heat shock-induced alternative splicing[J]. Plant Physiol, 2013, 162(1): 512-521. DOI:10.1104/pp.112.205864 (  0) 0) |
| [23] |
韩雅珊, 刘惠君. 食品化学实验指导[M]. 北京: 中国农业大学出版社, 1996, 75-77.
(  0) 0) |
| [24] |
WAN C Y, WILKINS T A. A modifed hot borate method signifcantly enhances the yield of high quality RNA from cotton (Gossypium hirsutum L.)[J]. Anal Biochem, 1994, 223(1): 7-12. (  0) 0) |
| [25] |
WAN H, ZHAO Z, QIAN C, et al. Selection of appropriate reference genes for gene expression studies by quantitative real-time polymerase chain reaction in cucumber[J]. Anal Biochem, 2010, 399(2): 257-261. (  0) 0) |
| [26] |
翁锦周, 洪月云. 植物热激转录因子在非生物逆境中的作用[J]. 分子植物育种, 2006, 4(1): 88-94. DOI:10.3969/j.issn.1672-416X.2006.01.016 (  0) 0) |
| [27] |
伊淑莹. 植物热激因子网络[J]. 生命的化学, 2008, 28(4): 383-387. DOI:10.3969/j.issn.1000-1336.2008.04.003 (  0) 0) |
| [28] |
MITTAL D, CHAKRABARTI S, SARKAR A, et al. Heat shock factor gene family in rice: Genomic organization and transcript expression profiling in response to high temperature, low temperature and oxidative stresses[J]. Plant Physiol Biochem, 2009, 47(9): 785-795. DOI:10.1016/j.plaphy.2009.05.003 (  0) 0) |
| [29] |
SCHARF K, BERBERICH T, EBERSBERGER I, et al. The plant heat stress transcription factor (Hsf) family: Structure, function and evolution[J]. BBA-Gene Regul Mech, 2012, 1819(2): 104-119. (  0) 0) |
| [30] |
王国栋, 孔凡英, 孟庆伟. 番茄热激转录因子研究进展[J]. 植物生理学报, 2013, 49(3): 217-224. (  0) 0) |
| [31] |
HÁBEL A, SCHÖFFL F. Arabidopsis heat shock factor: Isolation and characterization of the gene and the recombinant protein[J]. Plant Mol Biol, 1994, 26(1): 353-362. DOI:10.1007/BF00039545 (  0) 0) |
| [32] |
NOVER L, BHARTI K, DÖRING P, et al. Arabidopsis and the heat stress transcription factor world: How many heat stress transcription factors do we need?[J]. Cell Stress Chaperon, 2001, 6(3): 177-189. DOI:10.1379/1466-1268(2001)006<0177:AATHST>2.0.CO;2 (  0) 0) |
| [33] |
WU C. Heat shock transcription factors: Structure and regulation[J]. Ann Rev Cell Dev Biol, 1995, 11(1): 441-469. DOI:10.1146/annurev.cb.11.110195.002301 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36



