瓠瓜Lagenaria siceraria, 别名瓠子、蒲瓜, 为葫芦科(Cucurbitaceae)一年生攀缘草本植物, 原产于印度与热带非洲[1].瓠瓜在我国栽培种植历史悠久, 类型品种十分丰富, 主要分布于长江流域与长江以南地区.瓠瓜易栽培, 产量高, 嫩瓜柔软多汁, 风味可口, 老瓜供制容器与工艺品[2], 是华南地区度淡的重要蔬菜, 年种植面积6 666.7 hm2以上, 除满足本地市场外, 还销往港澳及冬季北运[3].目前对瓠瓜种质资源研究较少, 仅在种质遗传多样性分析[3-7]方面有一些报道.
随着蔬菜产业结构的调整, 瓠瓜的种植面积不断扩大.白粉病与病毒病是瓠瓜生产上的两大主要病害.病毒病复合侵染导致产量与品质急剧下降, 商业价值降低[8], 但目前生产上病毒病难以防治.白粉病在瓠瓜整个生育期均可侵染发生, 连作田块发病更盛[9], 几乎所有瓠瓜品种不抗白粉病, 药剂防治与栽培改良效果不佳.另有一些瓠瓜种质对西瓜枯萎病免疫, 可用作砧木嫁接栽培[10].因此挖掘新的抗性基因资源是研究病原物与寄主植物之间互作的分子机制、实施抗病分子设计育种的基础性工作, 也是病害控制最安全有效的途径[11-12].广东省农业科学院蔬菜研究所瓜类育种一室通过多年种质资源引进、收集和创新, 保存了丰富的瓠瓜资源, 并育成了一些优良品种, 因此利用我们的资源优势, 克隆分析与研究瓠瓜抗病基因, 对提高瓠瓜抗病性及阐明瓠瓜抗病分子机制具有重要意义.
抗病基因克隆是植物分子生物学研究领域的热点之一.迄今已分离克隆了70多个抗病基因[13], 但主要是通过遗传表型分析如转座子标签技术和以遗传图谱为基础的图位克隆技术获得的[14].这些R基因编码产物存在许多高度保守区域, 以此为基础将抗病基因分为8类[15], 其中核苷酸结合位点和富亮氨酸重复(Nucleotide binding site and leucine rich repeat, NBS-LRR)类抗病基因在基因组中含量最为丰富[16-17].抗病基因同源序列(Resistance gene analogs, RGAs)是一类呈簇分布于植物基因组中, 在一定程度上反映抗病基因特点的大基因家族[18], 它们本身可能为R基因或假基因一部分或与R基因紧密连锁, 扩增抗病同源序列已成为标记、定位和克隆植物R基因的有效手段[18-19].因此根据这些抗病基因的保守序列设计引物, PCR扩增同源序列, 成为克隆该类抗病基因的有效途径, 已在大豆、香蕉、白菜和黄瓜等多种作物中广泛应用[20-23].本研究以瓠瓜抗性材料“大籽瓠”为试材, 同源扩增NBS类抗病基因序列, 为进一步克隆瓠瓜的功能性抗病基因以及开发分子标记辅助育种提供研究基础, 对阐明瓠瓜抗病分子机制及培育抗病品种具有重要的指导意义.
1 材料与方法 1.1 植物材料瓠瓜抗性种质“大籽瓠”, 采自山西平遥, 由广东省农业科学院蔬菜研究所保存.2013年8月播种于温室营养盘内, 待幼苗长至2 ~ 3片真叶, 采集叶片保存于- 70 ℃冰箱备用.
1.2 主要试剂Ex Taq DNA聚合酶与pMD 19-T载体试剂盒为大连宝生物(TaKaRa公司)有限公司产品;琼脂糖、DNA回收试剂盒、Amp抗生素、dNTPs、DNA marker、大肠埃希菌DH5α感受态均为广州鼎国生物技术有限公司产品;其余试剂为国产分析纯.
1.3 瓠瓜基因组DNA提取与引物设计合成瓠瓜叶片基因组总DNA提取采用改良CTAB法[24], 质量浓度为10 g·L-1的琼脂糖凝胶电泳及纳米紫外分光光度计(GENEQUANT, Eppendorf, Germany)检测DNA浓度及纯度.参考斑茅、黄瓜、芒果及辣椒等[19, 25-27] NBS类抗病基因保守结构域, 设计合成简并引物.引物序列为NBS-F:5′-GGYATGGGNGGYMTHGGNAARAC-3′, NBS-R:5′-CCANACATCATCMAG SACAA-3′, 其中Y = C /T, N = A /G/C /T, R = A /G, M = A /C, S = C /G, H = A /T /C, 引物由广州英骏生物技术有限公司合成.
1.4 PCR扩增与克隆以提取的瓠瓜基因组总DNA为模板进行PCR扩增, PCR反应在ABI Applied公司GeneAmp system 9700型扩增仪上进行.反应体系总体积为25 μL, 包括:2.5 μL 10 × Ex buffer (含MgCl2)、1 U Ex Taq DNA聚合酶、0.2 mmol·L-1 dNTPs、0.4 μmol·L-1引物和50 ng模板DNA.反应程序为:94 ℃预变性3 min;94 ℃变性30 s, 50 ℃退火30 s, 72 ℃延伸30 s, 反应35个循环;最后72 ℃延伸10 min.PCR产物用质量浓度为10 g·L-1琼脂糖凝胶进行电泳, 检测结果在GeneGeniusBio Imaging System (Bio-Rad)凝胶成像系统下观察和拍照.
1.5 PCR产物的纯化、克隆与测序PCR产物回收纯化, 克隆至pMD19-T Vector, 转化至DH5α感受态细胞, 涂布在固体LB(含Amp 100 μg·mL-1)培养基上, 37 ℃条件下倒置培养过夜, 挑取白斑, 利用M13通用引物进行菌落PCR检测, 阳性克隆菌液送至广州英骏生物技术有限公司测序.
1.6 目的片段序列测定及序列同源性分析测得序列利用NCBI Vecscreen程序搜索并去除两端载体序列, 然后在GenBank中用BLASTX和BLASTN工具进行核苷酸序列和氨基酸序列间的同源比对搜索, 结合GenBank公布的其他物种NBS-LRR类抗病基因蛋白序列, 利用DNAstar软件进行多重序列比对, 分析各序列长度、G + C含量、变异位点、相似性、遗传分歧及序列比对;利用NCBI ORF finder程序进行开放阅读框搜索;最后用MegAlign构建系统发育树研究其进化关系.用于参比的R基因有:番茄Solanum lycopersicum Mi-1.1(AF039681)、烟草Nicotiana tabacum N(BAD12594)、亚麻Linum usitatissimum M(U73916)、拟南芥Arabidopsis thaliana RPS2 (U14158)、甜瓜Cucumis melo FOM- 2 (AY583855)、番茄I2C-1 (AF004878)、亚麻L11 (AF093641), 其中Mi-1.1、RPS2、FOM-2和I2C-1属于non-TIR-NBS-LRR类的抗病基因, 而N、M与L11属于TIR-NBS-LRR类抗病基因[28-29].
2 结果与分析 2.1 瓠瓜NBS类RGAs的克隆与鉴定利用NBS-F1 /R1简并引物扩增瓠瓜基因组DNA, 获得250 bp左右的明亮特异条带(图 1), 回收产物克隆至T载体, 挑取25个阳性克隆进行测序, 去除空载体序列与合并相同序列, 获得23个特异片段, 命名为HNB1 ~ HNB23, GenBank登录号为KJ908192 ~ KJ908214.测序结果表明, 这些片段序列长度在242 ~ 261 nt之间;NCBI blastp同源比对分析发现, 这23条RGAs与其他植物R基因均具有较高相似性.氨基酸序列推导发现, 23条序列均包含NBS类R基因特有的保守结构域, 因此推测均为瓠瓜RGAs.ORFfinder分析发现, 除HNB1、HNB7、HNB20、HNB22和HNB23存在移码突变外, 其他18个序列均具备连续ORF.MegAlign程序同源比对发现, 这23条RGAs核苷酸序列相似性在41.5% ~ 98.8%之间, 遗传分歧为1.2 ~ 109.1, 存在1 020个变异位点, 在130 ~ 210 nt区间变异最为丰富;其中HNB14与HNB5、HNB15与HNB5、HNB14与HNB15、HNB14与HNB19相似性最高, 为98.8%, HNB10与HNB11相似性最低, 为41.5%, 由此可见各序列间相似性变化较大, 说明瓠瓜RGAs存在丰富的变异位点, 可能分属于瓠瓜中不同抗病基因或具有NBS结构域的不同基因(具体结果未列出).
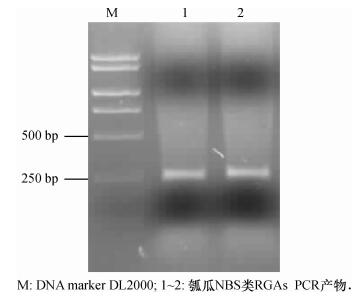
|
图 1 瓠瓜NBS类RGAs PCR产物电泳分析 Figure 1 Electrophoreses analyses of PCR products of NBS RGAs from bottle gourd |
利用MegAlign程序对23条RGAs推导的氨基酸序列进行比对, 发现氨基酸序列相似性为21.5% ~ 100.0%, 遗传分歧为0 ~ 223, 其中HNB7与HNB9氨基酸相似性最低, 为21.5%, HNB2与HNB4、HNB2与HNB5、HNB2与HNB14、HNB2与HNB15等14对基因片段氨基酸序列相似性为100.0%.经氨基酸序列聚类分析, 将23条RGAs分为4组, 其中HNB16、HNB20与其他片段遗传距离最远, 为第1组, 分为2个亚组, HNB16与HNB20单独为一亚组;HNB8、HNB9和HNB11组成第2组, HNB10、HNB17和HNB13组成第3组, 剩余RGAs形成第4组, 包括3个亚组(图 2).由此看出, 瓠瓜NBS类RGAs在进化过程中表现出较大的遗传差异和多样性.
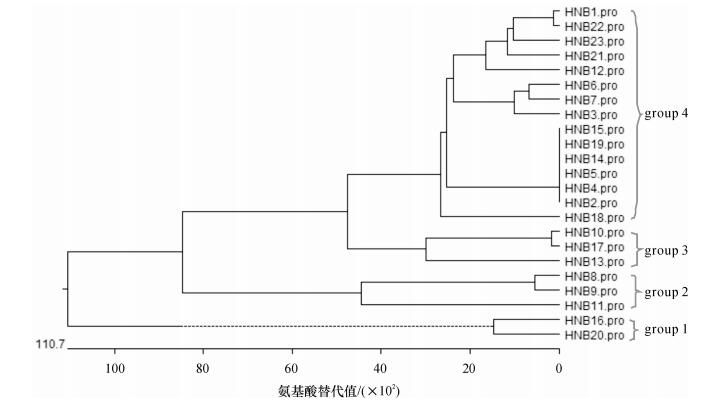
|
图 2 瓠瓜NBS类RGAs编码氨基酸序列的聚类分析 Figure 2 Clustering analyses of amino acid sequences encodcd by NBS type RGAs in bottle gourd |
前人研究报道NBS类R基因P-loop结构域为GMGGI /LGKTT, Kinase-2区域为(L/F) (L/V) VLD (D /N)(V /M) W[30].23条RGAs序列同源比对结果表明, 瓠瓜中NBS类RGAs结构域相当保守, 除HNB7不包含Kinase-2结构外, 其他序列均存在典型的P-loop (GMGGI /LGKTT)、Kinase-2 (L/FLVLDDVW)功能域(图 3), 少数序列保守结构域中发生单个氨基酸突变, HNB9 P-loop功能域GMGGIGKTT变为GMGGIRRGKTM, HNB23则变为GTGGLGKTT, 基本骨架未改变.上述分析表明, 本试验获得的23条序列(HNB1 ~ HNB23)为潜在候选R基因片段.另外, 前人研究报道, TIR-NBS-LRR类抗病基因Kinase- 2共有序列可总结为(V /L/I) (L/I /V) (L/I / V) V (L/I /V) DD(V /I) X, 最后一个氨基酸为任意氨基酸, 通常为色氨酸(D), 而non-TIR-NBS-LRR的Kinase-2共有序列为(Y /V) (L/V) (L/I /V) V(L/V) DD(I /V)W, 最后一个氨基酸为天冬氨酸(W) [18].由此可以看出, 瓠瓜所有RGAs序列Kinase-2基序最后一个氨基酸均为W, 所以属于non-TIR-NBS-LRR类.

|
图 3 瓠瓜NBS类RGAs编码氨基酸序列比对 Figure 3 Amino acid sequence alignments of NBS type resistance RGAs in bottle gourd “-”用于优化联配的缺口;下划线标注为NBS R基因保守功能域“ P-loop”与“ Kinase-2”. |
通过NCBI Blastp程序对瓠瓜各RGAs进行同源搜索, 发现所有RGAs氨基酸序列均含有AAA超级家族功能域, 20条序列表现NB-ARC保守结构域特征, 与其他物种相似性在40% ~ 100%之间, 其中HNB1、HNB16、HNB22和HNB23与葫芦Lagenaria siceraria RGA(AEV46102)相似性高达99% ~ 100%, HNB4、HNB5、HNB14、HNB15及HNB19与丝瓜Luffa aegyptiaca RGA(AFC97124)相似性高达96%, HNB18与黄瓜Cucumis sativus RGA(XP_0 04161606)相似性高达97%, HNB11与西瓜Citrullus lanatus RGA(AEV46173)相似性高达90%, HNB3与冬瓜Benincasa hispida RGA (AHB60507)相似性高达84%, 而HNB8、HNB9则与印度芒果Mangifera indica RGA(AEH49854)相似性最高仅为48% ~ 49%, 说明克隆的瓠瓜RGAs可能是相关抗病基因的一部分或与抗病基因属于同一个基因家族.其他抗病基因的物种名称和GenBank登录号以及构建的系统发育进化树见图 4.所有抗病同源序列分为5个组, 瓠瓜RGAs全部聚集在第5组中, 包括23条瓠瓜RGAs和38条其他植物RGAs, 又被分为7个亚组, 瓠瓜RGAs主要分布于第7亚组中;第4组包括L11、M和Pyrus × bretschneideri (ACN76569), Nicotiana tabacum(ACF22039)和Humulus lupulus(ABS70863)分别组成第3组和第2组, 第1组仅包括N(BAD12594), 与其他RGAs遗传距离最远(图 4).
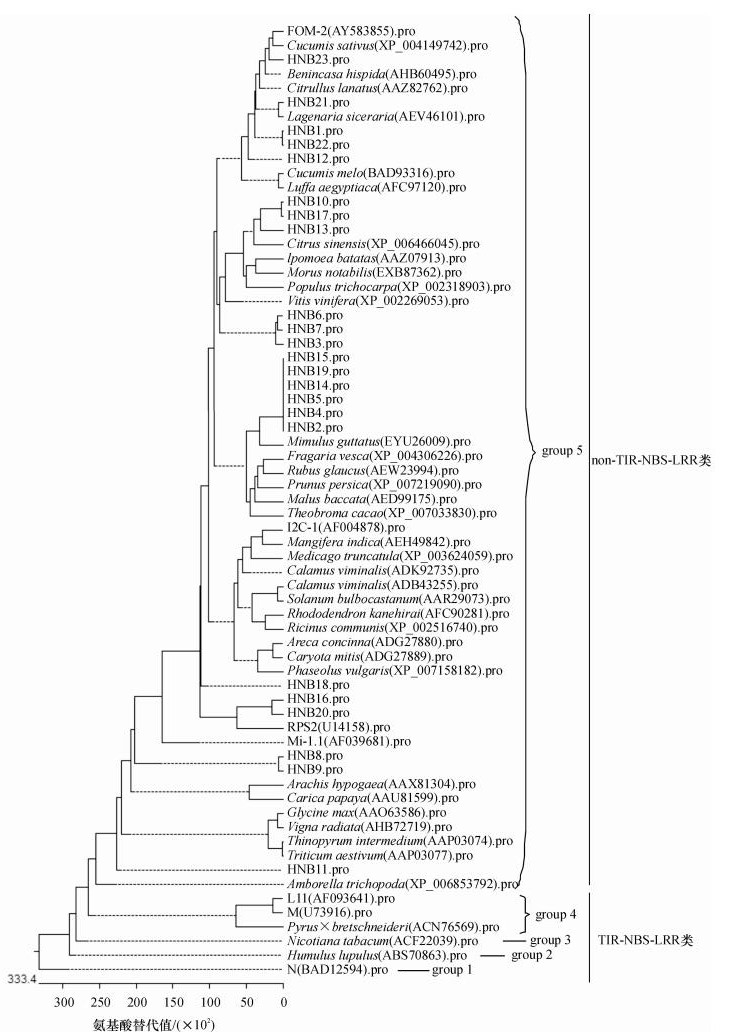
|
图 4 瓠瓜与其他植物NBS类RGAs编码氨基酸序列聚类分析 Figure 4 Clustering analyses of amino acid sequences encoded by NBS type RGAs in known other plants and bottle gourd |
对瓠瓜NBS类RGAs进行同源进化分析, non-TIR-NBS-LRR类基因FOM-2、Mi-1.1、RPS2、I2C-1编码氨基酸序列与所有瓠瓜RGAs聚集在第5组内, 而TIR-NBS-LRR类基因L11、M与N编码氨基酸序列和Pyrus × bretschneideri (ACN76569)、Nicotiana tabacum (ACF22039)、Humulus lupulus(ABS70863)则分布在第5组之外的其他组, 形成TIR-NBS-LRR类(图 4).同源进化分析结果与前面的推导氨基酸序列多重比较结果是一致的.
3 讨论植物抗病性一直是国内外研究热点, 挖掘和利用抗病基因对提高植物抗病性、阐明抗性机制及培育抗性品种具有重要意义.瓠瓜经济价值巨大, 抗性资源丰富, 具有许多极有价值的研究R基因的材料, 但其全基因组较大, 且尚未完成全基因组测序, 可开发利用的相关分子标记也较少, 因而通过经典的图位克隆或转座子标签技术获得R基因难度很大.利用已报道的植物R基因保守结构域, 设计特异简并引物分离RGAs, 成为克隆R基因的有效途径之一.利用RGAs方法克隆NBS-LRR类基因已在辣椒、甜瓜等多种蔬菜中广泛应用[27, 31].本研究根据已知NBS类R基因保守结构设计简并引物, 从瓠瓜中分离了23条抗病同源序列, 其中18条序列具有开放阅读框, 5条序列存在移码突变, 说明从植物中分离NBS类同源基因具有很大的随机性;这些序列与已克隆的黄瓜、冬瓜、丝瓜及葫芦R基因蛋白有较高的相似性, 表明这些序列属于RGAs序列, 其中的18条序列可能为功能性R基因, 另外也表明瓠瓜与黄瓜、丝瓜及葫芦等作物的近缘关系.
研究表明, 点突变、重组、不等交换和基因转变是R基因进化的主要动力[32].NBS类基因以基因簇多拷贝形式与其他R基因序列排列在染色体上, 使得基因内和基因间错配、重组、重复的频率大大提高, 促进无义基因与新R基因的产生[33-34].瓠瓜23条RGAs核苷酸序列相似性在41.5% ~ 98.8%之间, 存在1 020个变异位点, 在130 ~ 210 nt区间变异幅度较高, 说明瓠瓜NBS类基因存在一个较大的基因家族, 这些基因可能是来自同一基因的不同拷贝, 且基因变异程度较高.瓠瓜RGAs氨基酸序列多重比对与系统进化树分析一致, 认为所有序列均属于non-TIR-NBS-LRR类, 进一步支持了前人的研究结论[18].瓠瓜RGAs保守结构域也存在突变, 但未影响到整个保守域性质;保守域外的氨基酸序列变异程度较大, 序列整体的相似性变化范围较广(21.5% ~ 100.0%), 与其他物种相似性在40% ~ 100%之间.这些点突变、插入和缺失可能是引起瓠瓜RGAs多样性的原因.上述研究结果为进化趋异假说提供了间接证据.
NBS结构域是最重要的抗病基因保守结构域之一, 但具有NBS结构域的基因不一定就是抗病基因[19], 还需其他可能与抗病更直接相关的重要结构域如TIR(Toll or interluken-1 receptor)、LRR(Leucine rich repeats)或LZ(Leucine zipper)等[35].因此, 本研究分离得到的18条NBS类RGAs, 仅作为具有潜在功能的抗病基因片段, 分离鉴定真正具有抗病功能的基因还需更深入的研究.
利用基于同源候选基因的克隆策略分离R基因是一种简便快捷并且有效的手段, 但也具有自身局限性, 如分离基因具有很大随机性, 获得片段有的不具连续ORF, 有的含有保守结构域, 但与植物抗性无关, 病原菌诱导不能表达等.因此可通过用不同碱基组合简并引物扩增, 或从不同部位、时期cDNA分离RGAs, 可提高获得不同R序列机会.本研究以“大籽瓠”为试材, 同源扩增NBS类抗病基因同源序列, 为进一步克隆瓠瓜的功能性抗病基因以及分子标记辅助选择育种奠定基础, 也为研究瓠瓜R基因的起源和遗传进化提供借鉴.
| [1] |
HEISER C B. Variation in the bottle gourd[M] //MEGGERS B J, AYENSU E S, DUCKWORTH W D. Tropical forest ecosystems in Africa and South America: A comparative review. Washington D C: Smithsonian Institution Press, 1973: 121-128.
(  0) 0) |
| [2] |
彭庆务, 何晓明, 谢大森, 等. 瓠瓜的特征特性及育种对策[J]. 广东农业科学, 2003, 30(1): 18-19. DOI:10.3969/j.issn.1004-874X.2003.01.007 (  0) 0) |
| [3] |
陈孟强, 牛玉, 林鉴荣, 等. 瓠瓜部分种质资源主要性状的初步评价[J]. 广东农业科学, 2012, 39(23): 22-24. DOI:10.3969/j.issn.1004-874X.2012.23.008 (  0) 0) |
| [4] |
李开银, 石伟平, 胡宇舟, 等. 湖北部分瓠瓜种质资源初步研究及利用[J]. 中国蔬菜, 2003(3): 33-34. DOI:10.3969/j.issn.1000-6346.2003.03.015 (  0) 0) |
| [5] |
高山, 许端祥, 林碧英, 等. 38份瓠瓜种质资源遗传多样性的ISSR分析[J]. 植物遗传资源学报, 2007, 8(4): 396-400. DOI:10.3969/j.issn.1672-1810.2007.04.004 (  0) 0) |
| [6] |
高山, 许端祥, 林碧英, 等. 瓠瓜种质资源遗传多样性的RAPD分析[J]. 分子植物育种, 2007, 5(4): 502-506. DOI:10.3969/j.issn.1672-416X.2007.04.010 (  0) 0) |
| [7] |
周先治, 陈阳, 陈最, 等. 基于5.8S rDNA和ITS序列探讨亚洲瓠瓜的地理分化[J]. 中国蔬菜, 2011(6): 49-53. (  0) 0) |
| [8] |
谷昊, 陈绍宁, 竺锡武, 等. 复合侵染瓠瓜的两种病毒的互作研究[J]. 科技通报, 2009, 25(4): 419-422. DOI:10.3969/j.issn.1001-7119.2009.04.007 (  0) 0) |
| [9] |
王玲平, 吴晓花, 汪宝根, 等. 与瓠瓜品系J083白粉病抗性基因连锁的SCAR分子标记[J]. 浙江大学学报:农业与生命科学版, 2011, 37(2): 119-124. (  0) 0) |
| [10] |
肖光辉. 瓠瓜DNA直接导入西瓜抗枯萎病育种研究进展[J]. 中国西瓜甜瓜, 2002(2): 41-44. DOI:10.3969/j.issn.1673-2871.2002.02.021 (  0) 0) |
| [11] |
阙友雄, 许莉萍, 林剑伟, 等. 斑茅NBS-LRR类抗病基因同源序列的克隆与分析[J]. 热带作物学报, 2009, 30(2): 192-197. DOI:10.3969/j.issn.1000-2561.2009.02.015 (  0) 0) |
| [12] |
KANAZIN V, MAREK L F, SHOEMAKER R C. Resistance gene analogs are conserved and clustered in soybean[J]. PNAS, 1996, 93(21): 11746-11750. DOI:10.1073/pnas.93.21.11746 (  0) 0) |
| [13] |
李峰, 张颖, 樊秀彩, 等. 植物NBS-LRR类抗病基因的研究进展[J]. 分子植物育种, 2011, 9(108): 1784-1780. (  0) 0) |
| [14] |
贺超英, 张志永, 陈受宜. 大豆中NBS类抗病基因同源序列的分离与鉴定[J]. 科学通报, 2001, 46(12): 1017-1021. DOI:10.3321/j.issn:0023-074X.2001.12.013 (  0) 0) |
| [15] |
GURURANI M A, VENKATESH J, UPADHYAYA C P, et al. Plant disease resistance genes: Current status and future directions[J]. Physiol Mol Plant Pathol, 2012, 78: 51-65. DOI:10.1016/j.pmpp.2012.01.002 (  0) 0) |
| [16] |
SHI A, KANTARTZI S K, MMBAGA M, et al. Isolation of resistance gene analogues from flowering dogwood (Cornus f lorida L.)[J]. J Phytopathol, 2008, 156(11/12): 742-746. (  0) 0) |
| [17] |
XU Q, WEN X, DENG X. Isolation of TIR and nonTIR NBS-LRR resistance gene analogues and identification of molecular markers linked to a powdery mildew resistance locus in chestnut rose (Rosa roxburghii Tratt)[J]. Theor Appl Genet, 2005, 111(5): 819-830. DOI:10.1007/s00122-005-0002-7 (  0) 0) |
| [18] |
MEYERS B C, DICKERMAN A W, MICHELMORE R W, et al. Plant disease resistance genes encode members of an ancient and diverse protein family within the nucleotide binding superfamily[J]. Plant J, 1999, 20(3): 317-332. DOI:10.1046/j.1365-313X.1999.t01-1-00606.x (  0) 0) |
| [19] |
阙友雄, 许莉萍, 林剑伟, 等. 甘蔗NBS-LRR类抗病基因同源序列的分离与鉴定[J]. 作物学报, 2009, 35(4): 631-639. (  0) 0) |
| [20] |
丁国华, 池春玉, 周秀艳, 等. 黄瓜抗病基因类似序列(RGA)的同源性分析和Southern鉴定[J]. 园艺学报, 2007, 34(2): 355-360. DOI:10.3321/j.issn:0513-353X.2007.02.017 (  0) 0) |
| [21] |
SUN D Q, HU Y L, ZHANG L B, et al. Cloning and analysis of fusarium wilt resistance gene analogs in " Goldfinger"banana[J]. Mol Plant Breed, 2009, 7(6): 1215-1222. (  0) 0) |
| [22] |
王彦华, 侯喜林, 申书兴, 等. 不结球白菜抗病基因同源序列的克隆及分析[J]. 中国农业科学, 2006, 39(12): 2621-2626. DOI:10.3321/j.issn:0578-1752.2006.12.032 (  0) 0) |
| [23] |
丁海, 宛煜嵩, 朱美霞, 等. 大豆抗病基因同源序列的克隆与分析[J]. 分子植物育种, 2003, 1(2): 217-223. DOI:10.3969/j.issn.1672-416X.2003.02.009 (  0) 0) |
| [24] |
DOYLE J J, DOYLE J L. A rapid DNA isolation procedure for small quantities of fresh leaf material[J]. Phytochem Bull, 1987, 19(1): 11-15. (  0) 0) |
| [25] |
丁国华, 秦智伟, 刘宏宇, 等. 黄瓜NBS类型抗病基因同源序列的克隆与分析[J]. 园艺学报, 2005, 32(4): 638-642. DOI:10.3321/j.issn:0513-353X.2005.04.014 (  0) 0) |
| [26] |
刘洋, 姚全胜, 苏俊波, 等. 芒果NBS类抗病基因同源序列克隆与分析[J]. 植物遗传资源学报, 2013, 14(3): 571-576. (  0) 0) |
| [27] |
王铎, 刘长远, 赵奎华, 等. 辣椒NBS-LRR类抗病基因同源序列的克隆与分析[J]. 沈阳农业大学学报, 2011, 2(42): 98-101. (  0) 0) |
| [28] |
高丽华, 周以飞, 郑伟文, 等. 南瓜NBS类抗病基因同源序列的克隆与分析[J]. 长江蔬菜, 2007(8): 40-43. DOI:10.3865/j.issn.1001-3547.2007.08.029 (  0) 0) |
| [29] |
陈玲, 张颢, 邱显钦, 等. 云南悬钩子蔷薇NBS-LRR类抗病基因同源克隆与分析[J]. 植物分类与资源学报, 2012, 34(1): 56-62. (  0) 0) |
| [30] |
QILIN P, JONATHAN W, KOBERT F. Divergent evolution of plant NBS-LRR resistance gene homologous in dicot and cereal genomes[J]. J Mol Evol, 2000, 50: 203-213. DOI:10.1007/s002399910023 (  0) 0) |
| [31] |
王贤磊, 高兴旺, 张铁钢, 等. 甜瓜抗病基因同源序列的克隆与分析[J]. 新疆大学学报:自然科学版, 2011, 28(2): 136-144. (  0) 0) |
| [32] |
ELLIS J, DODDS P, PRYORT. Structure, function and evolution of plant disease resistance genes[J]. Current Opinion in Plant Biology, 2000, 3(4): 278-284. DOI:10.1016/S1369-5266(00)00080-7 (  0) 0) |
| [33] |
BELKHADIR Y R, SUBR A M, DANGL L J. Plant disease resistance protein signaling: NBS-LRR protein and their partners[J]. Curr Opin Plant Biol, 2004, 7(4): 391-399. DOI:10.1016/j.pbi.2004.05.009 (  0) 0) |
| [34] |
GOFF S A, RICKE D, LAN T H, et al. A draft sequence of the rice genome (Oryza sativa L. ssp. Japonica)[J]. Science, 2002, 296(5565): 92-100. DOI:10.1126/science.1068275 (  0) 0) |
| [35] |
TRAUL F W. The functions and consensus motifs of nine types of peptide segments that form different types of nucleotide binding sites[J]. Eur J Biochem, 1994, 222(1): 9-19. DOI:10.1111/ejb.1994.222.issue-1 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36

