磷是植物生长发育必需的矿质元素之一,虽然土壤中含有大量磷,但95%以上为无效磷,植物对其利用率很低[1-2].为了满足植物对磷的需求,高水溶性磷肥在生产中被大量使用[3-4],但是磷肥在土壤中易形成难溶性的磷酸盐,被土壤中Ca2+、Fe3+、Al3+等离子迅速吸附固定,使得当季利用率仅为5% ~ 25% [5].由此,如何提高土壤磷元素的利用率,将难溶性无机磷向可溶性磷的转化成为研究热点之一.植物根际中存在着解磷微生物(Phosphate solubilizing microorganisms),能将植物难以吸收的磷元素转化为可利用的状态[6].其中,对荧光假单胞菌Pseudomonas f luorescens [7-8]研究较为广泛,绿针假单胞菌P.chlororaphis [9]、橘黄假单胞菌P.aurantiaca[10]、恶臭假单胞菌P.putida[11]等亦有报道,这些解磷菌对黄瓜、番茄、葡萄、玉米、小麦、核桃等有较好的促生作用.温哥华假单胞菌P.vancouverensis PAN4是在四川核桃主产区根际土中分离到的1株细菌[12],目前关于该菌的解磷能力及对核桃促生作用的研究鲜见报道.
核桃Juglans sigllata属于胡桃科植物,是世界四大干果之一,也是我国传统的重要外销商品,居四川省各类干果经济林的首位[13].但由于核桃植株的生长对磷元素需求量很大[14],目前主要以施用化学肥料为主,对林地生态环境造成严重污染.本文以P.vancouverensis PAN4为对象,在测定解磷能力基础上,研究其对核桃幼苗生长、光合生理特性、植株养分吸收及土壤养分含量的影响,以探讨该菌株对核桃植株的促生效应机理,同时为开发微生物肥料、推广绿色无公害核桃的栽植提供技术参考.
1 材料与方法 1.1 供试材料供试菌种:温哥华假单胞菌PAN4,分离于四川省核桃主产区根际土,由四川农业大学森林保护重点实验室提供.
供试植株:2年生铁核桃实生苗,由四川省雅安市石棉县核桃育种基地提供.
供试土壤:采自四川省雅安市大兴镇大兴寺核桃种植区,采样深度为0 ~ 100 cm,紫色土.土壤理化性质为:pH7.1,有机质、全氮、全磷和全钾质量分数分别为24.3、1.2、1.8和8.4 g·kg-1,速效磷、速效钾和碱解氮质量分数分别为25.32、35.36和31.56 mg·kg-1.样土混合均匀后装袋,样土5 kg·袋-1,共计100袋.其中50袋于121 ℃灭菌30 min即灭菌土,剩余的50袋不作任何处理即非灭菌土.
蒙金娜培养基(Pikovskaya,PVK) [15]:葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4 ·4H2O 0.03 g,MnSO4 ·7H2O 0.03 g,Ca3(PO4)210 g,蒸馏水1 000 mL,pH7.0;LB培养基[15]:蛋白胨10 g,NaCl 10 g,酵母提取物5 g,蒸馏水1 000 mL,pH7.0,加入琼脂15 g成为固体培养基.以上培养基均于121 ℃灭菌30 min.
1.2 种子液制备一级种子:取温哥华假单胞菌PAN4斜面种子在LB培养基平板上划线,28 ℃条件下培养14 h,出现游离单菌落,即一级种子;二级种子液:取一级种子的单菌落,接种于具50 mL LB液体培养基的250 mL摇瓶中,28 ℃、200 r·min-1条件下培养12 h,D600 nm达到2.0,即为二级种子液[16].
1.3 菌株解磷能力及菌体生长量测定在150 mL的摇瓶中装入PVK培养液30 mL,调整pH为7.0,灭菌后接种二级种子液1 mL,28 ℃、200 r·min-1条件下培养24 h.每隔8 h检测菌体生长量(D600 nm)并用钼蓝比色法[17]计算有效磷含量(发酵液于4 ℃条件下10 000 r·min-1离心15 min,取上清液测定),到80 h终止.以上处理均重复3次,以灭活菌为对照(CK).
1.4 不同条件对菌株解磷能力的影响 1.4.1 碳源对解磷能力的影响选择麦芽糖、葡萄糖、蔗糖、可溶性淀粉4种含碳量高的常见碳源,等量代替PVK培养基中碳源,28 ℃、200 r·min-1条件下培养48 h,测定发酵液有效磷含量,每个处理3个重复.
1.4.2 氮源对解磷能力的影响选择玉米浆、NH4NO3、NH4Cl、(NH4)2SO4、酵母膏、牛肉膏6种含氮量高的常见氮源,等量代替PVK培养基中氮源,28 ℃、200 r·min-1条件下培养48 h,测定发酵液有效磷含量,每个处理3个重复.
1.4.3 初始pH对解磷能力的影响利用浓度均为0.1 mol·L-1的NaOH或HCl调节PVK液体培养基pH为5.0 ~ 8.5,以0.5为1个梯度,28 ℃、200 r·min-1条件下培养48 h,测定发酵液有效磷含量,每个处理3个重复.
1.4.4 温度对解磷能力的影响在150 mL的摇瓶中装入PVK液体培养基,分别在温度为20、22、24、36、28、30、32和34 ℃,200 r·min-1条件下培养48 h,测定发酵液有效磷含量,每个处理3个重复.
1.5 菌株对核桃实生苗的促生作用 1.5.1 菌剂制备及接种菌剂制备:将一级种子接种于LB液体培养基,在15 L的JSA发酵罐(上海保兴设备工程有限公司)发酵48 h后,测定菌种悬浮液D600 nm.通过调整菌悬液的D600 nm [9],使菌剂的含菌量为102 ~ 109 cfu·mL-1.
盆栽试验采取完全随机选择核桃苗,核桃苗盆栽前用10 μg·mL-1多菌灵溶液完全淹没后,浸泡24 h,共设20个处理,分为2个区进行对比试验.分别是:菌剂1 × 102、1 × 103、1 × 104、1 × 105、1 × 106、1 × 107、1 × 108和1 × 109 cfu·mL-1,以及复合肥[18] (硫酸钾型,云南顺丰生物科技肥业开发有限公司产品,按m(P2O5): m(N) : m(K2O) = 2: 3 : 2施入复合肥,每千克土施肥3 g]、无菌水;2个区分别是灭菌土区和非灭菌土区;每处理5个重复.
接种方法:当核桃苗栽植成活后,在其根际周围用无菌注射器注射菌剂或无菌水50 mL,每隔7 d接种1次,连续接种3次.
1.5.2 生理指标测定在接种前和3次接种后,选择天气晴朗阳光充足的上午对核桃苗进行测定.生长效应:测定植株高度和地径[7].光合特性:选择植株中部复叶的顶生叶片,采用Li-cor 6400(美国)便携式光合测定仪测定净光合速率(Pn)和蒸腾速率(Tr),每片叶测定10次,取平均值.叶绿素含量测定:参照王斌[19]的方法.以上指标按下式计算增长率:
增长率= (接种后-接种前) /接种前× 100%.
1.6 数据分析试验数据采用Excel和SPSS19.0软件分析处理,LSD法做多重比较.
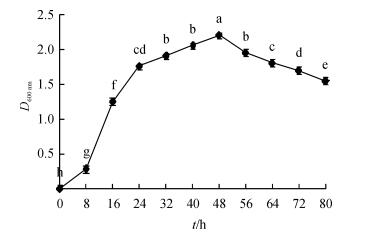
2 结果与分析 2.1 温哥华假单胞菌解磷能力变化在0 ~ 80 h检测期内,温哥华假单胞菌菌株PAN4上清液的有效磷含量呈先增加后下降趋势,且显著高于对照,而对照有效磷含量低且变化很小(图 1).0 ~ 48 h内随培养时间延长,PAN4上清液有效磷含量显著增加,并于48 h时达到峰值,之后缓慢下降,说明该菌株在培养的前48 h内解磷能力较好.另外,0 ~ 48 h温哥华假单胞菌PAN4上清液中其生长量不断增加(图 2),其解磷能力逐渐增强,在菌体数量达到最大值的48 h时,解磷能力也达到了最大值.温哥华假单胞菌PAN4上清液有效磷含量和菌体量均在48 h达到最大值,表明菌体的解磷能力与其生长状况一致.将菌体生长量和解磷能力做相关性分析,结果也表明两者之间极显著正相关(相关系数r = 0.9815,P<0.01).

|
图 1 温哥华假单胞菌菌株PAN4解磷能力动态变化 Figure 1 Dynamic changes of the phosphate-solubilizing ability of Pseudomonas vancouverensis strain PAN4 图中同一曲线的不同时间上,凡具有一个相同小写字母者,表示差异不显著(LSD法,P>0.05). |
|
图 2 温哥华假单胞菌菌株PAN4生长量动态变化 Figure 2 Dynamic changes of the bacterial growth mass of Pseudomonas vancouverensis strain PAN4 图中不同时间上,凡具有一个相同小写字母者,表示差异不显著(LSD法,P>0.05). |
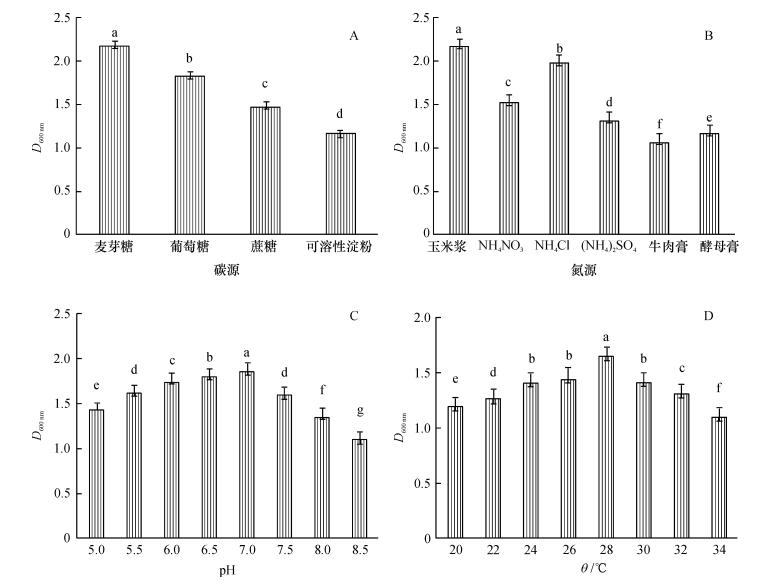
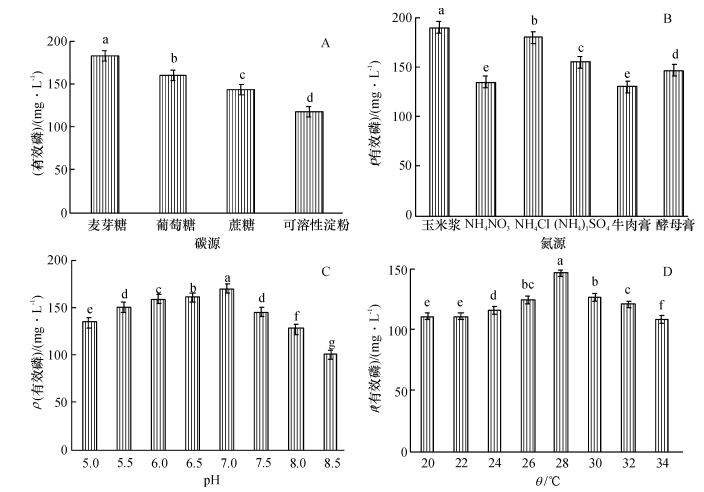
图 3A、图 4A显示,不同碳源对菌株PAN4生长量和解磷能力影响不同.用麦芽糖作为碳源时,菌体数量显著高于其他3种物质,说明菌株PAN4能很好地利用麦芽糖,这可能跟麦芽糖所含的微量营养素更适宜菌株生长有关.另外,以麦芽糖作为碳源,菌株PAN4的解磷能力也最强.
|
图 3 不同条件对温哥华假单胞菌菌株PAN4生长量的影响 Figure 3 Effects of the bacterial mass growth of Pseudomonas vancouverensis strain PAN4 under different conditions 各图中,柱子上方凡具有一个相同小写字母者,表示差异不显著(LSD法,P>0.05). |
|
图 4 不同条件对温哥华假单胞菌菌株PAN4解磷能力的影响 Figure 4 Effects of the phosphate-solubilizing ability of Pseudomonas vancouverensis strain PAN4 under different conditions 各图中,柱子上方凡具有一个相同小写字母者,表示差异不显著(LSD法,P>0.05). |
氮源对菌株生长量和解磷能力影响的试验结果(图 3B、图 4B)显示,以玉米浆作为氮源时,菌株生长繁殖最好,可以获得比较高的菌体数量,玉米浆中含有丰富的可溶性蛋白、生长素和一些前体物质,成分主要有氮、葡萄糖、乳糖、铁、磷、钙、钾、锌等,这些营养物质能够很好地促进菌株生长.另外,玉米浆作为氮源时,菌株解磷能力也是最强的,因此最适氮源为玉米浆.
2.2.3 初始pH当初始pH为5.0时,菌株可以进行生长,也有一定的解磷效果,但是当初始pH超过7时,液体培养基内的菌体数量和解磷能力都随着初始pH增大而减小(图 3C、图 4C).可见中性环境更有利于菌株生长、繁殖和解磷能力的发挥.
2.2.4 温度在20 ℃的相对低温和34 ℃的相对高温环境下,培养基中的菌体数量和解磷能力均比较低(图 3D、图 4D),28 ℃时二者均达到最大值,且与其他处理存在显著差异.
另外,4个条件下菌体生长量和解磷能力的相关系数分别为0.944 8(碳源)、0.892 1(氮源)、0.931 0 (初始pH)、0.957 2(温度),均达到显著(P<0.05)正相关或极显著(P<0.01)正相关,同样证明了菌体的解磷能力与其生长状况的一致性.
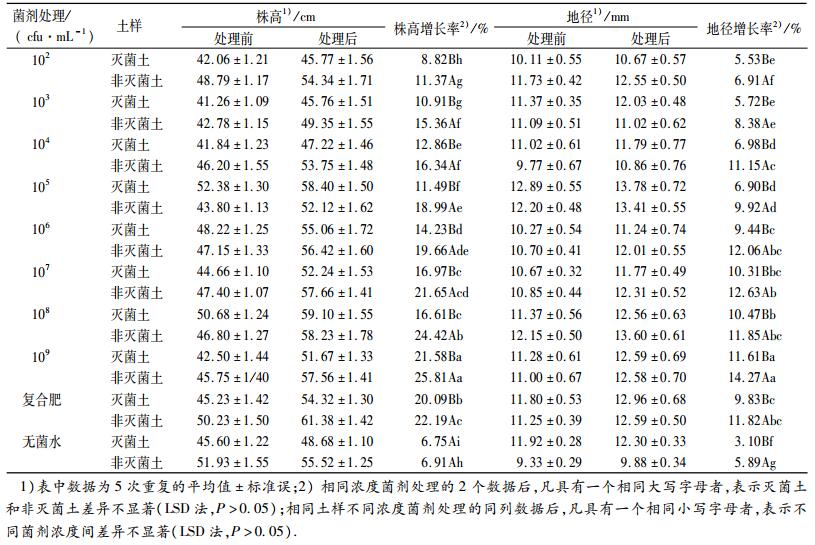
2.3 温哥华假单胞菌对核桃苗的促生效应 2.3.1 不同处理对核桃苗株高和地径的影响结果(表 1)显示,不同处理均可以促进核桃苗植株株高和地径增加,但接种菌剂与无菌水、复合肥对核桃苗株高和地径的影响差异显著.从菌体数量上看,随着菌剂浓度增加,核桃苗株高和地径增幅增大,最大增长率分别为25.81%和14.27% (109 cfu·mL-1),显著高于其他浓度处理.施肥和接种菌剂都能够增加核桃植株的株高和地径,但复合肥较菌剂来说,其增长率仅高于106或107 cfu·mL-1及以下,低于109 cfu·mL-1甚至108和107 cfu·mL-1,说明高浓度的菌剂更有利于核桃苗的生长.从土壤处理方式上看,土壤灭菌与否在菌剂对核桃苗株高和地径的影响中存在差异,除无菌水的处理外,非灭菌土接种菌剂后核桃苗植株株高和地径都显著高于灭菌土.
|
|
表 1 不同处理对核桃苗株高和地径的影响 Table 1 Effects of different treatments on the plant height and basal diameter of walnut seedlings |
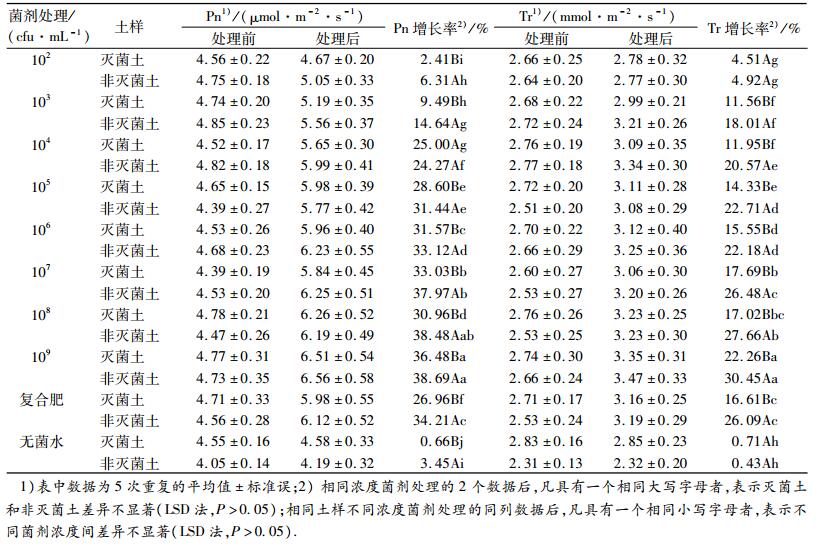
从表 2可以发现,不同处理均可以使核桃苗叶片净光合速率(Pn)和蒸腾速率(Tr)增加,各处理间差异显著.接种菌剂浓度越大,核桃苗叶片的净光合速率和蒸腾速率增幅越大,其中109 cfu·mL-1的菌剂其增长率分别高达38.69%和30.45%,显著高于其他处理.在接种菌剂浓度相同时,非灭菌土的核桃叶片的净光合速率和蒸腾速率增长率比灭菌土更高,说明菌株可以与土壤中的其他微生物对核桃植株起到协同促生作用.施肥和接种菌剂都能够增加核桃植株的净光合速率和蒸腾速率,但复合肥较菌剂来说,其增长率仅高于106 cfu·mL-1及以下处理,低于107、108和109 cfu·mL-1处理,说明高浓度的菌剂更能促进核桃苗的光合作用.
|
|
表 2 不同处理对核桃苗光合特性的影响 Table 2 Effects of different treatments on the photosynthetic characteristic of walnut seedlings |
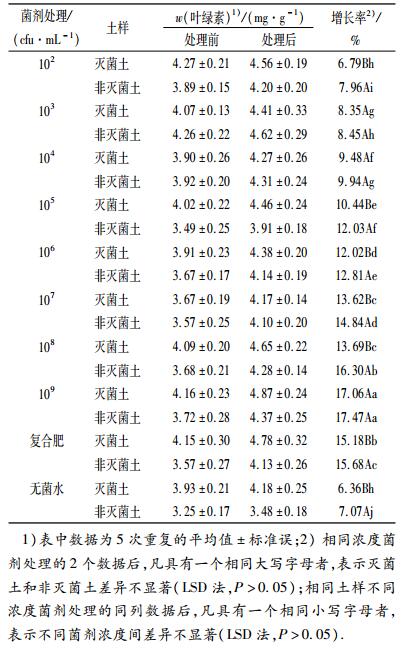
表 3显示,接种菌剂后,核桃苗叶片的叶绿素含量比无菌水处理有显著增加.不同处理可以使核桃苗叶片叶绿素含量增加,且处理间差异显著.菌剂浓度越高,增长率越大.其中109 cfu·mL-1菌剂灭菌土和非灭菌土的增长率分别为17.06%和17.47%,显著高于其他浓度处理.同灭菌土相比,同一浓度下非灭菌土所栽植的核桃苗叶片叶绿素含量增幅更加明显;虽103、104、109cfu·mL-1这3个浓度的灭菌土和非灭菌土差异不显著,但增长率后者仍高于前者.施肥和接种菌剂都能够增加核桃苗叶片的叶绿素含量,但复合肥较菌剂来说,高于107 cfu·mL-1及以下处理,低于109甚至108 cfu·mL-1处理,说明高浓度的菌剂更能提高核桃苗的叶绿素含量.
|
|
表 3 不同处理对核桃苗叶绿素含量的影响 Table 3 Effects of different treatments on the chlorophyll content of walnut seedlings |
菌种的生长繁殖和解磷能力,主要与其遗传特性有关,但受到培养条件(环境pH、培养时间、培养温度等)和培养基中氮源及碳源的影响也较大,且不同解磷菌特性存在很大差异[20].因此针对不同解磷菌培养特性的研究十分重要.碳水化合物是所有不能自养的微生物的能源物质,碳氮源是微生物的主要营养物质,对于微生物的生长繁殖和生理生化代谢都有重大的影响.刘辉等[7]发现,以葡萄糖为碳源时,荧光假单胞菌P.f luorescent溶磷能力最强;刘文干等[21]认为,洋葱伯克霍尔德氏菌Burkholderia cepacia在以麦芽糖为碳源时,其溶磷效果最佳.最适氮源同样如此,草酸青霉Penicillium oxalicum在硝态氮存在条件下的溶磷效率要高于铵态氮处理[22];而Whitelaw[23]的报道则相反:放射青霉P.radicum在铵态氮培养基中比在硝态氮培养基中分泌出更多的葡萄糖酸等有机酸.本试验中麦芽糖、玉米浆分别为最佳碳、氮源,说明不同细菌在不同的碳源和氮源培养下,溶磷活性不同,只有在特定的碳源和氮源下,溶磷能力才能达到最大.环境条件的改变能显著影响溶磷微生物的生长和溶磷功效的发挥,本研究结果中,pH为7、温度为28 ℃时温哥华假单胞菌菌株PAN4生长量和溶磷量最大,与多数报道一致[24-25],说明培养液pH和培养温度可以直接影响菌株的生长能力及溶磷能力.另外,本试验还发现菌体生长量和溶磷量之间具有相关性,与Narsian等[26]、胡晓峰[27]的结果不一致,可能与不同微生物的溶磷机制有关,本试验中,温哥华假单胞菌菌株PAN4数量的增多是溶磷量增加的直接因素.因此,对温哥华假单胞菌菌株PAN4溶磷特性的研究,可以为进一步探讨菌种溶磷机制打下坚实的基础.
假单胞菌是植物根系中较为活跃的一类解磷微生物,作为生物肥料,可以提高土壤中磷的利用率,提高作物产量[28].刘辉等[7]指出,来自植物根际土壤中的微生物能够抵抗不良环境并生存,是改善植物营养、促进植物生长的最有优势的微生物资源.温哥华假单胞菌PAN4是分离自核桃根际土的1株细菌,因此具备在核桃根际发展为优势菌株的前提.作为底物或调节物质,磷直接参与光合作用的各个环节[9],本试验接种温哥华假单胞菌PAN4菌剂后,核桃苗的株高、地径、净光合速率、呼吸速率和叶绿素含量均有不同程度的增加,这可能与解磷菌剂活化了土壤中的磷素并被核桃苗根系吸收后参与光合作用有关.高浓度菌剂促生效应优于复合肥,加之对环境友好、人畜安全的特点,为这一微生物肥料资源开发利用提供良好支撑.此外,菌剂在未灭菌土中促生效果比灭菌土好,结合余旋等[9]的报道,推测可能是由于未灭菌土中本身含有一些解磷微生物,或者原有微生物并未限制菌株的繁殖与发展,甚至增强温哥华假单胞菌菌株PAN4的解磷作用的缘故.本研究是在人工控制条件下进行的盆栽试验,应用的菌株获得正向效应符合大多数报道的结果[29].但在自然条件下,环境因子的影响很大,为使该菌在生产中稳定、有效地发挥作用,其定殖能力是后续研究重点之一.许多研究认为[30-33],溶磷细菌能够分泌植物激素、ACC脱氨酶、抗生素、嗜铁素等物质及通过溶磷等方式调节植物微生态环境,从而起到对植物促生防病的作用,本研究中温哥华假单胞菌菌株PAN4对核桃苗促生作用显著,但该菌是否具有分泌以上物质的功能,有待深入探讨.
| [1] |
张云翼, 邹碧莹. 土壤解磷细菌的研究进展[J]. 现代农业科技, 2008(15): 182-184. DOI:10.3969/j.issn.1007-5739.2008.15.122 (  0) 0) |
| [2] |
POONGUZHALI S, MADHAIYAN M, SA T. Isolation and identification of phosphate solubilizing bacteria from Chinese cabbage and their effect on growth and phosphorus utilization of plants[J]. J Microbiol Biotechn, 2008, 18(4): 773-777. (  0) 0) |
| [3] |
梁锦锋, 于红卫, 叶国平, 等. 有机磷化物对磷细菌生长和解磷的影响[J]. 江西农业学报, 2007, 19(8): 89-90. DOI:10.3969/j.issn.1001-8581.2007.08.033 (  0) 0) |
| [4] |
CHAIHARN M, LUMYONY S. Phosphate solubilization potential and stress tolerance of rhizobacteria from rice soil in Northern Thailand[J]. World J Microb Biot, 2009, 25(2): 305-314. DOI:10.1007/s11274-008-9892-2 (  0) 0) |
| [5] |
邵玉芳, 樊明寿, 乌恩, 等. 植物根际解磷细菌与植物生长发育[J]. 中国农学通报, 2007, 23(4): 241-244. DOI:10.3969/j.issn.1000-6850.2007.04.055 (  0) 0) |
| [6] |
TRIVEDI P, SA T. Pseudomonas corrugata (NRRL B-30409) mutants increased phosphate solubilization, organic acid production, and plant growth at lower temperatures[J]. Curr Microbiol, 2008, 56(2): 140-144. DOI:10.1007/s00284-007-9058-8 (  0) 0) |
| [7] |
刘辉, 吴小芹, 任嘉红, 等. 一株荧光假单胞菌的溶磷特性及其对杨树的促生效果[J]. 林业科学, 2013, 49(9): 112-118. (  0) 0) |
| [8] |
任嘉红, 刘辉, 吴晓蕙, 等. 南方红豆杉根际溶无机磷细菌的筛选鉴定及其促生效果[J]. 微生物学报, 2012, 52(3): 294-303. (  0) 0) |
| [9] |
余旋, 朱天辉, 刘旭, 等. 不同解磷菌剂对美国山核桃苗生长光合特性及磷素营养的影响[J]. 果树学报, 2010, 27(5): 725-729. (  0) 0) |
| [10] |
朱再玲, 王婧, 沈海涛, 等. 橘黄假单胞菌JD37对玉米小麦的防病促生作用[J]. 上海师范大学学报:自然科学版, 2011, 40(4): 399-404. (  0) 0) |
| [11] |
刘艳萍, 滕松山, 赵蕾. 高产嗜铁素恶臭假单胞菌A3菌株的鉴定及其对黄瓜的促生作用[J]. 植物营养与肥料学报, 2011, 17(6): 1507-1514. (  0) 0) |
| [12] |
崔晓亮. 核桃根际解磷、解钾、固氮菌株的筛选及分布特征研究[D]. 雅安: 四川农业大学, 2009.
(  0) 0) |
| [13] |
韩华柏, 朱益川, 余凌帆, 等. 四川核桃生产现状与产业化发展对策[J]. 经济林研究, 2003, 21(4): 138-140. DOI:10.3969/j.issn.1003-8981.2003.04.046 (  0) 0) |
| [14] |
余旋, 朱天辉, 刘旭. 不同解磷菌剂对美国山核桃根际微生物和酶活性的影响[J]. 林业科学, 2012, 48(2): 117-123. DOI:10.3969/j.issn.1001-1498.2012.02.002 (  0) 0) |
| [15] |
中国科学院南京土壤研究所微生物室. 土壤微生物研究方法[M]. 北京: 科学出版社, 1985, 50-51.
(  0) 0) |
| [16] |
陈守文, 王昌军, 信建, 等. 解磷恶臭假单胞菌L13及其发酵工艺: 中国, CN102649941A[P]. 2011-02-28.
(  0) 0) |
| [17] |
中国科学院南京土壤研究所. 土壤理化分析[M]. 上海: 上海科学技术出版社, 1978, 40-179.
(  0) 0) |
| [18] |
李冬梅, 魏珉, 张海森, 等. 氮、磷、钾用量和配比对温室黄瓜叶片相关代谢酶活性的影响[J]. 植物营养与肥料学报, 2006, 12(3): 382-387. DOI:10.3321/j.issn:1008-505X.2006.03.016 (  0) 0) |
| [19] |
王斌. NaCl和Na2SO4胁迫下沼泽小叶桦的生理响应[J]. 南京林业大学学报:自然科学版, 2013, 37(1): 132-136. (  0) 0) |
| [20] |
向文良, 冯炜, 郭健华, 等. 一株解磷中度嗜盐菌的分离鉴定及解磷特性分析[J]. 微生物学通报, 2009, 36(3): 320-327. (  0) 0) |
| [21] |
刘文干, 何园球, 张坤, 等. 一株红壤溶磷菌的分离鉴定及溶磷特性[J]. 微生物学报, 2012, 52(3): 326-333. (  0) 0) |
| [22] |
范丙全. 北方石灰性土壤中青霉菌P8(Penicillium oxalicum)活化难溶磷的作用和机理研究[D]. 北京: 中国农业科学院, 2001. http://cdmd.cnki.com.cn/Article/CDMD-82101-2001011991.htm
(  0) 0) |
| [23] |
WHITELAW M A. Growth promotion of plants inoculated with phosphate-solubilizing fungi[J]. Adv Agron, 1999, 69(2): 99-151. (  0) 0) |
| [24] |
赵小蓉, 林启美, 李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J]. 微生物学杂志, 2003, 23(3): 5-7. DOI:10.3969/j.issn.1005-7021.2003.03.002 (  0) 0) |
| [25] |
CHEN Y P, REKHA P D, ARUN A B, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Appl Soil Ecol, 2006, 34(1): 33-41. DOI:10.1016/j.apsoil.2005.12.002 (  0) 0) |
| [26] |
NARSIAN V, PATEL H H. Aspergillus aculeatus as a rock phosphate solubilizer[J]. Soil Biol Biochem, 2000, 32(4): 559-565. DOI:10.1016/S0038-0717(99)00184-4 (  0) 0) |
| [27] |
胡晓峰. 溶磷菌的筛选、溶磷条件优化及对玉米的促生作用研究[D]. 南京: 南京农业大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1762643
(  0) 0) |
| [28] |
ZAIDI A, KHAN M S, AMIL M D. Interactive effect of rhizotrophic microorganisms on yield and nutrient uptake of chickpea (Cicer arietinum L.)[J]. Eur J Agron, 2003, 19(1): 15-21. DOI:10.1016/S1161-0301(02)00015-1 (  0) 0) |
| [29] |
吕德国, 于翠, 秦嗣军, 等. 本溪山樱桃根部解磷细菌的定殖规律及其对植株生长发育的影响[J]. 中国农业科学, 2008, 41(2): 508-515. DOI:10.3864/j.issn.0578-1752.2008.02.026 (  0) 0) |
| [30] |
ARTURSSON V, FINLAY R D, JANSSON J K. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth[J]. Environ Microbiol, 2006, 8(1): 1-10. DOI:10.1111/EMI.2006.8.issue-1 (  0) 0) |
| [31] |
HAMEEDA B, HARINI O P, RUPELA O P, et al. Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna[J]. Microbiol Res, 2008, 163(2): 234-242. DOI:10.1016/j.micres.2006.05.009 (  0) 0) |
| [32] |
KHARE E, ARORAN K. Effect of indole-3-aceticacid (IAA) produced by Pseudomonas aeruginosa in suppression of charcoal rot disease of chickpea[J]. Curr Microbiol, 2010, 61(1): 64-68. DOI:10.1007/s00284-009-9577-6 (  0) 0) |
| [33] |
ZHANG Y F, HE L Y, CHEN Z J, et al. Characterization of ACC deaminase-producing endophytic bacteria isolated from copper-tolerant plants and their potential in promoting the growth and copper accumulation of Brassica napus[J]. Chemosphere, 2011, 83(1): 57-62. DOI:10.1016/j.chemosphere.2011.01.041 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36