夏季高温、高湿环境导致的热应激是影响家禽生产的主要环境因素之一.热应激会导致肉鸡采食、抗氧化力和免疫力的降低,从而严重影响肉鸡生产性能[1].因此,深入了解热应激影响肉鸡生理反应的内在机制,是研发安全有效抗热应激剂的前提.
机体细胞内环境的改变所引发的内质网内蛋白的错误折叠、未折叠蛋白质在内质网腔内聚集以及Ca2+平衡紊乱的状态,称为内质网应激(Endoplasmic reticulum stress,ERS),而由此引发的提高内质网功能的反应即为非折叠蛋白反应(Unfolded protein re- sponse,UPR)[2-3].研究表明,ERS和UPR与各种代谢和免疫功能紊乱密切相关[4],而热应激对肉鸡肝脏和肌肉中ERS和UPR有何影响还不清楚.骨骼肌纤维类型与肉品质密切相关[5-6].最新研究报道,热应激能够改变猪背最长肌肌纤维类型的组成[7],而热应激能否影响肉鸡肌纤维类型鲜见报道.
本试验以黄羽肉鸡为研究对象,在研究热应激对肉鸡生长、血液生化指标以及抗氧化能力影响的基础上,进一步探索热应激对肉鸡肝脏和肌肉ERS和UPR以及腓肠肌肌纤维类型的影响,旨在揭示热应激导致肉鸡生理功能变化的内在机制,为研发能安全有效缓解热应激的营养调控物提供理论依据.
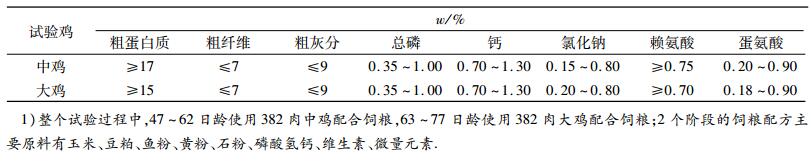
1 材料与方法 1.1 试验动物与试验设计试验选用20只47日龄江村黄肉母鸡,按体质量相近的原则随机分为常温对照组和热应激组,每组10只,试验期为30 d.鸡只饲养在人工气候室中,热应激组环境条件为:白天(09:00-17:00)(36 ± 1)℃,晚上(17:00-翌日09:00)(24 ± 1)℃,湿度(75 ± 5)%.常温组环境条件为:全天(24 ± 1)℃,湿度(75 ± 5)%.所有试验鸡均饲喂基础饲粮.基础饲粮组成及营养水平见表 1.
|
|
表 1 47 ~ 77日龄黄羽肉鸡基础饲粮组成及营养水平1) Table 1 Composition and nutrient levels of basal diets for yellow feather broilers aged from 47 to 77 days |
人工气候室(Conviron,加拿大),Bio-Rad MyCy- cler PCR仪(Bio-Rad,美国),HBPX220型梯度PCR仪(HYBRID,英国),Mx3005P荧光定量PCR仪(Sratagene,美国),γ放免计数器科大中佳GC-1200(科大创新股份有限公司),鸡笼等.总蛋白(TP)、白蛋白(ALB)、总抗氧化能力(T-AOC)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)检测试剂盒均购自南京建成生物有限公司.总胆固醇(TC)测定试剂盒购自北京北化康泰临床试剂有限公司.三酰甘油(TG)和血糖(GLU)测定试剂盒购自中生北控生物科技股份有限公司.血清激素:甲状腺激素(T3、T4)和胰岛素样生长因子1(IGF-1)测定试剂盒购自天津九鼎医学生物工程有限公司,皮质酮(CORT)ELISA检测试剂盒购自武汉华美生物工程有限公司.
1.3 测定指标及方法血液样品采集和检测:试验结束时,采集肉鸡血液于10 mL离心管中,离心分离血清,分装于1.5 mL离心管中,- 20 ℃冰箱中保存备用.利用试剂盒检测血清生化指标:TC、GLU、TP和ALB.利用放射免疫分析法检测血清激素:T3、T4和IGF-1;利用ELISA法检测血清激素CORT.利用试剂盒法检测血清抗氧化指标:MDA、GSH-PX和SOD.
组织样品采集和检测:处死肉鸡后,剪开腹部皮肤,暴露内脏,用小剪刀分离肝脏,滤纸吸干,于固定位置剪下0.5 g组织样,放入2 mL离心管中,每只鸡在同侧腓肠肌位置取样装入2 mL管,迅速投入装有液氮的液氮罐中.采样结束后转移样品至- 80 ℃冰箱中保存备用.利用试剂盒法检测肝脏抗氧化指标:SOD、GSH-PX、CAT和T-AOC.
取肝脏和腓肠肌样品分别抽提总RNA,使用一步法RNA抽提试剂TRIzol,常规方法抽提,用Oligo(dT)引物和AMV反转录酶进行反转录,RT-PCR反应体系为SYBR Premix Ex Taq,上、下游引物和cD- NA模板,以GAPDH为内参,荧光定量PCR法检测肝脏和腓肠肌中内质网应激相关因子基因,即热休克蛋白70(Heat shock protein 70,HSP70)基因、转录激活因子4(Activating transcription factor 4,ATF4)基因和鸡葡萄糖调节蛋白78(Glucose-regulated protein 78,GRP78)基因mRNA的表达.同时测定腓肠肌中慢肌肌球蛋白重链(Slow myofiber MyHC,MyHC-SM)基因、快红肌肌球蛋白重链(Fast red myofiber MyHC,MyHC-FRM)基因和快白肌肌球蛋白重链(Fast white myofiber MyHC,MyHC-FWM)基因mRNA的表达.相关基因的引物序列见表 2.
|
|
表 2 荧光定量PCR所用引物序列 Table 2 The primer sequences used for real-time quantitative PCR |
试验结果用平均值±标准误表示.统计分析采用Sigmaplot 12.5软件分析,对热应激组和常温对照组的数值进行t检验.
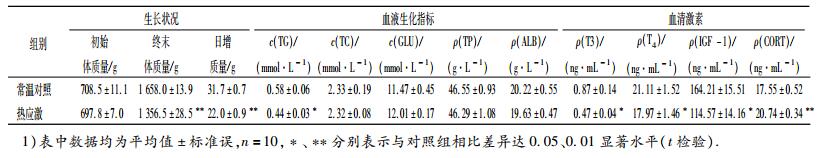
2 结果与分析 2.1 慢性热应激对肉鸡生长、血液生化指标以及血清激素水平的影响慢性热应激对肉鸡生长、血清生化指标以及血清激素水平的影响见表 3.慢性热应激极显著(P<0.01)降低肉鸡终末体质量和平均日增质量,说明慢性热应激对肉鸡生长具有显著的抑制作用.此外,慢性热应激对肉鸡血清的TC、GLU、TP和ALB的浓度无显著影响,但却显著(P<0.05)降低血清TG浓度.慢性热应激可显著提高血清CORT的水平,但显著降低(P<0.05)血清T3、T4和IGF-1的水平.
|
|
表 3 慢性热应激对黄羽肉鸡生长、血液生化指标以及血清激素水平的影响1) Table 3 Effects of chronic heat stress on growth, serum biochemical indexes, and serum hormone levels of yellow feather broilers |
由表 4可见,慢性热应激能显著提高(P<0.05)血清MDA含量,同时极显著降低(P<0.01)血清GSH-PX活性,而对血清SOD活性无显著影响.在肝脏中,慢性热应激能显著降低GSH-PX活性(P<0.01)和T-AOC(P<0.05),而对SOD和CAT活性无影响.
|
|
表 4 慢性热应激对黄羽肉鸡血清和肝脏抗氧化指标的影响1) Table 4 Effects of chronic heat stress on serum and liver antioxidant indexes of yellow feather broilers |
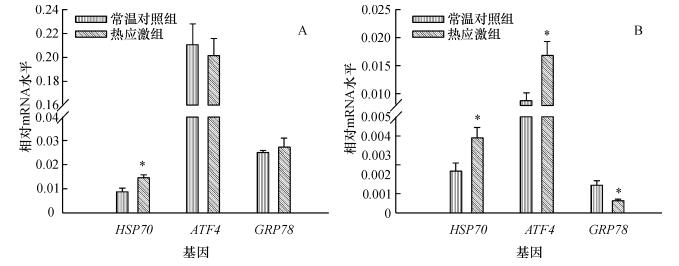
如图 1A所示,慢性热应激对肉鸡肝脏ATF4和GRP78基因mRNA表达量无显著影响,但能显著升高(P<0.05)肉鸡肝脏HSP70基因mRNA的表达.由图 1B可知,慢性热应激导致肉鸡腓肠肌HSP70和ATF4基因mRNA表达量显著升高(P<0.05),而GRP78基因表达量显著降低(P<0.05).
|
图 1 慢性热应激对肉鸡肝脏(A)和腓肠肌(B)HSP70、ATF4和GRP78基因mRNA表达的影响 Figure 1 Effects of chronic heat stress on the mRNA expressions of HSP70, ATF4 and GRP78 genes in liver (A) and gastrocnemius muscle (B) of broilers *表示与对照组相比差异达0.05显著水平(t检验). |
如图 2所示,慢性热应激虽然对MyHC-FRM基因和MyHC-FWM基因mRNA表达无影响,但却显著降低(P<0.05)MyHC-SM基因mRNA的表达.

|
图 2 慢性热应激对肉鸡腓肠肌不同肌纤维类型肌球蛋白重链基因mRNA表达的影响 Figure 2 Effects of chronic heat stress on the mRNA expressions of different types of myosin heavy chain in gastrocnemius muscle of broilers *表示与对照组相比差异达0.05显著水平(t检验). |
已有较多报道发现,高温导致的热应激会使鸡的生产性能显著下降[8-9],本试验中热应激导致肉鸡体质量和日增质量均极显著下降,与文献报道一致.李军乔[10]研究发现,当肉鸡热暴露3周时,血液中三酰甘油含量显著降低,而血液中血糖、白蛋白、总蛋白水平无变化,本试验结果与上述报道一致.而热应激组血清三酰甘油含量显著降低,其可能原因是高温导致肉鸡营养不良、脂肪消化吸收障碍等.动物应激会引起体内应激激素的升高,本试验中也发现热应激可以显著升高肉鸡血清皮质酮水平,这与以往的报道相一致[11].此外,本研究还发现,热应激导致IGF-1水平显著降低,而IGF-1与动物生长密切相关,因此,这与热应激显著降低肉鸡生长和体质量增加相一致.热应激还会降低肉鸡血液T3和T4水平[8, 12],进而影响动物的生长和代谢.而本试验中发现热应激显著降低血清T3和T4水平,一方面会抑制动物生长,另一方面降低机体能量代谢,减少热量产生.
本试验结果发现热应激显著升高肉鸡血清MDA含量,其反应是机体内自由基的增加,与以往报道一致[10].而机体自由基的清除主要依靠体内各类抗氧化酶,包括SOD、CAT和GSH-PX等.本试验中,热应激会显著降低血清和肝脏中GSH-PX的活性以及肝脏中T-AOC,进而导致MDA含量的增加,这也与以往报道一致[13-14].因此,在实际生产中,为了解决热应激造成的肉鸡抗氧化能力下降,可考虑在饲料中添加维生素类[15]、氨基酸[13]、铬[16]等,缓解热应激对机体抗氧化能力的破坏.
3.2 慢性热应激对肉鸡肝脏和肌肉ERS和UPR相关因子表达的影响高温环境不仅导致机体代谢失衡、抗氧化能力减弱和组织损伤,造成机体应激,产生热休克蛋白(如HSP70)[17],还可能破坏内质网的稳态造成内质网应激(ERS),此时细胞会启动UPR通路改变基因的转录和翻译过程来缓解内质网应激.GRP78是参与UPR通路的一种重要分子伴侣蛋白,ATF-4是UPR通路中一种重要的转录激活因子,二者在UPR信号通路起着关键作用[2, 4].本试验通过定量检测肝脏和肌肉组织中HSP70基因以及ERS和UPR相关因子基因的表达水平,来衡量机体抗应激能力和环境内质网应激能力.结果表明,热应激能显著提高肝脏和肌肉组织的HSP70基因表达量,有助于机体抗应激.与我们结果一致的是,李军乔[10]也发现高温环境能提高肉仔鸡肝脏HSP72基因的表达.此外,我们还发现慢性热应激对肝脏ATF4和GRP78基因无显著影响,提示热应激后肝脏细胞URP通路变化并不明显.在骨骼肌中,慢性热应激显著增加ATF4基因表达量,同时降低GRP78基因的表达量.以上结果提示,热应激会导致肝脏和肌肉产生不同的ERS和UPR.2种组织之间的差异可能是因为肝脏组织代谢旺盛,ERS和UPR处于动态平衡过程中,而肌肉组织代谢相对缓慢,可能反映出机体自身长时间的抗应激状态.因此,添加外源分子伴侣或者其他功能性营养物来提高细胞UPR,进而缓解细胞ERS,是缓解肉鸡热应激的有效途径.
3.3 慢性热应激对肉鸡腓肠肌肌纤维类型的影响对于禽类,骨骼肌肌纤维一般分为3类:慢肌纤维、快红肌纤维和快白肌纤维[18].肌纤维不同类型与肉鸡的肌肉品质密切相关,慢肌纤维含量多有助于提高禽类肉品质[5].目前,有关热应激对肉鸡的肌肉品质影响的报道已有一些,但这些报道多集中于热应激对肉色、系水力、pH等指标的影响[10, 19],而有关热应激对肉鸡骨骼肌纤维类型的研究还比较少.我们采集肉鸡腿肌样品时,也发现热应激组鸡的腿肌颜色偏白,提示热应激可能对骨骼肌纤维类型有一定影响.为了验证这一假说,我们检测了肉鸡腓肠肌中不同肌纤维类型(慢肌、快红肌和快白肌)肌球蛋白重链(Myosin heavy chain,MyHC)基因mRNA的表达.结果表明,热应激虽然对快红肌和快白肌MyHC基因mRNA表达无影响,但却显著降低慢肌MyHC基因mRNA的表达,提示热应激可降低肉鸡腓肠肌中慢肌纤维的比例,从而降低肉鸡肌肉品质.有研究报道,持续的中度热应激会诱导小鼠C2C12细胞系[20]和人成肌细胞[21]由快肌向慢肌分化,这与我们的试验结果相反.其原因可能是禽类与哺乳类之间存在物种差异,另外细胞与活体试验之间条件的差异也会导致结果不同.
综上所述,慢性热应激会抑制黄羽肉鸡生长、降低机体抗氧化能力,导致肉鸡出现内质网应激,并能减少肉鸡腓肠肌慢肌MyHC基因表达量,从而降低黄羽肉鸡肌肉品质.以上结果揭示了热应激导致肉鸡生理功能变化的内在机制,为针对性地研发能够提高机体抗氧化能力、缓解内质网应激的营养调控物提供了理论依据.
| [1] |
田书音, 李冰. 热应激对肉鸡生产的危害及抗应激添加剂的研究[J]. 饲料博览, 2010(10): 10-13. DOI:10.3969/j.issn.1001-0084.2010.10.003 (  0) 0) |
| [2] |
LAI E, TEODORO T, VOLCHUK A. Endoplasmic reticu- lum stress: Signaling the unfolded protein response[J]. Physiology (Bethesda), 2007, 22(3): 193-201. (  0) 0) |
| [3] |
刘宝琴, 王华芹. 内质网应激与未折叠蛋白反应的研究进展[J]. 中华肿瘤防治杂志, 2010, 17(11): 869-872. (  0) 0) |
| [4] |
CAO S S, KAUFMAN R J. Unfolded protein response[J]. Curr Biol, 2012, 22(16): R622-R626. DOI:10.1016/j.cub.2012.07.004 (  0) 0) |
| [5] |
邬理洋, 黄兴国. 肌纤维类型对肉质品质的影响[J]. 湖南饲料, 2010(3): 21-23. DOI:10.3969/j.issn.1673-7539.2010.03.013 (  0) 0) |
| [6] |
LEE S H, JOO S T, RYU Y C. Skeletal muscle fiber type and myofibrillar proteins in relation to meat quality[J]. Meat Sci, 2010, 86(1): 166-170. DOI:10.1016/j.meatsci.2010.04.040 (  0) 0) |
| [7] |
杨培歌. 热应激对肥育猪肌肉品质及其代谢物的影响[D]. 北京: 中国农业科学院, 2014. http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326613.htm
(  0) 0) |
| [8] |
LARA L J, ROSTAGNO M H. Impact of heat stress on poultry production[J]. Animals, 2013, 3(2): 356-369. DOI:10.3390/ani3020356 (  0) 0) |
| [9] |
王士长, 陈静, 黄怡, 等. 热应激对肉鸡生产性能和血清生化指标的影响[J]. 中国家禽, 2007, 29(15): 11-13. DOI:10.3969/j.issn.1004-6364.2007.15.003 (  0) 0) |
| [10] |
李军乔. 高温环境对肉仔鸡血液生化指标、热应激蛋白(HSP72)转录及肉品质的影响[D]. 保定: 河北农业大学, 2004. http://cdmd.cnki.com.cn/article/cdmd-11920-2004091510.htm
(  0) 0) |
| [11] |
刘铀, 林红英, 罗东君, 等. 热应激对肉鸡血液生化指标及内分泌机能的影响[J]. 湛江海洋大学学报, 1999, 19(1): 61-64. (  0) 0) |
| [12] |
何世山, 金小军. 高温对肉鸡血液生化指标的影响[J]. 浙江大学学报:农业与生命科学版, 2003, 29(3): 77-80. (  0) 0) |
| [13] |
李文立, 路静, 孙振钧, 等. 谷氨酰胺对热应激肉鸡抗氧化性能的影响[J]. 动物营养学报, 2011, 23(4): 695-702. DOI:10.3969/j.issn.1006-267x.2011.04.022 (  0) 0) |
| [14] |
林海, 杜荣. 热应激对肉鸡组织过氧化状态的影响[J]. 动物营养学报, 2001, 13(2): 30-32. DOI:10.3969/j.issn.1006-267X.2001.02.007 (  0) 0) |
| [15] |
JANG I S, KO Y H, MOON Y S, et al. Effects of vitamin C or E on the Pro-inflammatory cytokines, heat shock pro- tein 70 and antioxidant status in broiler chicks under sum- mer conditions[J]. Asian Australas J Anim Sci, 2014, 27(5): 749-756. DOI:10.5713/ajas.2013.13852 (  0) 0) |
| [16] |
王立, 姜建阳, 任慧英, 等. 两种铬源对热应激肉鸡抗氧化性能的影响[J]. 饲料广角, 2010(9): 26-27. DOI:10.3969/j.issn.1002-8358.2010.09.008 (  0) 0) |
| [17] |
孙培明. 肉鸡热应激损伤与热休克蛋白70表达的研究[D]. 南京: 南京农业大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10307-2007010246.htm
(  0) 0) |
| [18] |
李娟. 鸡生长发育和肌纤维生长的影响因素与相关基因表达研究[D]. 雅安: 四川农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10626-1014103189.htm
(  0) 0) |
| [19] |
杨小娇, 许静, 宗凯, 等. 不同温度热应激对肉鸡血液生化指标及肉品质的影响[J]. 家禽科学, 2011(3): 10-14. DOI:10.3969/j.issn.1673-1085.2011.03.004 (  0) 0) |
| [20] |
YAMAGUCHI T, SUZUKI T, ARAI H, et al. Continuous mild heat stress induces differentiation of mammalian myo- blasts, shifting fiber type from fast to slow[J]. Am J Physiol-Cell Ph, 2010, 298(1): C140-C148. DOI:10.1152/ajpcell.00050.2009 (  0) 0) |
| [21] |
YAMAGUCHI T, OMORI M, TANAKA N, et al. Distinct and additive effects of sodium bicarbonate and continuous mild heat stress on fiber type shift via calcineurin /NFAT pathway in human skeletal myoblasts[J]. Am J Physiol- Cell Ph, 2013, 305(3): C323-C333. DOI:10.1152/ajpcell.00393.2012 (  0) 0) |
 2015, Vol. 36
2015, Vol. 36