2. 平昌县林业局,四川 巴中 636600
2. Pingchang County Forestry Administration, Bazhong 636600;China
低效防护林是一种退化的森林生态系统,由于生态环境建设的需要,对低效林的改造和研究已成为恢复生态学领域的一个重要内容。目前,针对马尾松、柏木等不同树种的低效林分,许多学者也都进行了不同改造模式与改造技术的探讨[1-4],关于纯林补植其他树种变混交林、改善经营管理措施等研究比较深入,而采用经济林改造模式的研究还不够广泛,所以因地制宜栽植其他经济树种提高低效林的生态与经济效益具有一定的研究价值。
土壤微生物和酶活性是反映土壤肥力最为重要的生物学指标,其产生的变化可以表征土壤熟化程度,对土壤养分转化与循环、有害生物防治、促进土壤良性生态循环及土壤保持具有重大作用[5]。研究不同种植模式下土壤微生物和酶活性的分布状况及季节动态变化,可以直接或间接地反映不同林分对土壤的改良作用。
本文通过研究无植草的核桃林和3种核桃林草复合改造模式下土壤微生物、酶活性的空间分布和季节动态变化,并与柏木纯林对比,评价不同低效林改造模式对土壤肥力的影响,以期选出更优的经营模式,为该区低效林改造提供理论依据。
1 材料与方法 1.1 研究区域概况研究区位于德阳市旌阳区,地处成都平原边缘,介于东经104°15′~104°35′,北纬31°1′~31°19′之间。市境内地形地貌多样,属典型的低山丘陵区。研究区位于亚热带湿润季风区,常年平均气温15~17 ℃,最高气温36.5 ℃,最低气温-6.7 ℃。年平均日照1 000~1 300 h,年平均降雨量900 mm,雨热同季。土壤以碱性紫色土为主,土层浅薄。20世纪80年代初营建的以柏木为主的人工林由于多种原因,林相残败,树种单一,生物多样性低,生境质量较差,林分产量和生态功能低下,属典型的次生低效人工纯林。
1.2 样地设置试验地位于德阳市旌阳区和新镇永新村,于2011年对该区柏木低效纯林进行带状或块状皆伐,引入经济树种核桃Juglans regia,并采取林草复合模式进行改造。试验设立3个随机区组,区组内土壤肥力等环境条件相对均匀一致,每个区组划分4个小区,设置核桃+菊苣Cichorium intybus、核桃+苜蓿Medicago sativa、核桃+鸭茅Dactylis glomerata 3种林草模式和核桃(无植草)模式,并以纯柏木低效林为对照(CK),分别设立样地进行观测,样地重复3次。
1.3 样品采集及测定本试验按不同时期分4次取样,具体时间分别为2013年12月,2014年3、6、9月,于5种样地内按S形5点混合取样法分别取0~15、15~30 cm土层土样。一部分低温保存,用于微生物数量测定,分析采用稀释平板法[6],其中细菌采用牛肉膏蛋白胨培养基,真菌采用改良马丁培养基,放线菌采用改良高氏一号培养基;另一部分风干后用于土壤酶活性测定,其中过氧化氢酶活性测定采用高锰酸钾滴定法,蔗糖酶活性测定采用3, 5-二硝基水杨酸比色法,脲酶活性测定采用苯酚钠比色法,碱性磷酸酶活性测定采用磷酸苯二钠比色法[7]。
1.4 数据处理采用Microsoft Excel 2007、SPSS 17.0对数据进行处理与分析。
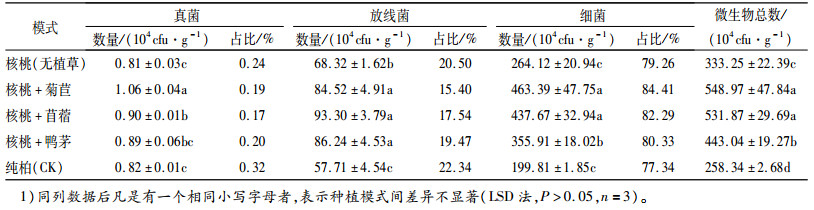
2 结果与分析 2.1 不同种植模式下土壤微生物的组成和数量土壤微生物是土壤生态系统的重要组成部分。细菌在氨化过程中作用重大,真菌积极参与土壤碳素和能源循环过程[8],放线菌发育相对缓慢,其主要通过分解作用将动植物残体转化为土壤有机组分。三者的变化必定影响到土壤中具有生理、生化活性物质的种类和数量[9],因此土壤微生物活性在一定程度上反映了土壤肥力[10]。
从表 1可以看出,5种不同种植模式条件下土壤微生物数量存在一定的差异,微生物总数表现为:核桃+菊苣>核桃+苜蓿>核桃+鸭茅>核桃(无植草)>纯柏,除了核桃+菊苣与核桃+苜蓿之间的微生物总数差异不显著外,其他模式间皆呈显著性差异(P<0.05);土壤细菌数量在微生物总量中占据的比例最大,分布最广,约占微生物总数的77%~85%,其变化趋势与微生物总数一致,其中3种林草复合模式中的细菌数量与核桃(无植草)、纯柏之间的差异达显著水平(P<0.05),核桃+菊苣和核桃+苜蓿之间差异不显著,但两者与核桃+鸭茅之间皆为显著性差异(P<0.05);放线菌约占微生物总数的15%~23%,数量大小为核桃+苜蓿>核桃+鸭茅>核桃+菊苣>核桃(无植草)>纯柏,但放线菌数量在3种林草复合模式之间差异不显著,该3种林草复合模式与核桃(无植草)、纯柏之间差异显著(P<0.05),核桃(无植草)与纯柏之间也呈显著性差异(P<0.05);真菌数量最少,仅占微生物总数的0.17%~0.32%,数量大小为核桃+菊苣>核桃+苜蓿>核桃+鸭茅>纯柏>核桃(无植草),真菌数量在核桃+菊苣、核桃+苜蓿与纯柏、核桃(无植草)之间差异显著(P<0.05),并且在3种林草复合模式中,核桃+菊苣分别与核桃+苜蓿、核桃+鸭茅呈显著性差异(P<0.05)。这可能与环境变化、树种更换及改造模式有关,由于采用皆伐方式降低了地被覆盖度,可能引起土壤温度、湿度变化,引入的核桃以及不同草种其根系分泌物、根系凋落物不同于原有林分,加之造林过程对土壤结构、通透性以及其他土壤性质的改变,都可能导致土壤微生物种类和数量变化,从微生物数量上看,总体表现为引入核桃树种优于原有柏木纯林,植草优于无植草,不同草种由于其适应性和本身特性不同,表现各异。相比之下,核桃+菊苣、核桃+苜蓿对土壤微生物数量的影响较大。
|
|
表 1 不同种植模式下的土壤微生物组成和数量(0~30 cm土层)1) Table 1 The compositions and amounts of soil microorganisms under different patterns(soil layer 0-30 cm) |
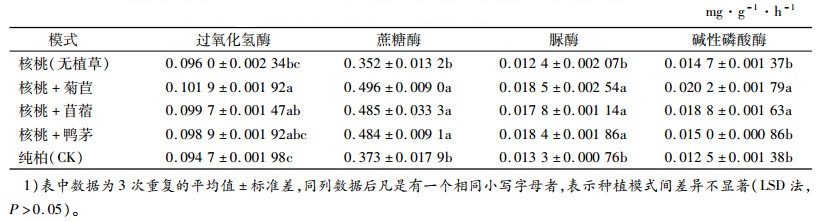
土壤酶是指由微生物、动植物活体分泌及由动植物残体分解释放于土壤中的一类具有催化作用的生物活性物质[11],主要参与包括土壤所有复杂的生物化学过程在内的自然界物质循环,常常被作为土壤生产力及土壤质量评定指标。本试验中,不同处理使土壤酶活性存在一定的差异,皆伐柏木改种核桃经济林,并加以栽植牧草形成林草复合模式,使土壤形成相对封闭的独特环境,其光照、温度、湿度、通气状况、水肥条件等不同于原有纯柏木林地,并形成特定的土壤环境。
从表 2可以看出,土壤酶活性大小在不同种植模式中表现不同。土壤过氧化氢酶、碱性磷酸酶活性皆表现为核桃+菊苣>核桃+苜蓿>核桃+鸭茅>核桃(无植草)>纯柏;蔗糖酶活性表现为核桃+菊苣>核桃+苜蓿>核桃+鸭茅>纯柏>核桃(无植草);脲酶活性表现为核桃+菊苣>核桃+鸭茅>核桃+苜蓿>纯柏>核桃(无植草)。3种林草复合模式中土壤酶活性与核桃(无植草)、纯柏之间基本上呈显著性差异(P<0.05),但土壤酶活性在不同林草复合模式之间、核桃(无植草)与纯柏之间差异不显著。可见,单纯引进核桃树种对土壤肥力影响不大,而引进核桃并结合种植牧草,不但没有造成牧草与核桃间对土壤营养的竞争,还在一定程度上提高了土壤肥力。其可能是较发达的牧草根系分泌物使微生物大量繁殖,对土壤酶具有刺激作用,影响土壤酶活性的缘故。但根系分泌物以何种成分、通过何种途径来影响土壤酶还有待进一步探究。根系自身也能向土壤提供部分酶[12],必然加大土壤酶活性。同时,不同牧草对土壤质量的影响差异不明显,可能是栽培时间较短、彼此间的差异性暂未表现的缘故。
|
|
表 2 不同种植模式下的土壤酶活性(0~30 cm土层)1) Table 2 Soil enzyme activities under different patterns(soil layer 0-30 cm) |
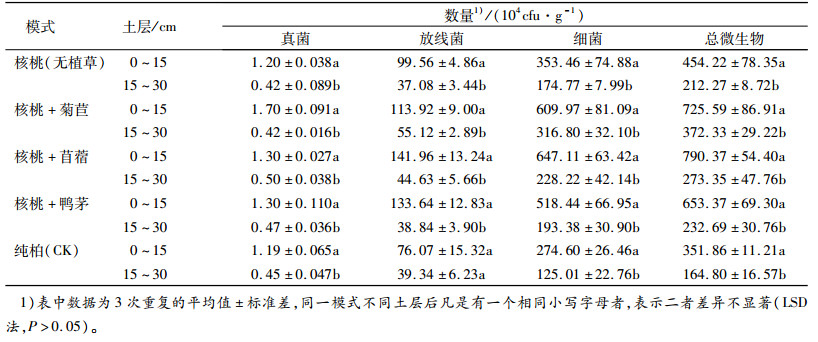
由于受到植物根系、土壤肥力以及土壤水分、温度等影响,土壤微生物数量和种类在不同的土壤深度中存在很大的差异,表现一定的垂直分布规律。不同模式0~15及15~30 cm土层土壤微生物数量测定结果见表 3。
|
|
表 3 不同种植模式下土壤微生物数量的垂直分布 Table 3 Vertical distribution of the number of soil microorganisms under different patterns |
由表 3得知,5种种植模式下的土壤微生物数量具有明显的垂直分布特征,均表现为上层高于下层,且上、下层之间差异显著(P<0.05)。由于表层土壤与空气进行热交换,土壤热值状况比下层好,适宜的温度促进了微生物的生长。而且表层土壤植物根系分布较密,是微生物活动最活跃的区域,其丰富的根系分泌物及死根为异养微生物提供了一定的碳源和能源[13]。加之地表有机质含量较高,其矿质化过程为土壤微生物提供养分和能量。其中林草复合模式区更多的牧草根系穿插或扩展于土壤表层,提高了土壤孔隙度及田间持水能力,土壤通透性的增加更有利于微生物的生长与分布。
由表 3还可以看出,不同土层之间各模式土壤微生物数量变化幅度不同。放线菌、细菌数量上下层变化幅度最大的皆为核桃+苜蓿,真菌为核桃+菊苣。三大微生物数量上下层变化幅度最小的皆为纯柏。可见引进核桃经济树种以及采用核桃林草复合模式对不同土层微生物数量变化幅度具有一定的影响。树种改变引起土壤原有结构、土壤肥力及其他土壤性质发生相应的改变,不同土层中的土壤微生物种类和数量随之改变。
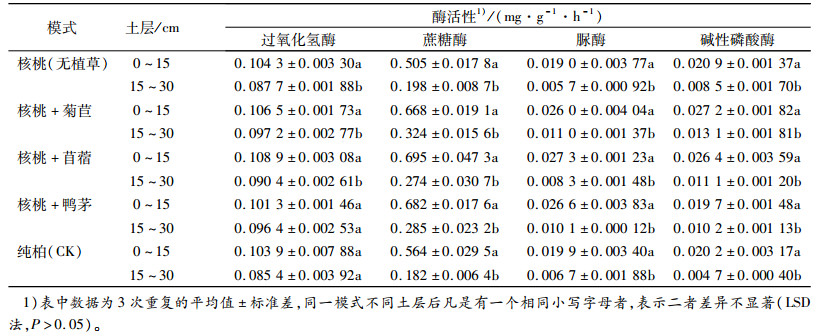
2.4 不同种植模式下土壤酶活性的垂直分布土壤酶活性与土壤中的有机质含量、土壤含水量、生物代谢过程等有密切的关系。土壤酶活性在土壤剖面中有明显的层次性,不同模式下0~15及15~30 cm土层土壤酶活性的垂直分布状况见表 4。
|
|
表 4 不同种植模式下土壤酶活性的垂直分布 Table 4 Vertical distribution of soil enzyme activities under different patterns |
由表 4得知,5种种植模式的土壤酶活性具有明显的垂直分布特征,均表现为上层高于下层,且上、下层之间差异显著(P<0.05)。产生该结果的原因与土壤微生物类似,主要源于地表土壤有机质高于下层,而土壤酶主要以物理或化学的结合形式吸附在土壤有机和无机颗粒上或者与土壤腐殖质络合。而且植物细根作为根系中最活跃的部分广泛分布于土壤表层,其在生长发育过程中的分泌物、脱落物的矿化分解促使酶进入土壤;土壤表面通气状况良好、水分含量高及温、湿度适宜;地表土壤微生物分泌物及其残体也能刺激酶活性增加。因此造成土壤表层酶活性显著高于下层。
由表 4还可以看出,与土壤微生物数量一致,其不同土层之间各种植模式土壤酶活性变化幅度有所差别,上、下层间各种植模式中过氧化氢酶、蔗糖酶、脲酶活性变化最大的皆为核桃+苜蓿,而碱性磷酸酶活性则为纯柏。过氧化氢酶、碱性磷酸酶活性变化最小的皆为核桃+鸭茅,蔗糖酶为核桃(无植草),而脲酶则为纯柏。其归因于不同林分、同一林分不同牧草模式所对应的土壤性质不同,说明其对土壤产生的影响具有差异性。
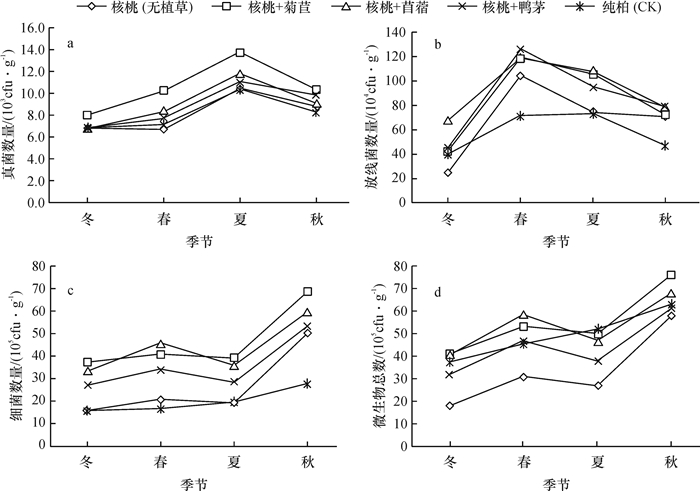
2.5 不同种植模式下土壤微生物数量的季节动态土壤微生物的季节动态受到土壤类型、气候条件、土壤营养状况等因素的影响。在不同的生态环境下,微生物种类的季节动态及分布特征不同[14],不同模式下土壤微生物三大类群数量均具有一定的季节变化趋势[15],但变化规律各异。
由图 1可见,由于细菌数量级较大,微生物总数的季节动态与细菌一致,均表现为秋季最高,春、夏季次之,冬季最低,这可能与季节不同带来的环境变化有关,从春季开始,土壤温度和湿度逐步提高,养分逐渐活化,生物代谢活动逐渐加强,细菌数量随之增加,秋季适宜细菌生长的环境又逐渐恶化,因而秋季细菌数量达到高峰后就持续下降;土壤真菌数量的季节变化趋势以夏季为高,春、秋季次之,冬季最低,这可能与夏季高温湿润更适合土壤真菌生长有关;土壤放线菌数量的季节变化规律表现为:春季>夏季>秋季>冬季,营养丰富的土壤有利于微生物生长的同时也加大了彼此间的竞争,而放线菌竞争能力相对较弱,则数量相对较少,而随环境恶化,其他微生物生长受到限制,放线菌竞争压力随之减小,其放线菌数量逐渐增加[16]。由于放线菌发育缓慢,随环境变化而表现出来的数量变化特征具有滞后性,因而表现为春、夏季较高,秋、冬季较低的变化规律。由于气温和土温以及土壤含水量降低,微生物代谢活动受到抑制,大部分微生物停止生长,处于休眠甚至死亡状态,造成三大微生物数量在冬季急剧下降,远低于其他季节。
|
图 1 不同种植模式下土壤微生物数量的季节动态 Figure 1 Seasonal dynamics in the number of soil microorganisms under different cropping patterns |
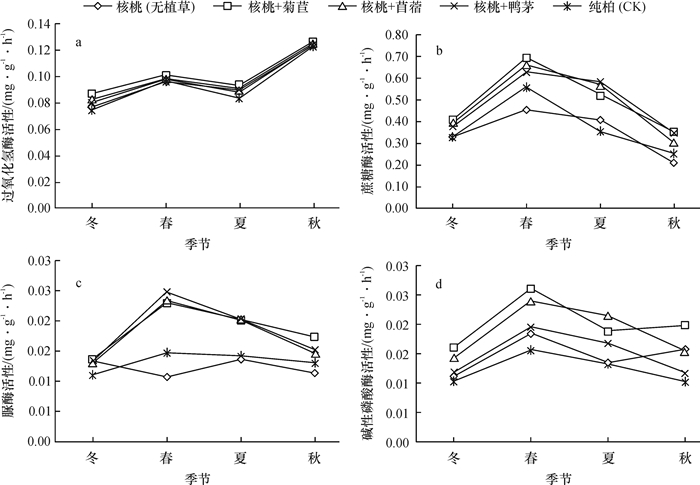
土壤酶活性主要受环境条件和林木生长状况等多种因素的共同影响,而季节变化会引起各种因素发生周期性变化,因此土壤酶活性会随着季节的改变而表现出不同特点。由图 2可知,不同种植模式下的土壤酶活性均具有一定的季节性变化,由于受不同林地条件影响,各模式土壤酶的季节动态分布规律各异。
|
图 2 不同种植模式下土壤酶活性的季节动态 Figure 2 Seasonal dynamics in soil enzyme activities under different patterns |
由图 2可知,各模式中土壤脲酶、碱性磷酸酶活性大致以春季最高,其次是夏、秋季,最低为冬季。土壤蔗糖酶表现为春季最高,夏、冬季次之,秋季最低。可能是春季温度开始回升,适宜的温、湿度对土壤酶具有激活效应,而且植物正处于生长旺盛期,根系生长力强,土壤微生物活动较频繁、代谢速率加快,由于土壤酶多数来自微生物的代谢产物及胞内酶,所以该时期的土壤酶活性也相应提高。其中土壤脲酶活性的季节变化与放线菌数量的变化规律一致,说明该酶的季节动态变化受到放线菌数量的变化影响较大。土壤过氧化氢酶活性则为秋季最高,其次是春、夏季,最后为冬季。表明不同土壤酶对温度的敏感程度不同。过氧代氢酶的季节动态可能受到凋落物动态的影响,因为秋季植被逐步枯萎、死亡,大量凋落物进入土壤,土壤微生物活动加强,酶活性随之提高。除了蔗糖酶外的3种酶活性皆以冬季最低,正是因为冬季温度、土壤含水量较低,微生物处于休眠或者死亡状态,间接减弱了土壤酶活性,并且冬季低温干燥也抑制了酶活性。至于蔗糖酶活性低谷期出现在秋季,可能的原因是秋季植物生长处于停滞期,土壤中蔗糖水解速率降低,土壤蔗糖酶活性随之降低。
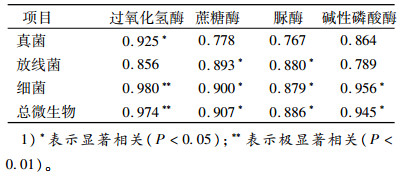
2.7 不同种植模式下土壤微生物与土壤酶活性的相关性分析土壤微生物和酶在土壤物质循环和能量转化过程中密切相关[17],存在相互促进和制约的复杂关系。而土壤中大部分酶是土壤微生物新陈代谢过程中释放的有活性物质,因此酶活性在一定的程度上也取决于微生物数量[18-20]。
由表 5可知,真菌数量与过氧化氢酶活性呈显著正相关(P<0.05);放线菌数量与蔗糖酶、脲酶活性呈显著正相关(P<0.05);细菌数量与过氧化氢酶活性呈极显著正相关(P<0.01),而与蔗糖酶、脲酶、碱性磷酸酶活性呈显著正相关(P<0.05)。说明土壤微生物数量与酶活性之间存在相关性,微生物数量越大,酶活性越强,生物化学反应越强烈,而土壤酶活性高低间接反映了这些生化反应产物的多少[21-22]。两者之间的相关性能及时反映土壤养分的变化趋势,故可作为评价林地土壤肥力的指标,为改造柏木低效林提供理论依据。
|
|
表 5 土壤微生物数量和土壤酶活性的相关性1) Table 5 The correlation coefficient between soil microorganism and soil enzyme activity |
本研究表明,德阳市旌阳区柏木低效林不同种植模式土壤微生物表现为以下特征:微生物数量中细菌占绝对优势,细菌、真菌、放线菌数量比例大致为400:100:1,这与微生物体积大小、发育规律等生物生理学特征有关;微生物分布均表现出明显的表聚性特征,0~15 cm土层微生物数量显著高于15~30 cm土层,这是表层土较下层土更适宜的温度、湿度、通透性、活性养分等环境特征导致的结果,与陈莉莉等[19]和戴雅婷等[23]的研究结果一致;微生物数量季节变化具有一定的规律性,细菌、真菌、放线菌生长高峰分别出现在秋、夏、春季,是温湿度变化、凋落物分解、生物竞争、生化过程等多种因素共同作用的结果。土壤酶活性大小在不同模式中表现不同,林草复合模式的土壤酶活性高于核桃(无植草)、纯柏,这与不同模式的生境条件、枯枝落叶化学组分的差异及植物群落结构有关,建植不同林草模式能改变原有的土壤性质,起到改良土壤的作用;上层的土壤酶活性明显高于下层,这些变化与土壤水热条件、植物生长节律有关,该研究结果与陶宝先等[24]、托尔坤等[25]、刘云鹏等[26]的研究结果一致。研究还发现,种植苜蓿加大了土壤上、下层微生物数量及酶活性的变化幅度,造成该结果的原因还待进一步研究;土壤酶活性季节变化规律不一,过氧化氢酶活性高峰期出现在秋季,其余3种酶皆出现在春季,这与不同季节气候变化、各类牧草根系的发育特征及更新有密切关系。微生物数量与过氧化氢酶、蔗糖酶、脲酶及碱性磷酸酶表现出不同程度的相关性,反映出微生物数量增加促进了土壤生化过程发生,有利于土壤养分活化,从而提高了土壤质量,王丽等[27]、向泽宇等[28]、孙翠玲等[18]、张明明[29]、李国梁[30]和苑力晖[31]对微生物与酶活性相关性研究结果也间接证明了土壤微生物数量可作为评价土壤肥力的指标。
与未改造的柏木低效纯林相比,不同改造模式的微生物数量及酶活性均有不同程度的增加,而与单纯的核桃改造模式相比,核桃中引进牧草改造模式具有一定的优势。由此可见,单纯引入核桃改造效果较弱,而引入牧草营造林草复合模式的改造效果显著,不仅可以提高土地利用率,增加经济效益,同时能充分发挥不同牧草保土肥田、改善土壤结构、提高土壤肥力等功效[32]。
| [1] |
周立江. 低效林评判与改造途径的探讨[J]. 四川林业科技, 2004, 25(1): 16-21. DOI:10.3969/j.issn.1003-5508.2004.01.003 (  0) 0) |
| [2] |
佘济云, 曾思齐, 陈彩虹. 低效马尾松水保林林下植被及生态功能恢复研究: Ⅰ恢复技术优化经营模式[J]. 中南林业调查规划, 2002, 21(2): 1-3. DOI:10.3969/j.issn.1003-6075.2002.02.001 (  0) 0) |
| [3] |
潘开文, 杨冬生, 江心. 马尾松低效防护林多层经营技术研究[J]. 四川农业大学学报, 1995, 13(2): 188-191. (  0) 0) |
| [4] |
徐东, 胡玉芳, 刘光兰. 柏木长防低效林的形成原因及改造措施探讨[J]. 重庆林业科技, 2007(1): 35-36. (  0) 0) |
| [5] |
ZELLES L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characteri-sation of microbial communities in soil:A review[J]. Biol Fertil Soils, 1999, 29(2): 111-129. DOI:10.1007/s003740050533 (  0) 0) |
| [6] |
中国科学院南京土壤研究所微生物室. 土壤微生物研究法[M]. 北京: 科学出版社, 1985, 54-59.
(  0) 0) |
| [7] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986, 274-339.
(  0) 0) |
| [8] |
张鼎华, 杨玉盛, 吴擢溪, 等. 马尾松木荷混交林土壤微生物及肥力的初步研究[J]. 林业科技通讯, 1988(9): 6-8. (  0) 0) |
| [9] |
何振立. 土壤微生物量及其在养分循环和环境质量评价中的意义[J]. 土壤, 1997, 29(2): 61-69. (  0) 0) |
| [10] |
王海英, 宫渊波, 龚伟. 不同林分土壤微生物、酶活性与土壤肥力的关系研究综述[J]. 四川林勘设计, 2005(3): 10-13. (  0) 0) |
| [11] |
王冬梅, 王春枝, 韩晓日, 等. 长期施肥对棕壤主要酶活性的影响[J]. 土壤通报, 2006, 37(2): 263-267. DOI:10.3321/j.issn:0564-3945.2006.02.012 (  0) 0) |
| [12] |
章铁, 刘秀清, 孙晓莉. 栗茶间作模式对土壤酶活性和土壤养分的影响[J]. 中国农学通报, 2008, 24(4): 265-268. (  0) 0) |
| [13] |
CAMPELL C D, GRAYSTON S J, HIRST D J. Use of rhizosphere carbon sources in sole carbon source tests to discriminate soil microbial communities[J]. J Microbiol Methods, 1997, 30(1): 33-41. DOI:10.1016/S0167-7012(97)00041-9 (  0) 0) |
| [14] |
张俊忠, 陈秀蓉, 杨成德, 等. 东祁连山高寒草地土壤微生物三大类群的时空动态特征[J]. 水土保持学报, 2008, 22(5): 167-171. DOI:10.3321/j.issn:1009-2242.2008.05.037 (  0) 0) |
| [15] |
马晓梅, 尹林克. 荒漠河岸林植物根际和非根际微生物的季节性变化[J]. 干旱区资源与环境, 2009, 23(5): 166-171. (  0) 0) |
| [16] |
焦如珍, 杨承栋, 屠星南, 等. 杉木人工林不同发育阶段林下植被、土壤微生物、酶活性及养分的变化[J]. 林业科学研究, 1997, 10(4): 373-379. DOI:10.3321/j.issn:1001-1498.1997.04.006 (  0) 0) |
| [17] |
殷国兰. 岷江干旱河谷辐射松人工林土壤微生物和酶活性动态[D]. 雅安: 四川农业大学, 2007.
(  0) 0) |
| [18] |
孙翠玲, 郭玉文, 佟超然, 等. 杨树混交林地土壤微生物与酶活性的变异研究[J]. 林业科学, 1997, 33(6): 488-497. DOI:10.3321/j.issn:1001-7488.1997.06.002 (  0) 0) |
| [19] |
陈莉莉, 王得祥, 于飞, 等. 松栎混交林土壤微生物数量与土壤酶活性及土壤养分关系的研究[J]. 土壤通报, 2014, 45(1): 78-84. (  0) 0) |
| [20] |
万忠梅, 吴景贵. 土壤酶活性影响因子研究进展[J]. 西北农林科技大学学报(自然科学版), 2005, 33(6): 87-92. DOI:10.3321/j.issn:1671-9387.2005.06.019 (  0) 0) |
| [21] |
付刚, 刘增文, 崔芳芳. 秦岭山区典型人工林土壤酶活性、微生物及其与土壤养分的关系[J]. 西北农林科技大学学报(自然科学版), 2008, 36(10): 88-94. DOI:10.3321/j.issn:1671-9387.2008.10.016 (  0) 0) |
| [22] |
李玥, 张金池, 王丽, 等. 上海市沿海防护林土壤微生物三大类群变化特征[J]. 南京林业大学学报(自然科学版), 2010, 34(1): 43-47. DOI:10.3969/j.issn.1000-2006.2010.01.010 (  0) 0) |
| [23] |
戴雅婷, 侯向阳, 王慧, 等. 鄂尔多斯沙地油蒿根际土壤微生物数量的季节动态[J]. 干旱区资源与环境, 2012, 26(10): 103-107. (  0) 0) |
| [24] |
陶宝先, 张金池, 愈元春, 等. 苏南丘陵地区森林土壤酶活性季节变化[J]. 生态环境学报, 2010, 19(10): 2349-2354. DOI:10.3969/j.issn.1674-5906.2010.10.015 (  0) 0) |
| [25] |
托尔坤·买买提, 于磊, 鲁为华, 等. 不同生长年限苜蓿对土壤酶活性与养分的影响[J]. 草业科学, 2010, 27(11): 21-25. (  0) 0) |
| [26] |
刘云鹏, 申卫博, 张社奇, 等. 黄河中游湿地土壤养分与酶活性特征及相关性研究[J]. 草地学报, 2013, 21(3): 475-478. (  0) 0) |
| [27] |
王丽, 刘霞, 张光灿, 等. 黄前水库集水区水源保护林地土壤微生物及酶活性时空变化[J]. 中国水土保持, 2012(1): 36-40. DOI:10.3969/j.issn.1000-0941.2012.01.014 (  0) 0) |
| [28] |
向泽宇, 王长庭, 宋文彪, 等. 草地生态系统土壤酶活性研究进展[J]. 草业科学, 2011, 28(10): 1801-1806. (  0) 0) |
| [29] |
张明明. 改变碳输入对樟树林土壤微生物数量和土壤酶活性的影响[D]. 长沙: 中南林业科技大学, 2012.
(  0) 0) |
| [30] |
李国梁. 柏木低效林不同改造模式土壤微生物和土壤酶活性研究[D]. 雅安: 四川农业大学, 2012.
(  0) 0) |
| [31] |
苑力晖. 沙坡头不同沙地微生物数量动态及土壤酶活性研究[D]. 兰州: 甘肃农业大学, 2008.
(  0) 0) |
| [32] |
安道渊, 黄必志, 吴伯志. 间作牧草的经济、生态效益研究进展[J]. 四川草原, 2005, 111(2): 10-13. DOI:10.3969/j.issn.1673-8403.2005.02.005 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37