药代动力学(Pharmacokinetics,简称药动学)主要研究药物在体内的吸收、分布、代谢与棑泄过程及其动态变化规律。研究发现一些疾病可以改变药物的吸收、分布、代谢及棑泄,而病理模型的药动学研究,尤其是疾病对抗菌药的药动学影响,已成为兽医药动学研究的重要内容。因此,开展抗菌药在疾病机体的药动学研究,将能更有效、更有针对性地制订给药方案,指导临床合理用药[1]。自从抗生素时代的到来,动物感染模型就被广泛用于评估抗生素在临床治疗时的药效,而中性粒细胞减少的小鼠大腿模型和肺炎模型等也被广泛用于抗生素药物的PK/PD研究中[2-3],从动物模型上得到的药效结果能够较好地指导其在人医及兽医上的合理用药[4]。多杀性巴氏杆菌Pasteurella multocida是一种可引起多种动物及人类感染发病的重要人畜共患性病原菌,对养殖业危害严重,马波沙星(Marbofloxacin)对多杀性巴氏杆菌有较强的抗菌活性,本文探讨马波沙星在健康小鼠和肺部感染多杀性巴氏杆菌小鼠体内的药动学特征,旨在为临床制订合理的给药方案提供理论依据。
1 材料与方法 1.1 材料 1.1.1 仪器与试剂高效液相色谱仪:Waters Alliance2695型,包含四元梯度高精密度输液泵、2475型荧光检测器、真空在线脱气系统。色谱分析柱:Hypersil BDS-C18,5 μm,4.6 mm×250 mm,美国Thermo公司。Y型留置针:规格:0.9 mm(22 G)。
马波沙星制剂:规格为50 mL:5 g,保定冀中药业有限公司产品;马波沙星对照品质量分数为99.0%,氧氟沙星(Ofloxacin)对照品质量分数为98.2%,均购自中国兽医药品监察所;环磷酰胺,阿拉丁试剂公司产品;戊巴比妥钠为翔博生物公司产品。三氯甲烷,氢氧化钠,磷酸氢二铵和四丁集溴化铵均为国产分析纯试剂。
1.1.2 溶液配制马波沙星标准储备液(1 000 μg·mL-1):精密称取马波沙星对照品50.50 mg于50 mL棕色容量瓶中,用少量0.1 moL·L-1的NaOH溶液助溶,以超纯水定容至刻度,置于-20 ℃冰箱保存。
氧氟沙星(内标)储备液:精密称取10.18 mg氧氟沙星对照品于100 mL棕色容量瓶中,以超纯水溶解定容至刻度,置于-20 ℃冰箱保存。
磷酸氢二铵-四丁基溴化铵缓冲液:准确称取4 g磷酸氢二铵和4 g四丁基溴化铵,超纯水溶解后,用磷酸调节pH至2.7,定容至1 L,经0.22 μm滤膜过滤后,超声脱气,备用。
0.01 g·mL-1戊巴比妥钠溶液:准确称取0.1 g戊巴比妥钠,溶于10 mL生理盐水中,用0.22 μm滤膜,过滤除菌,现配现用。
1.1.3 试验动物与菌株6周龄雌性SPF-ICR小鼠,体质量22~25 g,购自广东省医学实验动物中心。购买后自由采食,观察1周,未出现任何异常反应,进行试验。
多杀性巴氏杆菌CVCC411,Heddleston血清型:2,购自中国兽医药品监察所。
1.2 方法 1.2.1 建立小鼠肺部感染模型制备多杀性巴氏杆菌菌液:将冻存的多杀性巴氏杆菌CVCC411菌种复苏,接种于胰蛋白大豆肉汤培养基(TSB)中,培养至对数期时,4 ℃,4 000 r·min-1离心富集,用生理盐水重悬浮菌液,调整菌液浓度为108 CFU·mL-1,备用。
小鼠肺部感染模型:在小鼠肺部感染前,建立小鼠中性粒细胞减少症模型,即小鼠按剂量150 mg·kg-1·d-1 ,连续腹腔注射环磷酰胺4 d,小鼠再按剂量100 mg·kg-1·d-1腹腔注射环磷酰胺1 d,然后通过小鼠后眼眶静脉丛穿刺采血,若中性粒细胞数量<100 mm-3,则小鼠达到免疫抑制,可以进行下一步试验[5-6]。
小鼠肺部感染多杀性巴氏杆菌采用气管插管法,操作步骤如下:用胶带将Y型静脉留置针PVC软管横向固定在木板上缘(软管水平放置),预先注入0.05 mL上述制备的多杀性巴氏杆菌菌液在软管内;使用0.01 g·mL-1戊巴比妥钠溶液50 mg·kg-1麻醉小鼠,待小鼠舌头可以拉出至口腔外时,用丝线挂住小鼠门牙将小鼠悬挂在60°倾斜的木板上;透射灯对准小鼠颈部打开光源;调整小鼠倾斜角度,直至通过口腔可清晰看到声门裂,手持套管针通过声门裂,此时若成功插入气道,事先注入套管针管内液体会随着呼吸左右波动,以此确认插管成功;用0.8 mL气体将菌液冲入气道内,迅速从气道拔出套管针,悬挂约5~10 s后将小鼠放下保温[7-9]。
小鼠肺部感染多杀性巴氏杆菌后,小鼠于感染后2、5、10、24 h分别处死,无菌取出小鼠的肺部,置于无菌玻璃研磨器内,加入5 mL的无菌生理盐水,研磨均匀,吸取0.1 mL菌液系列倍比稀释,从每管稀释液中吸取20 μL稀释液,分别悬滴于1/4的TSA琼脂平板上,晾干后置于37 ℃培养箱中培养18~24 h,平板进行细菌计数,单位为CFU。
1.2.2 小鼠血浆中马波沙星的检测方法色谱条件及工作指标:流动相为V(四丁基溴化铵-磷酸氢二铵缓冲液):V(甲醇)= 75:25;流速为0.8 mL·min-1;荧光检测器激发波长为295 nm,发射波长为500 nm。
样品的前处理:根据单奇[10]报道的方法做了修改,血浆样品解冻后,吸取100 μL样品于离心管中,加入10 μL氧氟沙星,涡旋混匀,然后加入3 mL三氯甲烷,充分涡旋后,6 000 r·min-1离心10 min,将下层有机相转移至试管中,在40 ℃水浴下吹干,用200 μL流动相溶解,经0.22 μm滤膜过滤,置于进样瓶内。20 μL样品供HPLC分析。
标准曲线的制备:取适量马波沙星标准储备液(1 000 μg·mL-1),用超纯水稀释成50.0、20.0、10.0、5.0、1.0、0.5、0.1 μg·mL-1的系列工作液。将上述工作液系列添加于空白小鼠血浆中,并添加一定量氧氟沙星,得到一系列标准添加样品,涡旋混匀,按照上述“样品的前处理”方法处理后,取20 μL样品供HPLC分析,以马波沙星与内标的色谱峰面积之比(S)为横坐标,以添加的药物质量浓度(C)为纵坐标,得到标准曲线方程和相关系数。
1.2.3 马波沙星在感染小鼠和健康小鼠体内的药动学研究中性粒细胞减少的小鼠气管接菌108 CFU·mL-1,50 μL的多杀性巴氏杆菌CVCC411,肺部感染10 h后,将小鼠分为6组,每组4只,共24只感染小鼠,按小鼠体质量单剂量皮下注射2 mg·kg-1的马波沙星,采样时间点为0.083、0.25、0.5、0.75、1、2、4、6、8、12和24 h。每组的4只小鼠采取拼点法通过后眼眶静脉丛采血[11],即4只感染小鼠的血样浓度拼成1条药动学曲线,每个时间点有6个重复。未感染的健康小鼠共24只,按2 mg·kg-1剂量皮下注射马波沙星,分组和血样采集点与感染小鼠的分组和采样点一致,将采集的血液置于含肝素抗凝剂的离心管中,离心10 min(4 ℃、4 000 r·min-1),将血浆保存于-20 ℃条件下,待测。血浆样品浓度的测定如“1.2.2”中“样品前处理”所述。
2 结果与分析 2.1 小鼠气管插管法成功率试验中共成功进行100多次小鼠气管插管。插管后的小鼠成活率达到90%以上,少数小鼠死亡的原因是由于插管时间过长,导致小鼠窒息,或者补气速度过快,导致肺气肿。气管插管、滴注操作本身耗时为每只动物0.5~1 min,但由于麻醉处理及其他准备操作耗时,平均每只动物耗时5~6 min(每批约为30次操作)。
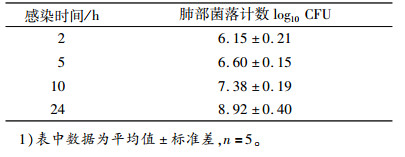
2.2 巴氏杆菌在感染小鼠肺部的生长结果Y型留置针软管内的多杀性巴氏杆菌菌液量为106.81 CFU,小鼠气管插管接菌后,小鼠于感染后2、5、10、24 h处死,无菌取出肺部,研磨,进行细菌计数。巴氏杆菌在小鼠肺部生长的各时间点的细菌数量如表 1所示。
|
|
表 1 不同时间点多杀性巴氏杆菌在小鼠肺内的细菌数量1) Table 1 Colony counts of Pasteurella multocida in the lungs of infected mice at different time |
由表 1可以看出,该气管插管法平行性较好,使得小鼠的肺部接菌量较为一致,感染2 h后测得的小鼠肺部菌量略少于初始的接菌量,表明通过该气管插管法,大部分的菌液均分散于肺部中,小鼠感染10 h时,肺部菌量大约达到107.5 CFU,而且小鼠表现出嗜睡,呼吸急促,没有食欲等临床症状,以此作为给药治疗的起始点。小鼠感染24 h后,表现出极度呼吸困难,结膜炎,濒临死亡的症状。
2.3 检测方法的特异性小鼠血浆中马波沙星在0.01~5.00 μg·mL-1范围内线性良好,绝对回收率≥81.81%,批内变异系数为1.74%~7.67%,批间变异系数为5.60%~6.70%,小鼠血浆中马波沙星的定量限为0.01 μg·mL-1,检测限为0.005 μg·mL-1。
根据试验得到的色谱图,马波沙星的保留时间是9.28 min,而氧氟沙星的保留时间是12.18 min,马波沙星和内标氧氟沙星分开,峰形良好,附近无杂质峰干扰。
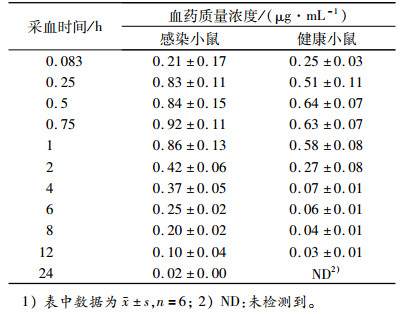
2.4 马波沙星在感染和健康小鼠体内药动学比较健康的小鼠和肺部感染多杀性巴氏杆菌10 h后的小鼠,分别单剂量皮下注射马波沙星(2 mg·kg-1)获得不同时间点血药质量浓度的实测值,见表 2。
|
|
表 2 健康和感染多杀性巴氏杆菌的小鼠单剂量皮下注射2 mg·kg-1马波沙星后的血药浓度1) Table 2 Plasma concentration of marbofloxacin after a single subcutaneous administration (2 mg·kg-1) in healthy mice and in mice with Pasteurella multocida infection |
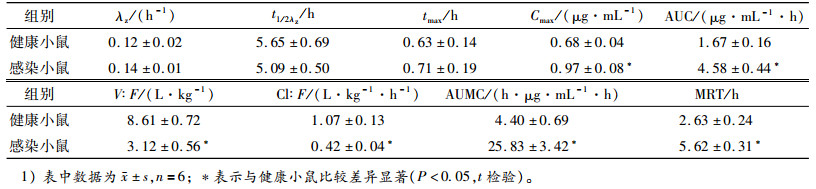
健康和感染的小鼠单剂量皮下注射马波沙星后,血浆中马波沙星的药物浓度-时间数据采用WinNolin5.2.1软件提供的非房室模型进行处理。根据血药浓度-时间数据,计算得到药动学参数见表 3。
|
|
表 3 健康和感染的小鼠皮下注射马波沙星(2 mg·kg-1)的药代动力学参数1) Table 3 Pharmacokinetic parameters of marbofloxacin after a single subcutaneous administration (2 mg·kg-1) in healthy and infected mice |
用统计学软件SPSS对表 3中的药动学参数进行t检验统计学分析,结果表明,马波沙星在感染小鼠体内的峰质量浓度(Cmax),药时曲线下面积(AUC),表观分布容积(V/F),体清除率(Cl/F),一阶矩曲线下面积(AUMC),平均滞留时间(MRT)与在未感染小鼠体内的值有显著性差异(P<0.05)。而马波沙星在感染小鼠体内的半衰期和达峰时间与在健康小鼠体内的值差异不显著(P>0.05)。
3 讨论与结论 3.1 关于小鼠肺部感染的方法选择研究马波沙星在小鼠肺部感染多杀性巴氏杆菌情况下的药动学,最基础的工作是建立小鼠肺部感染模型。药动学研究是多样本的重复、统计的过程,重复包括相同和不同时间的重复,要求动物间的个体差异要小,得出的药动学参数才有统计学意义。因此在小鼠肺部感染方法的选择上,笔者进行了多种尝试。
参考Craig等[2]采用的小鼠滴鼻法,小鼠麻醉后,用移液器吸取108 CFU的肺炎链球菌菌液50 μL,进行小鼠滴鼻。经过多次重复试验,结果表明,该法并不适用。因为50 μL的菌液并不能完全吸入肺部,而是大部分留在鼻腔中,部分小鼠能够感染,而部分小鼠不能够感染,使得动物间的感染差异很大,试验的重复性不好。而采用暴露气管法进行小鼠肺部感染时,该法创伤性较大,小鼠手术后存活率较低,不利于后续的研究,因此不采用该法。
借鉴Ferran等[12]小鼠肺部感染巴氏杆菌的方法,将导管从口腔中插入气管,将菌液注射入肺部,但其使用的是光纤引入口腔内照明的自制设备进行气管插管,设计成本高。因此参考贾晓峰等[9]的小鼠气管插管法,并做了相应的改进,利用简单的Y型留置针,冷光源及自制的小鼠固定简易装置,就能迅速,准确地进行小鼠肺部感染。
3.2 多杀性巴氏杆菌在小鼠肺部的生长小鼠感染多杀性巴氏杆菌后,肺部细菌数量随着感染的时间持续增长,感染10 h时,小鼠出现嗜睡,呼吸急促,没有食欲等临床症状,此时开始皮下注射马波沙星,以模拟临床实际过程中出现症状开始给药治疗。Ferran等[12]的研究中,小鼠肺部初始感染多杀性巴氏杆菌, 肺部菌量为1 000 CFU,感染32 h时,肺部菌量达到106~109 CFU,而小鼠表现出呼吸困难,嗜睡,脱水的临床症状,马波沙星于这个时间点开始给药。以模拟临床上出现病症后的给药治疗,本研究中小鼠给药治疗前的肺部多杀性巴氏杆菌的菌量为107 CFU,小鼠表现出呼吸急促的症状,与Ferran等[12]报道的感染32 h后给药相似,因此得到的数据具有可比性。
3.3 马波沙星在小鼠体内的药动学研究Ferran等[12]报道小鼠感染32 h后腹腔注射10 mg·kg-1的马波沙星得到的AUC为27 μg·mL-1·h,体清除率为0.370 L·kg-1·h-1,Cmax为6.1 μg·mL-1,马波沙星在感染小鼠体内的药动学为线性药动学,即获得的AUC和Cmax与给药剂量成正比。而本试验2 mg·kg-1马波沙星在感染小鼠体内的AUC为4.58 μg·mL-1·h,体清除率为0.42 L·kg-1·h-1,Cmax为0.97 μg·mL-1,与Ferran等[12]报道的一致。
本试验结果显示马波沙星在感染小鼠体内得到的AUC为4.58 μg·mL-1·h、Cmax为0.97 μg·mL-1、MRT为5.62 h,均高于(P<0.05)在健康小鼠体内得到的AUC(1.67 μg·mL-1·h)、Cmax(0.68 μg·mL-1)、MRT (2.63 h),而表观分布容积3.12 L·kg-1和体清除率0.42 L·kg-1·h-1均低于(P<0.05)健康小鼠体内的表观分布容积(8.61 L·kg-1)和体清除率(1.07 L·kg-1·h-1)。这表明急性的多杀性巴氏杆菌感染能够显著地改变马波沙星在动物体内的分布、消除和代谢,感染动物体内体清除率下降可能是由于多杀性巴氏杆菌产生的内毒素使得动物肝、肾组织遭到破坏,从而使得药物的代谢变慢。
Ferran等[13]和Kesteman等[14]的研究中均表明动物感染部位的菌量的高低会改变药物的药动学参数,Ismail等[15]研究了马波沙星在健康奶牛和溶血性曼氏杆菌感染奶牛血浆的药动学特征,研究发现,马波沙星在感染牛体内AUC明显增大,高达25.54 μg·mL-1·h,而健康奶牛的AUC仅为12.00 μg·mL-1·h。Abo-El-Sound等[16]研究了多杀性巴氏杆菌感染对马波沙星在兔体内肌注和静注后药动学特征的影响,结果表明马波沙星在感染兔体内的Cmax、MRT、AUC及t1/2β均高于健康兔体内得到的值,而体清除率低于健康兔体内得到的值。
氟喹诺酮类抗菌谱较广,为浓度依赖性药物。研究表明,当氟喹诺酮类药物达到AUC/MIC≥125 h、Cmax/MIC≥10时,其对临床病原菌起到很好的抗菌效果,而且Cmax/MIC为8~10,能减少药物耐药性的产生[16]。从本研究结果可以看出,马波沙星在感染动物体内将达到更高的AUC/MIC和Cmax/MIC,因此可以达到优化临床给药剂量并减少药物耐药性的效果。
| [1] |
黄显会, 陈杖榴, 张淑婷, 等. 禽多杀性巴氏杆菌感染对麻保沙星在鸡体内药动学特征的影响研究[J]. 畜牧兽医学报, 2003, 34(01): 98-102. DOI:10.3321/j.issn:0366-6964.2003.01.020 (  0) 0) |
| [2] |
CRAIG W A, ANDES D R. In vivo pharmacodynamics of ceftobiprole against multiple bacterial pathogens in murine thigh and lung infection models[J]. Antimicrob Agents Chemother, 2008, 52(10): 3492-3496. DOI:10.1128/AAC.01273-07 (  0) 0) |
| [3] |
WANG J, SHAN Q, DING H, et al. Pharmacodynamics of cefquinome in a neutropenic mouse thigh model of Staphylococcus aureus infection[J]. Antimicrob Agents Chemother, 2014, 58(6): 3008-3012. DOI:10.1128/AAC.01666-13 (  0) 0) |
| [4] |
AMBROSE P G, BHAVNANI S M, RUBINO C M, et al. Pharmacokinetics-pharmacodynamics of antimicrobial therapy: It's not just for mice anymore[J]. Clinical Infectious Diseases, 2007, 44(1): 79-86. DOI:10.1086/cid.2007.44.issue-1 (  0) 0) |
| [5] |
SHAN Q, LIANG C, WANG J, et al. In vivo activity of cefquinome against Escherichia coli in the thighs of neutropenic mice[J]. Antimicrob Agents Chemother, 2014, 58(10): 5943-5946. DOI:10.1128/AAC.03446-14 (  0) 0) |
| [6] |
ANDES D, CRAIG W A. Pharmacodynamics of the new fluoroquinolone gatifloxacin in murine thigh and lung infection models[J]. Antimicrob Agents Chemother, 2002, 46(6): 1665-1670. DOI:10.1128/AAC.46.6.1665-1670.2002 (  0) 0) |
| [7] |
RIVERA B, MILLER S, BROWN E, et al. A novel method for endotracheal intubation of mice and rats used in imaging studies[J]. Contemp Top Lab Anim Sci, 2005, 44(2): 52-55. (  0) 0) |
| [8] |
MACDONALD K D, CHANG H Y, MITZNER W. An improved simple method of mouse lung intubation[J]. J Appl Physiol, 2009, 106(3): 984-987. DOI:10.1152/japplphysiol.91376.2008 (  0) 0) |
| [9] |
贾晓峰, 郭新彪. 改进型快速小鼠气管滴注法-透射灯下经口直视滴注法研究[J]. 环境与健康杂志, 2012, 29(3): 217-218. (  0) 0) |
| [10] |
单奇. 马波沙星和头孢喹肟对多杀性巴氏杆菌药动-药效学整合模型研究[D]. 广州: 华南农业大学, 2013.
(  0) 0) |
| [11] |
SAFDAR N, ANDES D, CRAIG W A. In vivo pharmacodynamic activity of daptomycin[J]. Antimicrob Agents Chemother, 2004, 48(1): 63-68. DOI:10.1128/AAC.48.1.63-68.2004 (  0) 0) |
| [12] |
FERRAN A A, TOUTAIN P L, BOUSQUET-MELOU A. Impact of early versus later fluoroquinolone treatment on the clinical; microbiological and resistance outcomes in a mouse-lung model of Pasteurella multocida infection[J]. Vet Microbiol, 2011, 148(2/3/4): 292-297. (  0) 0) |
| [13] |
FERRAN A A, KESTEMAN A S, TOUTAIN P L, et al. Pharmacokinetic/pharmacodynamic analysis of the influence of inoculum size on the selection of resistance in Escherichia coli by a quinolone in a mouse thigh bacterial infection model[J]. Antimicrob Agents Chemother, 2009, 53(8): 3384-3390. DOI:10.1128/AAC.01347-08 (  0) 0) |
| [14] |
KESTEMAN A S, FERRAN A A, PERRIN-GUYOMARD A, et al. Influence of inoculum size and marbofloxacin plasma exposure on the amplification of resistant subpopulations of Klebsiella pneumoniae in a rat lung infection model[J]. Antimicrob Agents Chemother, 2009, 53(11): 4740-4748. DOI:10.1128/AAC.00608-09 (  0) 0) |
| [15] |
Ismail M, El-Kattan Y A. Comparative pharmacokinetics of marbofloxacin in healthy and Mannheimia haemolytica infected calves[J]. Res Vet Sci, 2007, 82(3): 398-404. DOI:10.1016/j.rvsc.2006.10.001 (  0) 0) |
| [16] |
ABO-EL-SOOUD K, GOUDAH A. Influence of Pasteurella multocida infection on the pharmacokinetic behavior of marbofloxacin after intravenous and intramuscular administrations in rabbits[J]. J Vet Pharmacol Ther, 2010, 33(1): 63-68. DOI:10.1111/jvp.2010.33.issue-1 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37