农药的使用有效地控制了病虫草害,在保证粮食安全上发挥了巨大作用,但也产生了许多负面影响。传统施药方式以叶面喷雾为主,靶标性差,利用率极低,既造成了浪费,又严重污染环境[1]。在保持或提高防效的基础上,减少农药用量一直是研究者的探索方向[2],内吸性农药的研究应用在这方面具有显著成效。农药内吸性是指农药能从植物体表进入植物体内并通过维管系统向其他部位传导的能力[3]。内吸性农药能够通过植物根、茎、叶吸收进入植物体内,再经由韧皮部或木质部向其他部位转运,从而使得农药在植物体内形成系统性的分布[4-5]。这一特点使其对于刺吸式口器的害虫和维管束病害具有良好防效。
内吸性农药在进入植物体内后的长距离运输主要通过植物木质部与韧皮部:韧皮部输导随光合作用产物,由“源”向“库”运输,多数为向下输导[6];木质部输导随蒸腾流运输,沿木质部导管向上输导,一般在叶片处积累。目前的内吸性农药多属于木质部输导,螺虫乙酯是唯一被证明的具有双向输导能力的商品化杀虫剂[7-8]。徐汉虹等[2]在研究植物源农药的基础上,提出导向农药的理念:利用导向载体将农药活性成分运载到害虫为害的靶标部位。并研发能双向输导并具有导向作用的新型内吸性农药。在前期研究中发现,导向基团葡萄糖与杀虫剂氟虫腈拼接得到葡萄糖基氟虫腈偶合物(GTF),在蓖麻植株上的试验表明,偶合物具有良好的韧皮部输导性,而母体化合物氟虫腈并没有这一特性[9]。同时,利用蓖麻体系,初步研究了3 h内GTF与氟虫腈的木质部输导性差异,结果表明GTF木质部输导性更强[10-14]。然而,相比已经商品化的内吸性农药,GTF在木质部输导性上是否具有优势却并未报道。因此,为进一步研究偶合物GTF的木质部输导性,笔者选取强内吸农药噻虫嗪,母体农药氟虫腈以及渗透性农药阿维菌素作为对照,比较并评价这4种农药的木质部输导性。选用典型的质外体装载植物大豆作为供试材料[15],利用浸根施药法,既可以保证吸收部位与药剂的充分接触,又可以准确地定量分析[16]。分别研磨并提取植株根、茎、叶3部分吸收的药物,通过高效液相色谱(HPLC)检测,分析其由根部向地上部分的输导量,评价这4种农药的木质部输导性。
1 材料与方法 1.1 供试材料与主要仪器 1.1.1 供试农药糖基氟虫腈偶合物GTF原粉,华南农业大学天然农药与化学生物学教育部重点实验室合成;质量分数为97%的氟虫腈原药,浙江海正化工股份有限公司;质量分数为98%的噻虫嗪原药,河北昊阳化工有限公司;质量分数为97%的阿维菌素原药,河北威远生物化工股份有限公司。
1.1.2 植物材料选取外观一致的大豆Glycine max种子,置于蛭石中培养。人工气候培养箱培养,温度(26±1)℃,湿度(80±5)%,白天光照12 h,光照强度1 000 lx,夜晚关闭。培养约10 d后,待幼苗长出2片真叶,选出长势一致的大豆幼苗作为供试植物材料。
1.1.3 主要仪器与试剂Agilent1100高效液相色谱仪,C18反相高效液相色谱柱,5 μm, 250 mm×4.6 mm,美国Agilent公司;BSA224S型万分之一电子天平,德国Sartorious Gmbh Gottingen公司;移液枪,北京吉尔森科技有限公司;0.22 μm有机相微孔滤膜,上海兴亚净化材料厂;色谱级甲醇、乙腈,瑞典Oceanpak试剂公司。
1.2 试验方法 1.2.1 施药方法准确称取一定量GTF原粉,溶于二甲基亚砜(DMSO),配成20 mmol·L-1的GTF母液。取50 mL离心管,加入40 mL浓度为0.5 mmol·L-1的CaCl2溶液与0.1 mL母液,配制成50 μmol·L-1的GTF水培药液,将大豆幼苗根部浸于此药液中。同时设置等浓度CaCl2溶液作为对照(CK)。置于人工气候培养箱中培养。
1.2.2 样品前处理处理3、6、12和24 h后取出植株,根部用体积分数为10%的丙酮水溶液洗涤3次,再用清水润洗1次后擦干,除去表面的残留药液与水分。整株分为根、茎、叶3部分,称鲜质量。分别置于研钵中,添加少量石英砂并磨碎,加入10 mL甲醇,超声萃取15 min,取1 mL萃取液于1.5 mL离心管,设置离心机转速为13 000 r·min-1,离心5 min,取其上清液,微孔滤膜过滤后置于液相瓶中,低温保存待测。平行重复3次。另外3种药剂按上述施药与样品前处理方法处理。
1.2.3 高效液相色谱法测定植株药物含量C18反相高效液相色谱柱,进样10 μL,流速1 mL·min-1,柱温25 ℃。GTF流动相为V(乙腈):V(水)=50:50,检测波长210 nm;氟虫腈流动相为V(乙腈):V(水)=80:20,检测波长210 nm;噻虫嗪流动相为V(乙腈):V(水)=20:80,检测波长254 nm;阿维菌素流动相为V(乙腈):V(水)=65:35,检测波长245 nm。
1.2.4 标准曲线制作移液枪准确吸取一定量的GTF母液,用甲醇溶解,配制成浓度分别为1.0、2.5、5.0、10.0、25.0、50.0、100.0 μmol·L-1的标准溶液,在上述色谱条件下,每个浓度进样3次,测量峰面积值;以标样溶液峰面积平均值y与标准溶液浓度x (μmol·L-1)进行线性回归。并根据回归方程和样品峰面积,计算样品中GTF的浓度。另外3种药剂按上述方法处理。
1.2.5 添加回收率试验分别准确添加GTF25、50、100 μmol·L-1标准溶液1 mL与植株各部分空白样品,按“1.2.2”方法处理样品,按“1.2.3”中液相分析条件检测。平行重复3次,计算平均添加回收率。另外3种药剂按上述方法处理。
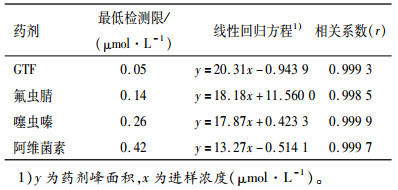
2 结果与分析 2.1 4种药剂的标准曲线与最低检测限分别用1.0、2.5、5.0、10.0、25.0、50.0、100.0 μmol·L-1的4种药剂标准溶液,按上述HPLC条件进行分析,保留时间都能与杂质较好地分离。药剂峰面积(y)对进样浓度(x)的线性回归方程见表 1。在试验浓度范围内,4种药剂的响应值与其浓度均成良好的线性范围,可进行HPLC的定量分析。最低检测限按照信噪比(S/N)等于3进行计算,在上述HPLC测定条件下,4种药剂最低检测限见表 1。
|
|
表 1 4种农药的线性回归方程与相关系数 Table 1 Regression equations and correlation coefficients of four types of pesticides |
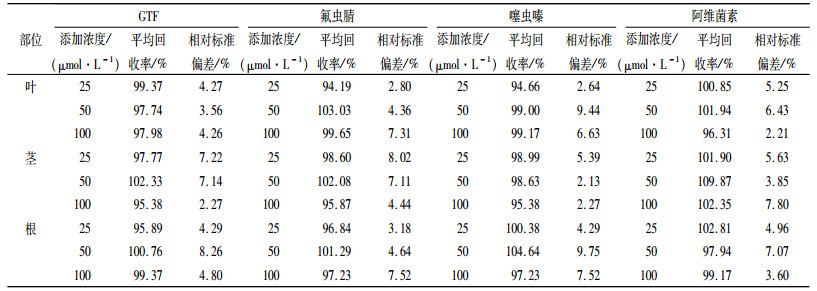
由表 2可见,GTF、氟虫腈、噻虫嗪和阿维菌素4种药剂在3个添加浓度时,大豆植株各部位的回收率分别为95.38%~102.33%、94.19%~103.03%、94.66%~104.64%、96.31%~109.87%,相对标准偏差分别为2.27%~8.26%、2.80%~8.02%、2.13%~9.75%、2.21%~7.80%,符合农药分析要求。
|
|
表 2 4种农药在大豆植株各部位的回收率及相对标准偏差 Table 2 Recovery rates and relative standard deviations of four types of pesticides in different parts of soybean seedlings |
4个标样与其对应样品的保留时间均保持一致,表明4种农药均能在样品中检测到(图 1)。

|
图 1 4种农药标样及样品的高效液相色谱分析 Figure 1 Analysis of standards and samples of four pesticides by HPLC ——:标样;——:根部样品;——:茎部样品;——:叶部样品。 |
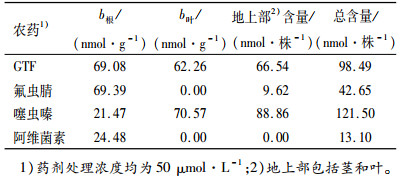
药液处理3 h后,分别研磨提取大豆植株根、茎、叶中药物,HPLC检测结果列于表 3。4种药物在大豆根部均可检测到,而叶部仅检测到GTF与噻虫嗪;阿维菌素在植株地上部未检出,仅存在于根部,说明其难以向上输导;氟虫腈地上部为9.62 nmol·株-1,但在叶片中并未检测到,说明其输导至茎部而未到达叶片;噻虫嗪与GTF地上部含量较高,分别为88.86和66.54 nmol·株-1,占各自总含量的73%和68%,说明这2种农药进入根部后,能迅速随蒸腾流沿大豆木质部向地上部分转运,具有高效的木质部输导性,短时间即能完成由根向叶的转运与累积。
|
|
表 3 处理后3 h 4种农药在植株内的分布 Table 3 Distribution of pesticides in soybean seedlings at 3 hours after immersion treatment |
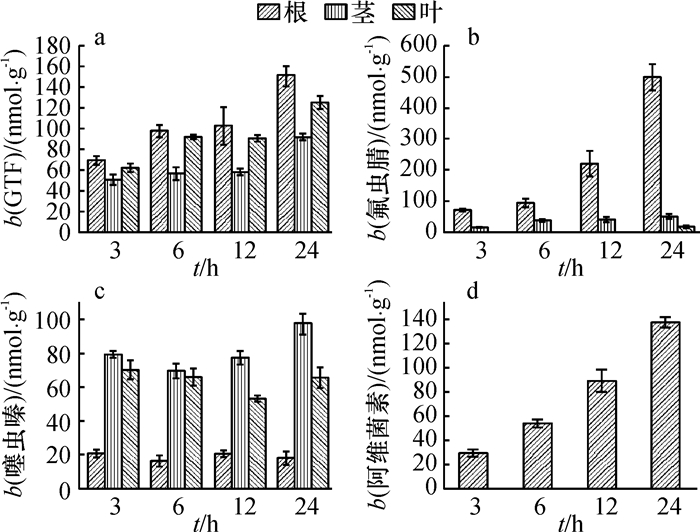
药液处理3、6、12和24 h后,分别研磨提取大豆植株根、茎、叶中药物,高效液相色谱检测结果(图 2)表明:药物处理后,大豆植株的根、茎、叶3部分在各个时间点均可以检测到GTF,三者浓度相近,表明GTF在植株体内呈系统均匀分布,且随着处理时间的增长,植株各部分药剂浓度明显增大,浓度与时间的依赖关系明显;处理6和12 h后,仍然只能在植株根、茎检测到氟虫腈,根部浓度在各个时间点都远高于茎,并随着处理时间的延长而明显增大,显示出明显的根部积累现象;噻虫嗪处理后,对比4个时间点,植株各部分所检测到的药物浓度相近,随时间变化的趋势不明显,表明在3 h之前噻虫嗪的吸收与输导已经达到近似饱和水平;阿维菌素处理的大豆植株,在各个时间点均仅于根部检测出药物,其浓度随时间变化明显,呈线性增长趋势。
|
图 2 药液处理后不同时间4种农药在大豆植株中的分布 Figure 2 Distribution of pesticides in soybean seedlings at different hours after immersion treatment |
药液处理24 h后,分别研磨提取大豆植株根、茎、叶中药物,高效液相色谱检测结果列于表 4。阿维菌素在根部达到最大值132.92 nmol·g-1,地上部仍未检出,未表现出木质部输导性;氟虫腈在根部同样达到最大值499.51 nmol·g-1,远高于其他药剂,但叶部仅检测到微量氟虫腈,地上部含量为41.22 nmol·株-1,仅占总含量的15%,木质部输导性较弱;GTF与噻虫嗪地上部含量较高,分别为127.26和97.23 nmol·株-1,总含量分别为197.29和127.65 nmol·株-1,由此可见,24 h时GTF木质部输导性明显优于噻虫嗪。
|
|
表 4 处理24 h后4种农药在植株内的分布 Table 4 Distribution of pesticides in soybean seedlings at 24 hours after immersion treatment |
本文初步研究了GTF在大豆幼苗上的木质部输导性,并将其与强内吸农药噻虫嗪、母体农药氟虫腈以及渗透性农药阿维菌素作比较。结果表明:GTF具有良好的木质部输导性,由根部吸收进入大豆幼苗后,能系统性均匀分布在植株根、茎、叶中,输导水平与时间的依赖关系明显;噻虫嗪的木质部输导性高效,可迅速完成由根向叶的转运,向顶输导性强,根部积累少,短时间内即达到吸收输导饱和;氟虫腈木质部输导性较弱,进入植株后积累于根部,地上部含量所占比例较低,24 h时叶部仅检测到微量;阿维菌素不具有木质部输导性,仅通过渗透作用进入大豆根部,未沿木质部随蒸腾流向上转运。
前期研究[9-15]仅发现GTF在3 h以内的木质部输导性强于母体农药氟虫腈,但未做进一步研究,且其相对商品化农药是否同样具有优势鲜见报道。本文研究表明,与已经商品化的内吸性农药相比,GTF的木质部输导性更优,具有进一步研究进而商品化的潜力。由以上结果可见,对母体农药作糖基化修饰,可以显著改善其木质部输导性,这为研究开发高效木质部输导性农药提供了新的思路。
利用农药的特性合理施药,可以显著提高农药的利用效率。研究农药木质部输导性,对于农药的实际使用具有一定的指导作用。阿维菌素渗透性强,根部施药后会在根部积累,可用灌根、拌土的施药方式防治根结线虫等地下害虫。噻虫嗪在根部施药后,能高效向植物叶片处输导,适合防治蚜虫、飞虱、粉虱等为害叶片的刺吸式口器害虫,并且具有耐雨水冲刷,持效期长的优点。但在防治蔬菜害虫时,需要考虑施药后的安全间隔期。同时,噻虫嗪也适合于干旱缺水地区的滴灌种植,做到水药一体化,高效环保。
| [1] |
WANG C J, LIU Z Q. Foliar uptake of pesticides:Present status and future challenge[J]. Pestic Biochem Phys, 2007, 87(1): 1-8. (  0) 0) |
| [2] |
徐汉虹, 张志祥, 程东美, 等. 导向农药[J]. 世界农药, 2004, 26(5): 3-9. DOI:10.3969/j.issn.1009-6485.2004.05.002 (  0) 0) |
| [3] |
SICBALDI F, SACCHI G A, TREVISAN M, et al. Root uptake and xylem translocation of pesticides from different chemical classes[J]. Pestic Sci, 1997, 50(2): 111-119. DOI:10.1002/(SICI)1096-9063(199706)50:2<>1.0.CO;2-8 (  0) 0) |
| [4] |
LICHTNER F. Phloem mobility of crop protection products[J]. Aust J Plant Physiol, 2000, 27(6): 609-614. (  0) 0) |
| [5] |
CHAMBERLAIN K, PATEL S, BROMILOW R H. Uptake by roots and translocation to shoots of two morpholine fungicides in barley[J]. Pestic Sci, 1998, 54(1): 1-7. DOI:10.1002/(SICI)1096-9063(199809)54:1<>1.0.CO;2-U (  0) 0) |
| [6] |
DELETAGE-GRANDON C, CHOLLET J, FAUCHER M, et al. Carrier-mediated uptake and phloem systemy of a 350-dalton chlorinated xenobiotic with an alpha-amino acid function[J]. Plant Physiol (Rockville), 2001, 125(4): 1620-1632. DOI:10.1104/pp.125.4.1620 (  0) 0) |
| [7] |
BRUCK E, ELBERT A, FISCHER R, et al. Movento (R), an innovative ambimobile insecticide for sucking insect pest control in agriculture: Biological profile and field performance[J]. Crop Prot, 2009, 28(10): 838-844. DOI:10.1016/j.cropro.2009.06.015 (  0) 0) |
| [8] |
张庆宽. 双向内吸性新杀虫剂螺虫乙酯的开发[J]. 农药, 2009, 48(6): 445-447. DOI:10.3969/j.issn.1006-0413.2009.06.021 (  0) 0) |
| [9] |
YANG W, WU H X, XU H H, et al. Synthesis of glucose-fipronil conjugate and its phloem mobility[J]. J Agric Food Chem, 2011, 59(23): 12534-12542. DOI:10.1021/jf2031154 (  0) 0) |
| [10] |
WU H X, YANG W, ZHANG Z X, et al. Uptake and phloem transport of glucose-fipronil conjugate in Ricinus communis involve a carrier-mediated mechanism[J]. J Agric Food Chem, 2012, 60(24): 6088-6094. DOI:10.1021/jf300546t (  0) 0) |
| [11] |
WANG J, LEI Z W, WEN Y J, et al. A novel fluorescent conjugate applicable to visualize the translocation of glucose-fipronil[J]. J Agric Food Chem, 2014, 62(35): 8791-8798. DOI:10.1021/jf502838m (  0) 0) |
| [12] |
LEI Z W, WANG J, MAO G L, et al. Glucose positions affect the phloem mobility of glucose-fipronil conjugates[J]. J Agric Food Chem, 2014, 62(26): 6065-6071. DOI:10.1021/jf5010429 (  0) 0) |
| [13] |
QIN P W, WANG J, WANG H, et al. Synthesis of rotenone-O-monosaccharide derivatives and their phloem mobility[J]. J Agric Food Chem, 2014, 62(20): 4521-4527. DOI:10.1021/jf500197k (  0) 0) |
| [14] |
LEI Z W, WANG J, MAO G L, et al. Phloem mobility and translocation of fluorescent conjugate containing glucose and NBD in castor bean (Ricinus communis)[J]. J Photochem Photobiol B:Biol, 2014, 132: 10-16. DOI:10.1016/j.jphotobiol.2014.01.011 (  0) 0) |
| [15] |
吴瀚翔. 糖基氟虫腈在蓖麻上的内吸输导性[D]. 广州: 华南农业大学, 2012.
(  0) 0) |
| [16] |
李俊凯, 徐汉虹, 江定心, 等. 吲哚乙酸引导下三唑醇在大豆植株中的传导与积累研究初报[J]. 农药学学报, 2005, 7(3): 259-263. DOI:10.3321/j.issn:1008-7303.2005.03.012 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37