热带和亚热带树种苗木在遭遇低温时,由于气孔张开受限制,导致叶片细胞内的CO2浓度降低,且低温时光合相关酶的活性降低,使得苗木叶片的蒸腾速率和光合速率降低[1-3]。同时,低温可能引起植物叶片内活性氧的积累,导致叶片细胞膜脂的过氧化,从而出现叶片水分失衡等生理变化[4-5]。磷素既能调控植物的生长和呼吸代谢,同时也是植物体内许多生物分子——如核酸、三磷酸腺苷等的组成物质。研究表明适量的磷素供应可以显著提高植物抗低温的能力[6-7]。植物细胞正常生理活动的维持所需可溶性磷的最佳浓度为5~20 mmol·L-1,而大多数土壤中其浓度仅为1~10μmol·L-1[8]。为培育高质量的苗木,兼顾集约施肥的目的,磷素试验对每种苗木都尤为重要[9-10]。吴国欣等[11]对降香黄檀Dalbergia odorifera的施肥试验表明,2.40~2.60 g·盆-1的磷素量为合理施用量。而以一年生的榉树Zelkova schneideriana为研究材料时,4 g·株-1的磷素供给使苗木生长状况最优[12]。
闽楠Phoebe bournei系樟科Lauraceae楠属Phoebe常绿大乔木,是国家Ⅱ级重点保护野生植物。王樱琳等[13]的闽楠幼苗缺素试验结果表明:磷素缺乏导致闽楠苗木同化力和还原力受影响,使得光合能力减弱,进而影响苗木生长以及生物量的积累。王艺等[14]认为:磷素营养与闽楠苗木苗高、地径、根系生长量以及根冠比均为显著相关关系,60 mg·株-1的有效磷成分能满足1年生闽楠容器苗的磷素需求。本试验通过测定不同磷素供给闽楠苗木在自然低温条件下的光合和其他生理指标,研究磷营养元素供给对闽楠苗木抗寒特性影响的生理机制,为高质量闽楠苗木的培育提供理论支持。
1 材料与方法 1.1 供试材料2011年6月选取长势均一的闽楠实生幼苗(苗高约4.56 cm),将其移栽于体积配比为3(泥炭):2(蛭石):2(珍珠岩)的已灭菌的基质中,所用容器为上、下口径和高分别为10、8和8 cm的塑料盆。为了便于水肥管理,施肥试验在温室中进行,待施肥结束后,再将苗木置于自然低温环境处理,而后进行指标测定。试验所用肥料为德国生产的Planta缺磷肥和磷酸二氢钠(NaH2PO4·2H2O)。Planta主要成分及质量分数为:氮总量(N)19%,可溶性钾(K2O)15%,镁氧化物(MgO)2%,螯合铁(Fe)和螯合锰(Mn)均为0.05%,螯合锌(Zn)、螯合铜(Cu)和硼(B)均为0.01%,钼(Mo)0.001%。
1.2 试验方法 1.2.1 施肥方案试验均为单因素完全随机区组设计,每小区供试苗木为12株,4次重复。磷素8个水平总量分别为0(对照,CK)、7.5(P1)、15.0(P2)、22.5(P3)、30.0(P4)、40.0(P5)、60.0(P6)和90.0 mg·株-1 (P7)。施肥时间为2011年7月1日—12月15日,每次施肥间隔期为15 d,总计施肥次数为12次。磷肥每次施入量恒定,为总量的1/12,即0、0.625、1.250、1.875、2.500、3.750、5.000、7.500 g·株-1。Planta缺磷肥则分3个阶段差量施入,分别为32.90(第1~4次)、65.79(第5~8次)、98.69(第9~12次)g·株-1。每次施肥前先将2种肥混合溶于蒸馏水中,每株苗木每次施入混合肥剂为38.5 mL。
1.2.2 生理指标测定方法于2012年1月中旬的上午09:30—11:30,连续测定3 d,采用美国Li-COR公司生产的Li-6400便携式光合仪,测定苗木的叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)。饱和光强设为1 600 μmol·m-2·s-1;控制空气流速为500 mL·min-1,叶室温度为(23±2) ℃,相对湿度为(30±5)%。每重复随机选取4株苗木,每株标记5片功能叶,每片重复测定3次。气孔限制值[15](Ls)和光合水分利用效率(WUE)[16]计算公式为:
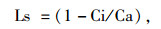
|
(1) |
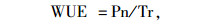
|
(2) |
其中Ca为大气CO2浓度。
其他生理指标也连续测定3 d,参照陈建勋等[17]方法进行测定。
1.2.3 温、湿度监测采用MicroLogPRO EC750温湿度记录仪实时监测自然环境温、湿度,测定间隔期为1 h,将1月10—12日连续3 d的温、湿度记录导入计算机汇总作图。
1.3 数据处理将数据录入Excel表进行计算处理,数据的方差分析和Duncan’s多重比较通过SPSS 18.0来实现,采用Origin8.5进行作图。
2 结果与分析 2.1 指标测定期间环境温、湿度变化测定日期选择在广州温度较低的1月份,且天气晴朗,从图 1中可以看出,1月10—12日,最高温度为29.7 ℃,最低温度为5.0 ℃,相对湿度最高为87.5%,最低为30.6%。其3 d的日均温分别为15.6、14.0、14.0 ℃,而且夜间(20:00至次日07:00)温度仅为8.6、7.4、9.1 ℃。因此可知测定期内昼夜温, 湿度变化较大,能较好地检测苗木抗寒能力。
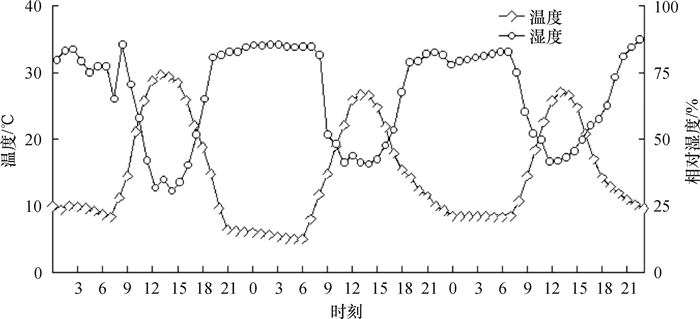
|
图 1 1月10—12日测定期内自然环境的温、湿度变化 Figure 1 Changes of temperature and moisture in the natural environment from 10 to 12 January |
不同磷肥供给对闽楠苗木叶片光合生理有显著影响。其中随着磷素供给的增长,闽楠苗木叶片净光合速率(Pn)(图 1A)、气孔导度(Gs)(图 1B)、胞间CO2浓度(Ci)(图 1C)、蒸腾速率(Tr)(图 1D)以及光合水分利用效率(WUE)(图 1F)均呈先升后降的趋势。各处理最高值均为P4处理苗木,其最高值分别为3.09 μmol·m-2·s-1、0.023 mol·m-2·s-1、350.18 μmol·mol-1、0.32 mmol·m-2·s-1和9.69,分别是最低值的2.69、3.29、2.90、1.88和1.54倍,而气孔限制值(Ls)(图 1E)则呈先降后升之势,最低值为0.34,是最高值的50.75%。
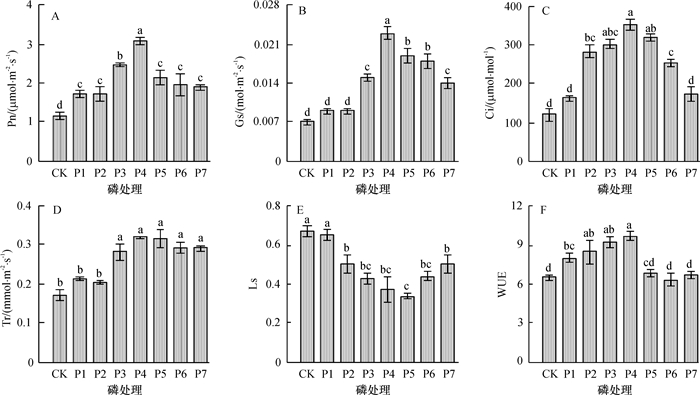
|
图 2 不同磷水平处理对闽楠苗木叶片光合生理特性的影响 Figure 2 Photosynthetic physiological characteristics of Phoebe bournei seedlings with different phosphorus treatments 各图中,柱子上方凡具有一个相同小写英文字母者,表示差异不显著(P>0.05,Duncan’s法)。 |
经方差分析可知:P4处理的Pn、Gs显著高于其他处理;P3、P4和P5处理的Ci值显著高于其他处理;而Tr值P3、P4、P5、P6和P7之间无显著差异,但显著高于其他处理;CK、P1处理的Ls显著高于其他处理;WUE在P4与P2、P3之间无差异,但显著高于其他处理。说明适量的磷素供给,有利于自然低温下闽楠苗木叶片的高光合速率的保持。
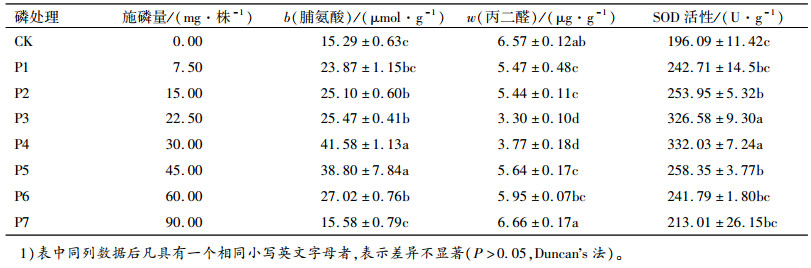
2.3 不同磷素供给对闽楠苗木叶片脯氨酸、丙二醛含量和超氧化物歧化酶(SOD)活性的影响从表 1中可以看出:随磷素供给水平的升高,脯氨酸含量和SOD活性呈先升高后降低的趋势,而丙二醛含量则为先降后升。
|
|
表 1 不同磷素水平处理对苗木脯氨酸、丙二醛含量和SOD活性的影响1) Table 1 Proline and MDA contents and SOD activity of Phoebe bournei seedlings with different phosphorus treatments |
不同磷素供给的闽楠苗木叶片脯氨酸含量存在显著差异。P2、P3、P4、P5、P6处理的脯氨酸含量均显著高于对照,分别为对照的1.64、1.67、2.72、2.54、1.77倍,其中P4处理(磷素供给30 mg·株-1)的闽楠苗木叶片脯氨酸含量最高。而不同磷素处理下的闽楠苗木叶片丙二醛含量,除P6、P7处理低于或高于对照但不显著外,其他均显著低于对照,其中丙二醛含量最低的处理为P3(磷素供给22.5 mg·株-1),仅为对照的50.22%。闽楠苗木叶片SOD活性显著高于对照磷素水平的有P2、P3、P4和P5(磷素供给分别为15.0、22.5、30.0和45.0 mg·株-1)处理,分别为对照的1.30、1.67、1.69和1.32倍,其中P4处理的闽楠苗木叶片SOD活性最高。
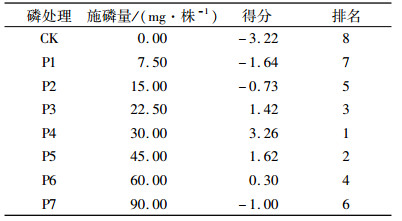
2.4 不同磷素供给闽楠苗木抗寒性的综合评价为了全面合理地评价闽楠苗木抗寒能力,采用主成分分析法[18]对其进行综合评价。以累积贡献率大于85%,确定主成分个数。本研究中,抽取主成分数为2时,累积贡献率达92%。由表 2可知,不同磷素供给水平的闽楠苗木抗寒的能力大小顺序为P4>P5>P3>P6>P2>P7>P1>CK,其中无磷供给的闽楠苗木抗寒能力最差,无磷、高磷(P7)和低磷(P1和P2)供给水平苗木综合得分均为负值,说明足量的磷肥供给有利于苗木抗寒能力的提升。
|
|
表 2 不同磷素水平下闽楠苗木抗低温得分 Table 2 Cold resistance scores of Phoebe bournei seedlings with different phosphorus treatments |
磷素营养对苗木叶片光合作用的影响较为显著,因为磷素与同化力三磷酸腺苷(ATP)和烟酰胺腺嘌呤二核苷酸磷酸(辅酶Ⅱ,NADP)的形成,以及许多磷酸化合物中间产物的合成关系密切[19]。当苗木处于低温环境时,适量的磷素营养供给能提高苗木光合效率,提升苗木的抗低温能力[20]。在可控条件下,植物最佳的光合温度为15~30 ℃[21]。本研究测定日最高温度为29.7 ℃,最低温度为5 ℃,平均温度为14~15 ℃,既能满足最佳光合温度,也能检测低温对植物生理特性的影响。本研究表明30 mg·株-1磷素供给时,苗木光合生理指标均为最高,气孔限制值最低,其中气孔导度显著升高,而蒸腾速率变化不明显,所以闽楠苗木光合水分利用效率(WUE)最高,此时光合速率也最高,这与Gulías等[22]的研究结果一致。本研究中随着磷素供给量的增加,闽楠苗木净光合速率先增后减,是因为低温会限制外界CO2进入植物叶片细胞,但适量的磷素供给能提高叶肉细胞光合活性,保持最高的气孔导度和胞间CO2浓度,使得气孔限制值最低,所以光合速率较高,而低磷和高磷处理没有显著提高苗木抗逆性,气孔限制值高,而其他值较低,因此,光合速率较低[23-24]。
植物光合速率的降低还受其他非羧化等生理过程调节物的影响,如氨基酸和酶等[25]。植物体内脯氨酸是一种水合能力极高的氨基酸,其含量可以作为衡量植物抗水分胁迫的重要指标[26]。本研究中,闽楠苗木叶片脯氨酸含量,随磷素的供给量先增加后降低(30 mg·株-1时最高),这与Andivia等[27]和徐艳丽等[28]的研究结果相同。低磷和高磷供给水平下,闽楠苗木叶片丙二醛含量均比较高,磷素供给22.5 mg·株-1时丙二醛含量最低,这说明不合理的肥力供应,使得苗木在低温胁迫时,膜脂产生较高含量的过氧化产物,致使细胞膜受损严重[19],适宜的肥量供给则能增强闽楠苗木的抵抗膜脂过氧化的能力。超氧化物歧化酶是一种含金属辅基的酶,可以消除超氧阴离子自由基(O2-·)与H+,从而使苗木免受过氧化物的毒害[29]。不同处理闽楠苗木叶片超氧化物歧化酶活性变化趋势与丙二醛相反,与其他与苗木生长正相关的指标(Pn、WUE、脯氨酸含量等)相同,说明适量磷素供给的闽楠苗木叶片内保护酶活性维持在较高水平,有利于其生理代谢的稳定。
不同磷素供给闽楠苗木生长特性及叶片养分含量的研究表明,当磷素供给为22.5 mg·株-1时,闽楠苗木苗高、地径、生物量和叶片氮磷钾含量均最高,且闽楠苗木的最适磷素施用范围为22.5~30.0 mg·株-1[30]。本研究中,磷素供给30 mg·株-1时,闽楠苗木叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、光合水分利用效率(WUE)、脯氨酸含量和超氧化物歧化酶(SOD)活性均最高,丙二醛含量和气孔限制值(Ls)第2低。且经主成分法综合分析可知,30 mg·株-1磷素供给的闽楠苗木抗寒能力最大。本试验结果与文献[30]结果一致,两者互相呼应。与王艺等[14]的研究结果相比,磷素最适量低了1倍,是因为本试验所用肥料为速效肥,而王艺等[14]所用肥料为缓释肥。
30 mg·株-1磷素供给,最有利于闽楠苗木抗寒能力的提高。当使用轻基质育苗时,30 mg·株-1磷素供给量是最佳选择。大田育苗时,磷素使用量还需进一步的试验来核定。
| [1] |
郭淑红, 薛立, 张柔, 等. 4种幼苗对低温胁迫的光合生理响应[J]. 华南农业大学学报, 2012, 33(3): 373-377. DOI:10.3969/j.issn.1001-411X.2012.03.020 (  0) 0) |
| [2] |
王建林, 于贵瑞, 房全孝, 等. 不同植物叶片水分利用效率对光和CO2的响应与模拟[J]. 生态学报, 2008, 28(2): 525-533. DOI:10.3321/j.issn:1000-0933.2008.02.010 (  0) 0) |
| [3] |
VARONE L, RIBAS-CARBOS M, CARDONA C, et al. Stomatal and non-stomatal limitations to photosynthesis in seedlings and saplings of Mediterranean species pre-conditioned and aged in nurseries: Different response to water stress[J]. Environ Exp Bot, 2012, 75(1): 235-247. (  0) 0) |
| [4] |
WANG D, HECKATHORN S A, WANG X Z, et al. A meta-analysis of plant physiological and growth responses to temperature and elevated CO2[J]. Oecologia, 2012, 169(1): 1-13. DOI:10.1007/s00442-011-2172-0 (  0) 0) |
| [5] |
PALLARDY S G. Physiology of woody plants[M]. Missouri: Academic Press, 2010, 225-226.
(  0) 0) |
| [6] |
侯立刚, 陈温福, 马巍, 等. 低温胁迫下不同磷营养对水稻叶片质膜透性及抗氧化酶活性的影响[J]. 华北农学报, 2012, 27(1): 118-123. DOI:10.3969/j.issn.1000-7091.2012.01.022 (  0) 0) |
| [7] |
侯伟, 孙爱花, 杨福孙, 等. 低温胁迫对西瓜幼苗光合作用与叶绿素荧光特性的影响[J]. 广东农业科学, 2014, 41(13): 35-39. DOI:10.3969/j.issn.1004-874X.2014.13.008 (  0) 0) |
| [8] |
TRAN H T, HURLEY B A, PLAXTON W C. Feeding hungry plants: The role of purple acid phosphata-ses in phosphate nutrition[J]. Plant Sci, 2010, 179(1): 14-27. (  0) 0) |
| [9] |
GARRISH V, CERNUSAK L A, WINTER K, et al. Nitrogen to phosphorus ratio of plant biomass versus soil solution in a tropical pioneer tree, Ficus insipida[J]. J Exp Bot, 2010, 61(13): 3735-3748. DOI:10.1093/jxb/erq183 (  0) 0) |
| [10] |
赵琼, 曾德慧. 林木生长氮磷限制的诊断方法研究进展[J]. 生态学杂志, 2009, 28(1): 122-128. (  0) 0) |
| [11] |
吴国欣, 王凌晖, 梁惠萍, 等. 氮磷钾配比施肥对降香黄檀苗木生长及生理的影响[J]. 浙江农林大学学报, 2012, 29(2): 296-300. DOI:10.3969/j.issn.2095-0756.2012.02.021 (  0) 0) |
| [12] |
丁彦芬, 高俊飞, 张利. 配方施肥对榉树幼苗生长的影响[J]. 南京林业大学学报(自然科学版), 2014, 38(S1): 35-38. (  0) 0) |
| [13] |
王樱琳, 韦小丽, 段如雁, 等. 闽楠幼苗对大量元素缺乏的响应[J]. 西北林学院学报, 2014, 29(2): 61-65. DOI:10.3969/j.issn.1001-7461.2014.02.11 (  0) 0) |
| [14] |
王艺, 王秀花, 吴小林, 等. 缓释肥加载对浙江楠和闽楠容器苗生长和养分库构建的影响[J]. 林业科学, 2013, 49(12): 57-63. (  0) 0) |
| [15] |
ZHOU S X, DUURSMA R A, MEDLYN B E, et al. How should we model plant responses to drought? An analysis of stomatal and non-stomatal responses to water stress[J]. Agr Forest Meteorol, 2013, 183(22): 204-214. (  0) 0) |
| [16] |
HUANG Z, ZOU Z R, HE C X, et al. Physiological and photosynthetic responses of melon (Cucumis melo L.) seedlings to three Glomus species under water deficit[J]. Plant Soil, 2011, 339(1): 391-399. (  0) 0) |
| [17] |
陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2002, 115-118.
(  0) 0) |
| [18] |
何跃君, 薛立, 任向荣, 等. 低温胁迫对六种苗木生理特性的影响'[J]. 生态学杂志, 2008, 27(4): 524-531. (  0) 0) |
| [19] |
TAIZ L, ZEIGER E. Plant physiology[M]. Sinauer Associates: Sunderland, 2006, 227-228.
(  0) 0) |
| [20] |
陈琳, 曾杰, 贾宏炎, 等. 林木苗期营养诊断与施肥研究进展[J]. 世界林业研究, 2012, 25(3): 26-31. (  0) 0) |
| [21] |
OGAYA R, PEUELAS J, ASENSIO D, et al. Chlorophyll fluorescence responses to temperature and water availability in two co-dominant Mediterranean shrub and tree species in a long-term field experiment simulating climate change[J]. Environ Exp Bot, 2011, 73(2): 89-93. (  0) 0) |
| [22] |
GULIAS J, CIFRE J, JONASSON S, et al. Seasonal and inter-annual variations of gas exchange in thirteen woody species along a climatic gradient in the Mediterranean island of Mallorca[J]. Flora-Morphol, Distribut Funct Ecol Plant, 2009, 204(3): 169-181. (  0) 0) |
| [23] |
郑春芳, 刘伟成, 陈少波, 等. 短期夜间低温胁迫对秋茄幼苗碳氮代谢及其相关酶活性的影响[J]. 生态学报, 2013, 33(21): 6853-6862. (  0) 0) |
| [24] |
张毅龙, 张卫强, 甘先华. 低温胁迫对6种珍贵树种苗木光合荧光特性的影响[J]. 生态环境学报, 2014, 23(5): 777-784. DOI:10.3969/j.issn.1674-5906.2014.05.008 (  0) 0) |
| [25] |
FLEXAS J, DIAZESPEJO A, GAGO J, et al. Photosynthetic limitations in Mediterranean plants:A review[J]. Environ Exp Bot, 2014, 103(3): 12-23. (  0) 0) |
| [26] |
于金平, 俞珊, 梁有旺, 等. NaCl胁迫对美国白蜡幼苗部分生理指标的影响[J]. 植物资源与环境学报, 2014, 23(1): 110-112. DOI:10.3969/j.issn.1674-7895.2014.01.18 (  0) 0) |
| [27] |
ANDIVIA E, MÁRQUEZ-GARCÍA B, VÁZQU-EZ-PIQUÉ J, et al. Autumn fertilization with nitrogen improves nutritional status, cold hardiness and the oxidative stress response of Holm oak (Quercus ilex ssp. ballota[Desf.] Samp) nursery seedlings[J]. Trees, 2012, 26(2): 311-320. DOI:10.1007/s00468-011-0593-3 (  0) 0) |
| [28] |
徐艳丽, 鲁剑巍, 周世力, 等. 氮磷钾肥对高羊茅生长及抗寒性的影响[J]. 植物营养与肥料学报, 2007, 13(6): 1173-1177. DOI:10.3321/j.issn:1008-505x.2007.06.030 (  0) 0) |
| [29] |
FAVARETTO V F, MARTINEZ C A, SORIANI H H, et al. Differential responses of antioxidant enzymes in pioneer and late-successional tropical tree species grown under sun and shade conditions[J]. Environ Exp Bot, 2011, 70(1): 20-28. DOI:10.1016/j.envexpbot.2010.06.003 (  0) 0) |
| [30] |
王东光, 尹光天, 杨锦昌, 等. 磷肥对闽楠苗木生长及叶片氮磷钾浓度的影响[J]. 南京林业大学学报(自然科学版), 2014, 38(3): 40-44. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37