邻苯二酸酯类化合物(PAEs)又称钛酸酯,是大约30种化合物的总称,主要用作塑料的增塑剂,以增大塑料的可塑性和强度[1]。邻苯二甲酸二丁酯(DBP)是塑化剂的一种,工业上主要用于硝基漆和聚氯乙烯(PVC)塑料的生产,以增强产品的柔韧性。此外,DBP还用于生产防泡剂、乳胶黏合剂和纺织助剂等[2]。塑化剂的大量生产和频繁应用,导致在人们的日常生活中塑化剂污染严重。据报道,中国南京市区的大气塑化剂污染中,DBP占到了58.7%[3]。DBP是一种具有生殖毒性和遗传毒性的环境雌激素,具有雌激素的作用,致突变,对胎儿有毒性,对肌肉、骨骼、中枢神经系统有影响,能通过消化系统、呼吸系统和皮肤进入人体[4],对人体产生不同程度的危害作用。有研究发现,DBP的代谢产物MBP对大鼠具有胚胎毒性作用,导致胚胎生长缓慢,同时对胚胎有致畸作用[5]。
早在1975年,DBP就被世界野生动物基金会列为具有内分泌紊乱作用的物质之一[6]。DBP还被欧盟2005/84/EC指令限制使用于儿童玩具和用品中,在塑料中的含量不得超过0.1%。美国、加拿大、日本、韩国等多个国家也相继发布了与欧盟类似的法律和标准[7],我国也将其列为优先控制污染物黑名单[8]。近年来爆发的”台湾塑化剂事件“和“白酒塑化剂事件”,让人们重新认识了作为包装材料添加剂的“塑化剂”,由此引发了对食品包装材料安全性能的高度关注[9]。目前对塑化剂的检测方法主要为气相色谱(GC)、高效液相色谱(HPLC)和质谱(MS)等,但这些方法费时,仪器昂贵,需专业人士操作,样品前处理复杂,不能同时大量分析[10]。本研究采用的免疫分析技术具有特异性强、灵敏度高、方便快捷、分析容量大、检测成本低、安全可靠等优点[11]。
小分子物质邻苯二甲酸二丁酯只有反应原性,没有免疫原性,不能刺激动物发生免疫反应。为了获得具有免疫原性的完全抗原,必须将其与大分子载体进行偶联[12]。本研究利用戊二酸酐合成了连接有5个碳臂长的半抗原衍生物4-戊二酸单酰邻苯二甲酸二丁酯(DBCP),再通过活性酯法将DBCP与载体蛋白——牛血清蛋白(BSA)或卵清蛋白(OVA)偶联获得人工抗原,最后利用间接酶联免疫法(icELISA)检测抗体。该抗原的合成为免疫分析技术的建立奠定了基础。
1 材料与方法 1.1 材料与仪器4-硝基邻苯二甲酸(质量分数≥99%)、钯碳:百灵威化学试剂有限公司;高纯氢气:广州市君多气体有限公司;二环乙基碳二亚胺(DCC)、N-羟基琥珀酰亚胺(NHS)、牛血清蛋白(BSA,质量分数为98.6%)、卵清蛋白(OVA,质量分数为98%)、弗氏完全佐剂与不完全佐剂:美国Sigma公司;SPF级雌性新西兰大白兔:广东省动物中心;羊抗兔IgG-HRP二抗:武汉博士德生物工程有限公司;其他试剂均为国产分析纯。TU-1901紫外-可见分光光度仪:北京谱析通用仪器有限责任公司;RT-2100C型酶标仪:雷杜生命科学股份有限公司;96孔酶标板:厦门云鹏科技有限公司。
1.2 人工抗原的合成与鉴定 1.2.1 4-硝基邻苯二甲酸二丁酯(DBNP)的合成按照文献[13]中的方法,称取20 g(0.095 mol)4-硝基邻苯二甲酸,加入26 mL正丁醇,搅拌下加入3.3 mL浓H2SO4催化,120 ℃搅拌回流7 h后,蒸馏除去未反应的丁醇和生成的水。趁热导入冰水中,油状粗品用质量分数为10%Na2CO3洗涤至水层无色(pH7~8)后,分离出油状物,用无水乙醇溶解除去不溶物,加热后除去少量乙醇,趁热置冰箱中冷却,得到黄色油状液体28.5 g,产率93%。
1.2.2 4-氨基邻苯二甲酸二丁酯(DBAP)的合成取2 g(6.19 mmol)4-硝基邻苯二甲酸二丁酯和0.4 g钯碳溶于15 mL甲醇,缓慢通入H2,50 ℃条件下回流搅拌反应5 h,反应结束后过滤,上清液旋转蒸发浓缩,用乙酸乙酯溶解后再过滤,旋转蒸发浓缩后得淡黄色固体1.78 g,产率98%。产物经硅胶柱层析提纯,通过氢核磁共振(1H NMR)和质谱(MS)鉴定。
1.2.3 4-戊二酸单酰邻苯二甲酸二丁酯(DBCP)的合成将0.29 g(1 mmol)DBAP和0.22 g(2 mmol)戊二酸酐溶解在20 mL四氢呋喃(THF)中,60 ℃条件下回流搅拌反应8 h,再转移至室温搅拌反应12 h,蒸馏除去THF。残余物溶于10 mL乙酸乙酯中,并用10 mL双蒸水洗涤,分离出乙酸乙酯层,转旋蒸发除去乙酸乙酯,得到黄色油状液体0.31 g,产率75%。
1.2.4 人工抗原的合成将40.7 mg(0.1 mmol)DBCP,17 mg(0.15 mmol)NHS完全溶于1 mL的二甲基甲酰胺(DMF)后,加入31 mg(0.15 mmol)DCC,4 ℃条件下反应12 h,离心分离出上清液。取900 μL得到的上清液,滴加到8 mL溶有113 mg BSA的磷酸盐缓冲液(PBS, pH 7.4)中,4 ℃条件下反应12 h。10 000 g·min-1条件下离心10 min。将上清液装入透析袋,用PBS透析3 d,每12 h换液1次,得到棕黄色的邻苯二甲酸全抗原溶液。
1.2.5 人工抗原的鉴定为鉴定半抗原与载体蛋白是否偶联成功,分别将半抗原、载体蛋白和偶联物稀释至一定浓度进行SDS-PAGE鉴定,并在200~400 nm波长间进行紫外吸收光谱测定,以紫外分光光度法估算偶联物的结合比[14]。
1.3 免疫动物及抗血清检测以DBCP-BSA作免疫原,用PBS溶液(pH 7.4)稀释至1 mg·mL-1,与等体积的弗氏完全佐剂充分乳化,对2只成年健康雌性新西兰大白兔采用背部多点注射和肌肉注射。3周后再次免疫改用等量的弗氏不完全佐剂进行乳化,以后每隔2周免疫1次,免疫后7~8 d耳缘静脉取血[15]。
以DBCP-OVA作包被原,将抗血清用PBS溶液倍比稀释,采用间接ELISA法检测抗体效价,并用间接竞争ELISA法[16]检测抗体的特异性。以标准品DBP浓度的自然对数值为横坐标,D/D0(D、D0分别为加兔抗血清和阴性血清对应的光密度)为纵坐标,建立竞争抑制曲线。
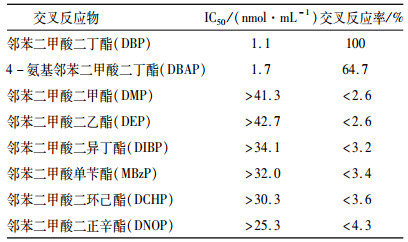
1.4 抗体特异性分析采用icELISA法分别检测邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸单苄酯(MBzP)、4-氨基邻苯二甲酸二丁酯(DBAP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二正辛酯(DNOP)与抗体的交叉反应,并计算各竞争物的半抑制率(IC50),比较抗体对它们的亲和性。根据以下公式计算各竞争物与DBP抗体的交叉反应率[17]。

|
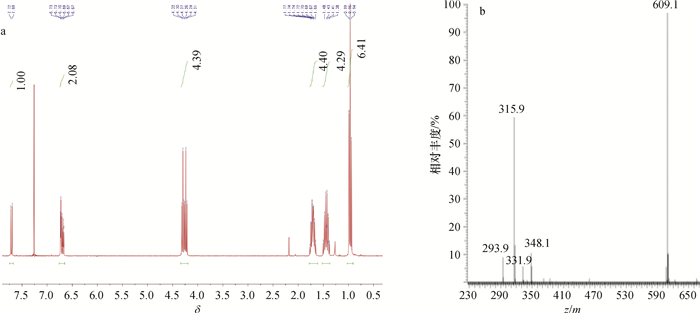
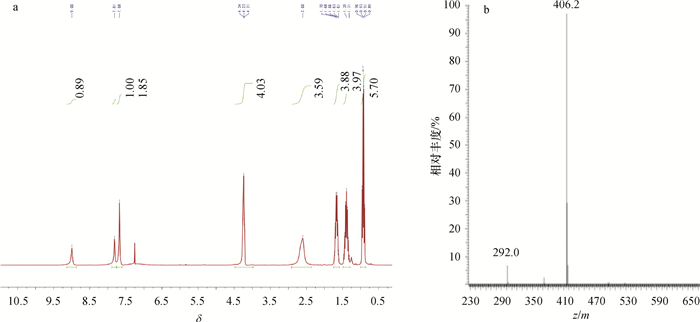
对半抗原衍生物4-氨基邻苯二甲酸二丁酯(DBAP)和4-戊二酸单酰邻苯二甲酸二丁酯(DBCP)进行了质谱(MS)与氢核磁共振(1H NMR)扫描,结果(图 1和图 2)表明合成成功。
|
图 1 半抗原衍生物DBAP的1H NMR(a)和MS(b)图谱 Figure 1 1H NMR (a)and MS(b) spectrums of hapten derivative DBAP |
|
图 2 半抗原衍生物DBCP的1H NMR(a)和MS(b)图谱 Figure 2 1H NMR(a) and MS(b) spectrums of hapten derivative DBCP |
由图 1a分析可知,DBAP的1H NMR (300 MHz, CDCl3) δ: 7.71 (d, J = 8.4 Hz, 1H), 6.76~6.65 (m, 2H), 4.27 (dt, J = 17.6, 6.7 Hz, 4H), 1.78 ~1.61 (m, 4H), 1.52~1.37 (m, 4H), 0.96 (t, J = 7.3 Hz, 6H),其MS图(图 1b)中293.9是M+H+,315.9是M+Na+,331.9是M+K+,348.1是M+Na++CH3OH,609.1是2M+Na+。由此可知,该化合物的相对分子质量为293,与计算结果吻合。
由图 2a分析可知DBCP的1H NMR (300 MHz, CDCl3) δ: 9.02 (s, 1H), 7.84 (s, 1H), 7.69 (d, J = 8.0 Hz, 2H), 4.24 (td, J = 6.7, 3.2 Hz, 4H), 2.46 ~2.21 (m, 4H), 2.01 ~ 1.83 (m, 2H), 1.74~ 1.56 (m, 4H), 1.39 (dp, J = 14.4, 7.3 Hz, 4H), 0.92 (q, J = 7.3 Hz, 6H),其MS图(图 2b)中,406.2是M-H+。由此可知,该化合物的相对分子质量为407.2,与计算结果吻合。
2.2 抗原的鉴定 2.2.1 紫外可见光吸收光谱鉴定经紫外可见光分光光度计测定,得到载体蛋白、半抗原衍生物以及人工抗原的紫外扫描图(图 3)。从图 3中可以看出,DBCP在波长204、223和269 nm处出现特征吸收峰,载体蛋白BSA在波长202和280 nm处出现特征吸收峰,OVA在205和280 nm处出现特征吸收峰,而DBCP-BSA则在205和272 nm处有显著吸收峰,DBCP-OVA在203和269 nm处有显著吸收峰。由于DBCP的羧基与载体蛋白的氨基发生偶联,所以紫外光谱中特征峰发生改变,但同时具备半抗原和载体蛋白的吸收特征,间接说明半抗原和载体蛋白偶联成功[18]。根据紫外分光光度法估算DBCP-BSA和DBCP-OVA的结合比分别为11:1和17:1。
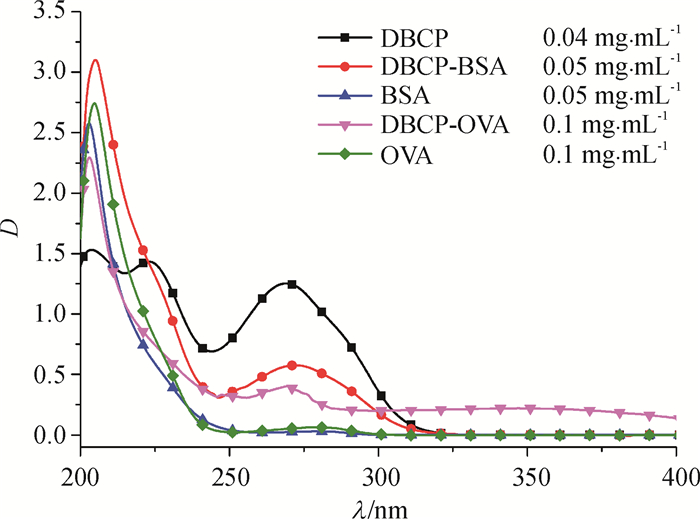
|
图 3 人工抗原紫外扫描图 Figure 3 Ultraviolet scanning of artificial antigens |
人工抗原及蛋白的SDS-PAGE结果见图 4。由图 4可知,人工抗原的迁移速率均比载体蛋白的迁移速率小,表明偶联产物的相对分子质量均比载体蛋白的相对分子质量大。其中,DBCP-OVA和OVA在电泳图中的区分效果较好,可能是OVA的相对分子质量较小、结合上的DBCP较多的缘故(结合比17:1)。电泳图表明半抗原衍生物与载体蛋白偶联成功。
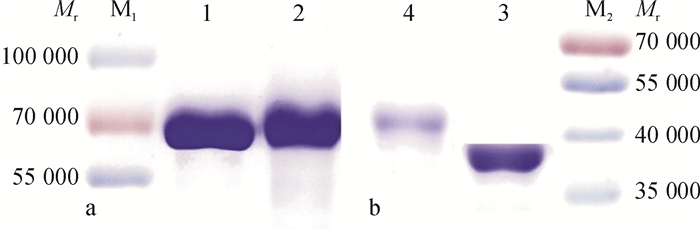
|
图 4 BSA和DBCP-BSA以及OVA和DBCP-OVA的SDS-PAGE电泳图 Figure 4 SDS-PAGE gel of BSA, DBCP-BSA, OVA and DBCP-OVA M1:重组蛋白Marker 1; 1:BSA;2:DBCP-BSA; M2:重组蛋白Marker 2; 3:OVA; 4:DBCP-OVA。 |
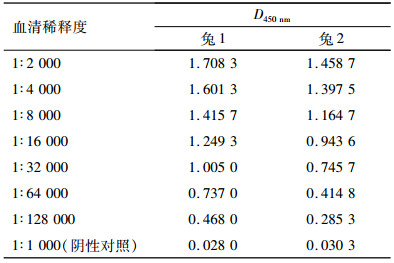
对兔子进行5次免疫后耳部静脉采血,经离心得到抗血清,利用间接ELISA法检测抗体效价,结果见表 1。从表 1可知,兔1和兔2抗血清效价均达到1:128 000。包被抗原DBCP-OVA经方阵滴定法确定最佳包被质量浓度为2 000 ng·mL-1。以抗血清最高效价稀释倍数,利用icELISA法测定其半抑制率(IC50),竞争抑制曲线如图 5,可知兔1和兔2的IC50分别为301和308 ng·mL-1。
|
|
表 1 抗血清效价测定结果 Table 1 Detection result of serum titer |
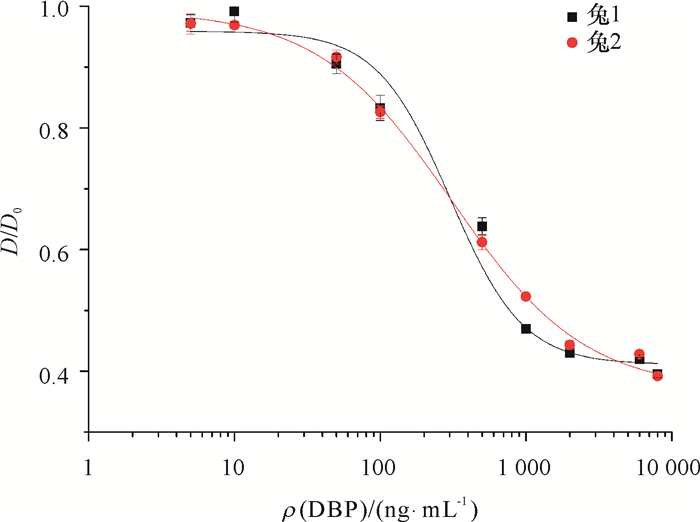
|
图 5 DBP标准竞争抑制曲线 Figure 5 Standard competitive inhibition curves for DBP |
采用icELISA法对邻苯二甲酸二甲酯、邻苯二甲酸二乙酯、邻苯二甲酸二异丁酯、邻苯二甲酸单苄酯等邻苯二甲酸结构类似物进行特异性检测,结果如表 2所示。从表 2中可以看出,除DBP和DBAP外,其他结构类似物的交叉反应率均小于4.3%。因此,表明DBCP-BSA免疫新西兰大白兔所获抗体建立的icELISA方法特异性良好。
|
|
表 2 多克隆抗体与DBCP结构类似物的交叉反应 Table 2 Cross-reactivity of the polyclonal antibody against DBCP related compounds |
半抗原的设计、半抗原的修饰和人工抗原的合成是制备抗小分子化合物抗体、建立相应的免疫分析方法的重要过程。之前的研究中,邻苯二甲酸二丁酯人工抗原的研究多以4-氨基邻苯二甲酸二丁酯为半抗原通过重氮化法与载体蛋白偶联制备[3, 11, 13], 这种方法在半抗原制备过程中通常使用苯等有毒有机溶剂,不利于试验操作人员的健康。其次,重氮化法的操作有一定的危险性,且步骤比较繁琐。Wei等[2]在其研究中曾经制备带4个碳链的邻苯二甲酸二丁酯人工抗原,但在其研究中主要将这种抗原作为包被原来使用,并未深入探究这种抗原的免疫活性。
本研究在DBAP的4位氨基上利用戊二酸酐在半抗原与载体之间连接了1条含5个碳的手臂链,充分暴露出了半抗原分子的特征结构,而且连接了5个碳手臂链,更有利于人工抗原表面突显半抗原的结构特征,以利于产生具有高特异性的抗体[19]。利用H2还原、钯碳作催化剂,大大缩短了反应时间,避免了使用有毒试剂苯,试验操作更安全更简便,也提高了反应产率。使用戊二酸酐反应与戊二醛法反应相比较,产物更稳定,副产物少,专一性更强,产率更高。因此,该抗原的合成为下一步建立免疫分析技术奠定了基础。
本试验使用戊二酸酐反应合成了半抗原衍生物,经质谱、氢核磁共振谱图鉴定,衍生物合成成功。采用活性酯法将半抗原衍生物与载体蛋白进行偶联,合成人工抗原,经紫外光谱、SDS-PAGE鉴定,偶联成功。所得抗体经icELISA法检测知其具有较高灵敏度和较好特异性,可用于邻苯二甲酸二丁酯含量的测定。
| [1] |
XU F, WANG W, JIANG H, et al. Indirect competitive enzyme-linked immunosorbent assay for the detection of dibutyl phthalate in white wine, compared with GC-MS[J]. Food Analytical Methods, 2014, 7(8): 1619-1626. DOI:10.1007/s12161-014-9797-7 (  0) 0) |
| [2] |
WEI C X, DING S M, YOU H H, et al. An immunoassay for dibutyl phthalate based on direct hapten linkage to the polystyrene surface of microtiter plates[J]. PLOS One, 2011, 6(12): e29196. DOI:10.1371/journal.pone.0029196 (  0) 0) |
| [3] |
KUANG H, LIU L, XU L, et al. Development of an enzyme-linked immunosorbent assay for dibutyl phthalate in Liquor[J]. Sensors, 2013, 13(7): 8331-8339. DOI:10.3390/s130708331 (  0) 0) |
| [4] |
王民生. 邻苯二甲酸酯(塑化剂)的毒性及对人体健康的危害[J]. 江苏预防医学, 2011, 22(4): 68-70. (  0) 0) |
| [5] |
刘慧杰, 舒为群. 邻苯二甲酸酯类化合物的毒理学效应及对人群健康的危害[J]. 第三军医大学学报, 2004, 26(19): 1778-1781. DOI:10.3321/j.issn:1000-5404.2004.19.026 (  0) 0) |
| [6] |
谭君, 林竹光. GC-EI-MS内标法分析鱼肉中邻苯二甲酸酯[J]. 化学学报, 2007, 65(24): 2875-2882. DOI:10.3321/j.issn:0567-7351.2007.24.013 (  0) 0) |
| [7] |
杨涛. 台湾塑化剂风暴对饮料及饮料包装行业的影响[J]. 塑料包装, 2011, 21(4): 35-39. DOI:10.3969/j.issn.1006-9828.2011.04.009 (  0) 0) |
| [8] |
王少杰, 孟雨吟, 李秋顺, 等. 高效液相色谱法测定蔬菜中邻苯二甲酸二丁酯残留[J]. 山东农业科学, 2012, 44(1): 112-114. DOI:10.3969/j.issn.1001-4942.2012.01.033 (  0) 0) |
| [9] |
方丽, 林泽鹏, 林晨, 等. 气质联用法测定食品包装材料中22种邻苯二甲酸酯残留方法的探讨[J]. 食品工业, 2015, 36(1): 291-296. (  0) 0) |
| [10] |
FENG X, LU S, LIU D, et al. Direct competitive immunosorbent assay for detection of MEHP in human urine[J]. Chemosphere, 2013, 92(1): 150-155. DOI:10.1016/j.chemosphere.2013.02.062 (  0) 0) |
| [11] |
ZHANG M, LIU S, ZHUANG H, et al. Determination of dimethyl phthalate in environment water samples by a highly sensitive indirect competitive ELISA[J]. Appl Biochem Biotechnol, 2012, 166(2): 436-445. DOI:10.1007/s12010-011-9439-0 (  0) 0) |
| [12] |
王建华, 张冲. 小分子抗原人工合成进展[J]. 应用化学, 2011, 28(4): 367-375. (  0) 0) |
| [13] |
ZHANG M, WANG Q, ZHUANG H. A novel competitive fluorescence immunoassay for the determination of dibutyl phthalate[J]. Anal Bioanal Chem, 2005, 386(5): 1401-1406. (  0) 0) |
| [14] |
庄惠生, 李玉科, 张明翠. 环境荷尔蒙邻苯二甲酸二甲酯的人工全抗原合成与表征[J]. 化学试剂, 2005, 27(9): 559-560. DOI:10.3969/j.issn.0258-3283.2005.09.014 (  0) 0) |
| [15] |
ZHOU J, ZHAO S, ZHANG J, et al. An indirect competitive enzyme-linked immunosorbent assay for bisphenol-A based on the synthesis of a poly-l-lysine-hapten conjugate as a coating antigen[J]. Anal Methods, 2013, 5(6): 1570. DOI:10.1039/c3ay26220k (  0) 0) |
| [16] |
郑劼, 张焜, 赵肃清. 双酚A人工抗原的光谱表征及免疫鉴定研究[J]. 光谱学与光谱分析, 2008, 28(7): 1583-1586. DOI:10.3964/j.issn.1000-0593.2008.07.032 (  0) 0) |
| [17] |
万宇平, 陶光灿, 李勇, 等. 邻苯二甲酸二丁酯(塑化剂)ELISA检测方法的研究[J]. 食品工业, 2013, 34(9): 194-196. (  0) 0) |
| [18] |
赵肃清, 蔡燕飞, 雷红涛, 等. 农药甲胺磷人工抗原的光谱鉴定研究[J]. 光谱学与光谱分析, 2004, 24(2): 207-209. DOI:10.3321/j.issn:1000-0593.2004.02.024 (  0) 0) |
| [19] |
宋娟, 王榕妹, 王悦秋, 等. 半抗原的设计、修饰及人工抗原的制备[J]. 分析化学, 2010, 38(8): 1211-1218. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37