2. 广州飞禧特水产科技有限公司,广东 广州 510640
2. Guangzhou Fishtech Aquactic Sciences Co., Ltd., Guangzhou 510640, China
菜粕因其来源广、蛋白含量高、蛋氨酸和赖氨酸在植物性蛋白原料中相对高等特点,已成为水产饲料中广泛使用的原料。饲料原料价格受种植产量、养殖动物终端产品市场价格、养殖形势及国际贸易等较多因素影响,波动较大,配合饲料中菜粕等植物蛋白原料用量在逐渐增大。近几年,一些饲料企业在罗非鱼饲料配方中国产菜粕用量高达30%以上,或者印度菜粕用量达20%左右,甚至更高。由于饲料原料价格普遍大幅度上涨,而印度菜粕相对国产菜粕更便宜,具有价格优势,在淡水鱼饲料中大量使用。据调查研究,印度菜粕和国产菜粕蛋白含量差异不大,主要是抗营养因子总硫甙、恶唑烷硫酮(OZT)和芥子碱等含量前者显著高于后者[1]。印度菜粕的用量增加,会严重影响鱼的适口性,进而影响鱼的摄食与生长及肝胆健康等问题。张伟涛等[2]研究了不同水平诱食剂配合印度菜粕对38 g左右的罗非鱼生长性能和经济效益的影响,发现配方中使用28%的印度菜粕加0.2%的诱食剂效果较好。没有直接对比2种菜粕的应用效果。莫文艳等[3]发现印度菜粕替代50%的国产菜粕(印度菜粕使用量为17.5%)加诱食剂后对罗非鱼幼鱼(2.5~11.0 g)生长性能和肝脏指数有显著改善作用。菜粕替代豆粕对奥尼罗非鱼、菜粕不同水平对吉富罗非鱼生长、免疫或肝脏等的影响已有报道[4-5],而植物蛋白源利用不合理会对水产养殖动物的生长[4, 6]、免疫力[6-7]、肉质[7-8]、组织学[9-10]、形态学[4, 11]产生影响。本试验选用17.3 g左右的奥尼罗非鱼为研究对象,用印度菜粕部分或全部替代国产菜粕,从生长、体组成、血清中酶活力指标和肝功能等方面考察对罗非鱼的影响,为印度菜粕在罗非鱼配合饲料中的合理应用提供依据,同时优化配方,降低成本,为实际生产带来更大的效益。
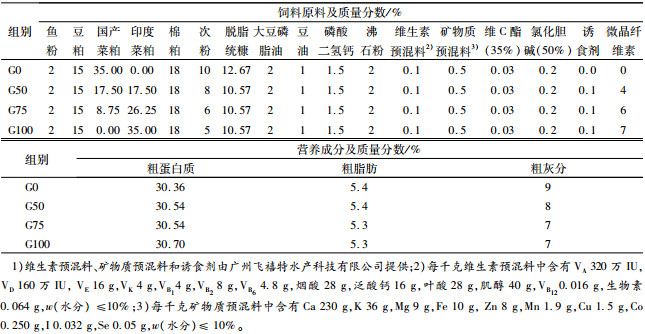
1 材料与方法 1.1 试验饲料以鱼粉、豆粕、国产普通菜粕和棉粕为蛋白源,磷脂油和豆油为脂肪源,配制基础饲料(G0),其中国产菜粕比例为35%。采用等蛋白替代方法,用印度菜粕分别替代对照饲料中50%、75%和100%的国产菜粕并添加质量分数为0.1%的二甲基-β-丙酸噻亭(DMPT)为诱食剂,配制3种试验饲料,记作G50、G75和G100。饲料配方及营养成分见表 1。饲料原料经粉碎后过40目筛,所有原料混匀后用SLX-80型双螺杆挤压机制成直径为2.0 mm的颗粒饲料,75 ℃条件下烘干,自然冷却回潮后放入密封袋中,置于-20 ℃冰箱中保存备用。
|
|
表 1 试验饲料配方及营养组成(风干质基础)1) Table 1 Ingredients and nutrient composition of experimental diets (D M basis) |
养殖试验在广东省农业科学院动物科学研究所水产室的室内循环水养殖系统(桶缸直径80 cm、高70 cm,水体容积300 L)中进行。鱼苗于室外水泥池暂养2周后进行分组,挑选健康、活泼、体质量约为17.3 g的奥尼罗非鱼120尾,随机分为4组,每组3个重复,每个重复10尾,分别投喂4种试验饲料。养殖水源为经过活性炭、珊瑚石过滤后的自来水。饲养期间,每天投喂2次(08:00—09:00,16:00—17:00),投饲量为6%左右,持续充气,保持溶氧5~7 mg·L-1,pH 7.8±0.4,水温(28±4) ℃,氨氮≤ 0.2 mg·L-1,亚硝酸盐≤ 0.02 mg·L-1。每3 d排污并换水,换水量视水质情况而定。养殖周期为43 d。
1.3 样品采集与指标检测 1.3.1 样品采集养殖试验结束后禁食24 h,称其体质量、测体长,计算增质量率、特定生长率和饲料系数。每缸随机取5尾鱼,用1 mL无菌注射器于鱼尾静脉取血,合并置于离心管中,静置2~3 h后,离心(4 ℃,5 000 r·min-1,15 min)取血清于-80 ℃冰箱保存备用;解剖分离称量内脏质量和肝质量;随机挑选3尾鱼的肝脏用体积分数为10%中性甲醛固定,用于制备肝组织切片;另取5尾去内脏鱼用于粗蛋白质、粗脂肪、水分和粗灰分测定。生长性能和生物学性状计算公式如下:
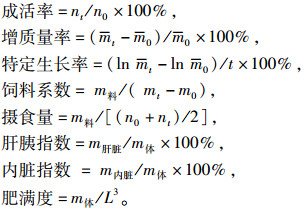
|
式中,n0和nt分别为试验开始和试验结束时鱼的尾数,m0和mt分别为试验开始和试验结束时鱼体的总质量(g),m0和mt分别为试验开始和试验结束时鱼体的平均质量(g),t为试验的时间(d),m料为投饵总量(g),m肝脏为鱼体肝脏质量,m内脏为鱼体内脏质量,m体和L分别为每尾鱼的体质量(g)和体长(cm)。
1.3.2 指标检测饲料和全鱼水分含量采用105 ℃烘箱干燥法(GB/T6435—1986)测定,粗蛋白质含量采用凯氏定氮法(GB/T6432—1994)测定,粗脂肪含量采用乙醚抽提法(GB/T6433—1994)测定,粗灰分含量采用550 ℃灼烧法(GB/T643—1992)测定。血清生化指标采用日立7600全自动生化分析仪测定;谷丙转氨酶(GPT)、谷草转氨酶(GOT)、超氧化物歧化酶(SOD)、丙二醛(MDA)、NO、总抗氧化能力(T-AOC)、溶菌酶(LZM)和碱性磷酸酶(AKP)含量采用南京建成生物工程研究所的试剂盒进行测定,具体测定方法参照试剂盒说明书进行。
将肝脏取出,经脱水、透明和浸蜡等步骤后用石蜡进行包埋,连续切片,苏木精-伊红(HE)染色,树胶封片,在光学显微镜下观察其形态和结构的变化。
1.4 数据统计与分析采用SPSS11.5软件进行数据分析和统计,先对数据作单因素方差分析(One-way ANOVA),若组间差异显著,再采用Duncan’s法进行多重比较。
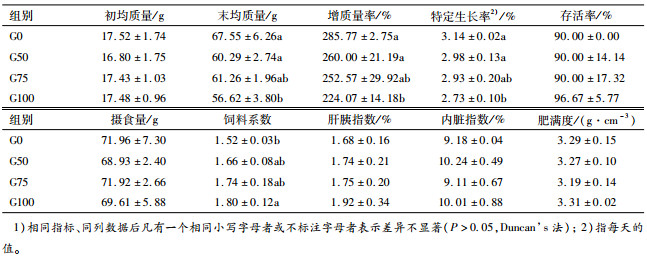
2 结果 2.1 印度菜粕替代国产菜粕对奥尼罗非鱼生长性能的影响如表 2所示,随着印度菜粕替代水平的升高,奥尼罗非鱼的末均体质量、增质量率和特定生长率均呈下降趋势,饲料系数呈升高趋势,其中G100组生长性能显著低于对照组、饲料系数显著高于对照组(P < 0.05);肝胰指数呈升高趋势,但差异不显著。各组间的存活率、摄食量、内脏指数和肥满度均无差异(P>0.05)。
|
|
表 2 印度菜粕替代国产菜粕对奥尼罗非鱼生长性能的影响1) Table 2 Effects of China rapeseed meal replacement by Indian rapeseed meal on growth performance of tilapia, Oreochromis niloticus×O.aureus |
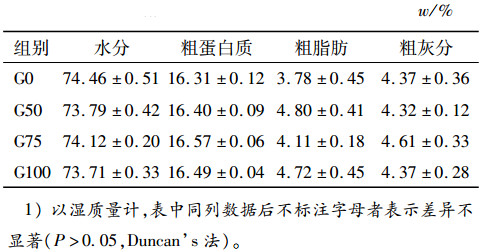
由表 3可知,印度菜粕替代国产菜粕对奥尼罗非鱼全鱼粗蛋白质、粗脂肪、水分和粗灰分含量的影响不显著(P>0.05),但3个替代组均能够在一定程度上降低鱼体水分含量,提高鱼体粗蛋白质及粗脂肪含量。
|
|
表 3 印度菜粕替代国产菜粕对奥尼罗非鱼体组成的影响1) Table 3 Effects of China rapeseed meal replaced by Indian rapeseed meal on body composition of tilapia, Oreochromis niloticus×O.aureus |
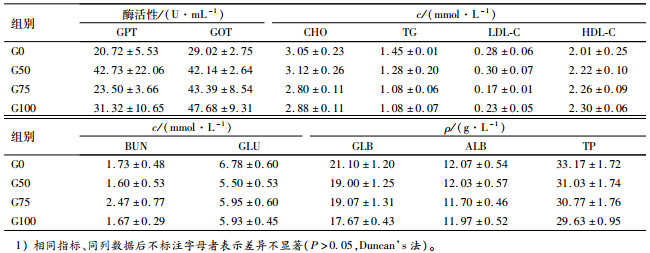
如表 4所示,与对照组G0比较,奥尼罗非鱼血清GPT、GOT活性和高密度脂蛋白胆固醇(HDL-C)含量增加,但差异不显著(P>0.05);三酰甘油(TG)、球蛋白(GLB)、总蛋白(TP)、血糖(GLU)含量呈降低的趋势,但未达到显著性水平(P>0.05)。
|
|
表 4 印度菜粕替代国产菜粕对奥尼罗非鱼血清生化指标的影响1) Table 4 Effects of China rapeseed meal replaced by Indian rapeseed meal on serum biochemical indices of tilapia, Oreochromis niloticus×O.aureus |
如表 5所示,试验组血清NO含量和AKP活性较对照组的降低,但差异不显著(P>0.05)。随着印度菜粕替代水平的增加,奥尼罗非鱼的LZM含量和T-AOC均呈现升高的趋势,其中,G100组显著高于对照组(P < 0.05)。各组间SOD活性差异不显著(P>0.05)。各替代组奥尼罗非鱼血清MDA含量与对照组相比差异不显著(P>0.05),但各替代组间,G50组显著高于G75和G100组(P < 0.05)。
|
|
表 5 印度菜粕替代国产菜粕对奥尼罗非鱼血清免疫、抗氧化指标的影响 Table 5 Effects of China rapeseed meal replaced by Indian rapeseed meal on antioxidant and immune indices of tilapia, Oreochromis niloticus×O.aureus |
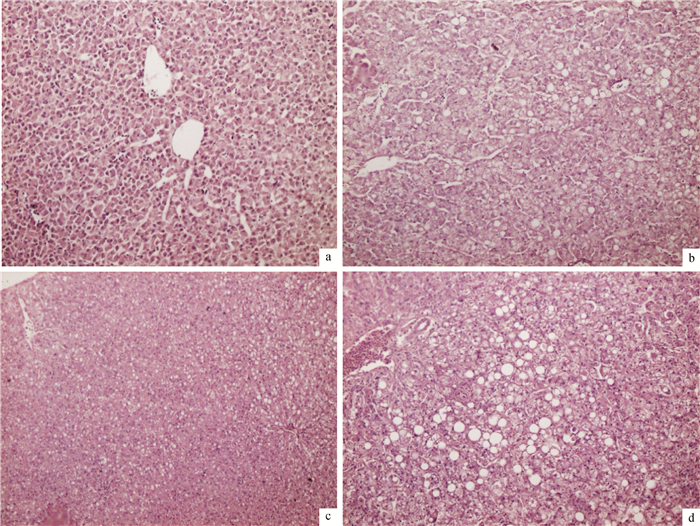
如图 1所示,对照组肝细胞正常,排列均匀规则,细胞核位于肝细胞中央;G50组散在少量肝细胞脂肪变性;G75组散在多量肝细胞脂肪变性;G100组多个区域大量肝细胞脂肪变性。
|
图 1 印度菜粕替代国产菜粕对奥尼罗非鱼肝脏组织切片观察 Figure 1 Effects of China rapeseed meal replaced by Indian rapeseed meal on liver histological observations of tilapia, Oreochromis niloticus×O.aureus a~d分别为G0(对照组)、G50、G75和G100组罗非鱼的肝脏切片;苏木精-伊红(HE)染色10×20。 |
张明明等[5]研究表明,在5~45 g的罗非鱼饲料中菜粕的使用量不宜超过45.0%,且其配方中鱼粉用量达到6%,故本试验在鱼粉用量为2%时选用菜粕用量35%为罗非鱼最大适宜剂量。本研究结果表明,印度菜粕替代75%的国产菜粕即印度菜粕使用量为26.25%并添加0.1%的诱食剂时对奥尼罗非鱼的生长性能和形体指标没有显著影响。与莫文艳等[3]用印度菜粕加诱食剂在奥尼罗非鱼幼鱼的使用量为17.5%时对增质量率、摄食量和肝脏指数已产生负作用不同,但与张伟涛等[2]在38~300 g的罗非鱼饲料中使用28%的印度菜粕加诱食剂不影响其生长、摄食量、饲料系数和形体指标结果接近,跟谭芳等[12]在罗非鱼成鱼饲料中印度菜粕的使用剂量不超过30%的结果吻合。分析其原因是因为不同阶段的罗非鱼对印度菜粕的耐受性不同,15 g以下的罗非鱼幼鱼饲料中印度菜粕使用量要低得多,否则会通过降低摄食量进而影响生长,即使添加诱食剂也不能缓解,而17~70 g与38~350 g生长阶段的罗非鱼虽然摄食量随着印度菜粕的增加而下降,但通过添加合适的诱食剂可以消除差异而不影响生长。斑点叉尾
国内外一些研究表明,不同菜粕水平对鱼类全鱼体组成产生明显影响。金素雅[17]发现印度菜粕和国产菜粕不同水平对草鱼全鱼粗脂肪、肌肉粗脂肪含量存在交互影响,且随着添加水平的增加,全鱼粗蛋白质含量有所降低,粗脂肪含量显著增加。在红鲷鱼[21]和斑点叉尾
一般鱼体内有机成分的分解代谢与合成代谢保持动态平衡,其在血液中的指标值也相对稳定[24]。正常血液指标如生化指标和免疫酶活等不仅能反映动物的健康状况、营养水平等,还能为动物的生理、病理研究等提供重要的参考依据。本研究结果显示,随着替代量的增加,血清中的GPT和GOT呈增加趋势,而TP呈下降趋势,但不显著,与双低菜粕在青鱼中“转氨酶升高和总蛋白下降”的趋势一致[19]。没有达到显著,可能是由于鱼的食性不同导致其对菜粕的耐受性不同。其他指标BUN、CHO、TG、LDL-C、HDL-C、GLB、ALB和GLU各组间无明显规律也无差异(P>0.05),且这些血清生化指标的测试结果都在健康范围[25-26]之内。由此可见,印度菜粕替代国产菜粕对奥尼罗非鱼蛋白质、糖和脂代谢没有显著影响,与金素雅[17]报道的不同菜粕及水平在草鱼中的研究结果一致。与莫文艳等[3]报道的罗非鱼的TG显著升高和Tun等[16]报道的饲料中使用32%或以上的菜粕会显著增加草鱼幼鱼血浆BUN的含量结果不同,可能是因为鱼的规格大小和品种不同。
LZM活性大小在一定程度上反映鱼体抵抗细菌侵袭的能力。LZM主要存在于鱼类黏液、血清、吞噬细胞和单核细胞的胞浆内[27]。本试验中,NO和AKP随着印度菜粕替代量的增加而呈下降趋势,但没有差异;而LZM则增加,在最高组达显著,表明印度菜粕对其机体的刺激更大,在一定程度上提高了奥尼罗非鱼机体非特异性免疫防御力,与金素雅[17]在草鱼中各水平组LSZ活力无差异的结果不同,原因有待进一步探讨。
动物细胞生存要求适当的氧化与抗氧化平衡。鱼体内抗氧化酶的缺乏会导致体内原有的自由基代谢平衡遭到破坏[28]。T-AOC是衡量机体抗氧化系统功能状况的综合性指标[29-30],其大小可代表和反映机体抗氧化酶系统和非酶促系统对外来刺激的代偿能力及机体自由基代谢的状态。MDA是机体被自由基氧化的产物之一,其含量的高低反映了机体细胞受自由基攻击的程度[31]。本研究中罗非鱼血清SOD活力没有差异,与金素雅[17]在草鱼中的报道一致,与张明明等[5]和莫文艳等[3]的结果不同,可能是因为本试验所用奥尼罗非鱼为较大规格,对菜粕的耐受性要强,同样剂量的菜粕不会引起机体SOD变化,而是启动了其他的抗氧化防御系统的相关酶,因为T-AOC是增加的,需要进一步检测一些指标验证。本试验中T-AOC呈增加趋势,G100组显著高于对照组,即奥尼罗非鱼总体抗氧化能力有所增强,说明饲喂高水平印度菜粕短时间(43 d)后,因其抗营养因子含量高导致鱼机体应激严重,启动抗氧化保护防御系统所致,血清MDA含量整体呈下降趋势也验证了这一点。有趣的是,本研究中G50组MDA含量显著高于其他2个试验组,其原因有待进一步探讨;各替代组与对照组的MDA含量没有差异,与草鱼饲料中分别用34.5%印度菜粕和国产菜粕时肝脏MDA含量没有差异的结果一致[17]。
鱼类的肝脏具有解毒功能,但当体内有害物质含量超过一定量时,其对肝脏的毒害作用就会表现出来。唐精等[32]总结指出,饲料植物蛋白中抗营养因子是引起鱼体肝脏病变的成因之一,其中对鱼体肝脏损伤较大的是菜粕中的抗营养因子硫代葡萄糖甙的分解物。张明明等[5]研究报道,随着菜粕水平的增加,罗非鱼幼鱼肝细胞核偏移和空泡变性的数量增加,超过45%用量时肝脏受损程度加剧。本试验中,对照组国产菜粕用量为35%,罗非鱼规格相对较大,肝细胞正常,与已报道结果相似[5]。马利等[15]研究发现,饲料中添加30.0%菜粕时,草鱼肝细胞体积部分稍有变大,出现一些核偏移和空泡变性;菜粕含量达到50%时,肝细胞变性甚至坏死。吴志新等[33]在草鱼和鲤中也有类似的报道,试验28 d后,喂食双低菜粕含量为52.2%的鲤部分肝细胞出现空泡变性;第42天后,双低菜粕含量51%的草鱼肝细胞出现颗粒变性和空泡变性,含量34.8%的鲤肝细胞出现空泡变性,随着投喂时间的延长,鲤肝细胞受损程度加剧。异育银鲫饲料中菜粕含量为60.0%时,肝脏出现受损情况[34]。由此可见,饲料中过量的菜粕可以引起肝脏受损甚至产生病理变化,不同的鱼品种间引起肝脏受损的菜粕用量不同。Tan等[16]报道,在草鱼饲料中添加过高的菜粕造成肝脏损伤,同时用体外细胞试验法验证了异硫氰酸烯丙酯(硫葡萄糖甙的降解产物)是引起肝细胞结构受损的原因。本研究中,随着印度菜粕替代量的增加,奥尼罗非鱼肝脏受损程度相应增加,是由于印度菜粕中的毒素物质硫葡萄糖甙含量高于国产菜粕,使用后其相应的降解产物异硫氰酯也增加造成的。
本试验条件下,在奥尼罗非鱼17~70 g生长阶段印度菜粕替代国产菜粕比例不宜超过75%。
致谢:感谢郏自明和郑艳华老师在组织切片制作和读片上给予的支持和帮助!
| [1] |
陈一淑, 杨琳. 菜籽粕调查研究[J]. 中国饲料添加剂, 2009(12): 35-37. (  0) 0) |
| [2] |
张伟涛, 叶元土, 张宝彤, 等. 诱食剂配合印度菜粕在罗非鱼饲料中的应用[J]. 饲料工业, 2010, 31(10): 21-26. (  0) 0) |
| [3] |
莫文艳, 王国霞, 黄文庆, 等. 印度菜粕替代国产菜粕对奥尼罗非鱼幼鱼生长性能和血清指标的影响[J]. 广东农业科学, 2013, 40(6): 124-127. DOI:10.3969/j.issn.1004-874X.2013.06.037 (  0) 0) |
| [4] |
林仕梅, 麦康森, 谭北平. 菜粕、棉粕替代豆粕对奥尼罗非鱼(Oreochromis niloticus×O.aureus)生长、体组成和免疫力的影响[J]. 海洋与湖沼, 2007, 38(2): 168-172. DOI:10.3321/j.issn:0029-814X.2007.02.013 (  0) 0) |
| [5] |
张明明, 文华, 蒋明, 等. 饲料菜粕水平对吉富罗非鱼幼鱼生长、肝脏组织结构和部分非特异性免疫指标的影响[J]. 水产学报, 2011, 35(5): 748-755. (  0) 0) |
| [6] |
LEE K J, RINCHARD J, DABROWSKI K, et al. Long-term effects of dietary cottonseed meal on growth and reproductive performance of rainbow trout:Three-year study[J]. Anim Feed Sci Tech, 2006, 126(1/2): 93-106. (  0) 0) |
| [7] |
DREW M D, OGUNKOYA A E, JANZ D M, et al. Dietary influence of replacing fish meal and oil with canola protein concentrate and vegetable oils on growth performance, fatty acid composition and organochlorine residues in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2007, 267(1/2/3/4): 260-268. (  0) 0) |
| [8] |
LUNGER A N, MCLEAN E, CRAIG S R. The effects of organic protein supplementation upon growth, feed conversion and texture quality parameters of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2007, 264(1/2/3/4): 342-352. (  0) 0) |
| [9] |
HEIKKINEN J, VIELMA J, KEMILAINEN O, et al. Effects of soybean meal based diet on growth performance, gut histopathology and intestinal microbiota of juvenile rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2006, 261(1): 259-268. DOI:10.1016/j.aquaculture.2006.07.012 (  0) 0) |
| [10] |
BONALDO A, ROEM A J, PECCHINI A, et al. Influence of dietary soybeam meal levels on growth, feed utilization and gut histology of Egyptian sole (Solea aegyptiaca) juveniles[J]. Aquaculture, 2006, 261(2): 580-586. DOI:10.1016/j.aquaculture.2006.08.013 (  0) 0) |
| [11] |
REFSTIE S, LANDSVERK T, BAKKE-MCKELLEP A M, et al. Digestive capacity, intestinal morphology, and microflora of 1-year and 2-year old Atlantic cod (Gadus morhua) fed standard or bioprocessed soybean meal[J]. Aquaculture, 2006, 261(2): 269-284. (  0) 0) |
| [12] |
谭芳, 高启平, 王若军, 等. 三种菜粕对罗非鱼成鱼生长性能的影响[C]//中国水产学会动物营养与饲料专业委员会. 第九届世界华人鱼虾营养学术研讨会论文摘要集. 厦门. 出版地不详: 出版者不详, 2013: 192.
(  0) 0) |
| [13] |
LIM C, KLESIUS P H, HIGGS D A. Substitution of canola meal for soybean meal in diets for channel catfish(Ictalurus punctatus)[J]. World Aquac Soc, 1998, 29(2): 161-168. DOI:10.1111/jwas.1998.29.issue-2 (  0) 0) |
| [14] |
DAVIES S J, MCCONNELL S, BATESON R I. Potential of rapeseed meal as an alternative protein source in complete diets for tilapia (Oreochromis mossambicus Peters)[J]. Aquaculture, 1990, 87(2): 145-154. DOI:10.1016/0044-8486(90)90271-N (  0) 0) |
| [15] |
马利, 黄峰, 吴建开, 等. 不同菜粕水平对草鱼生长、血清生化指标和毒素残留的影响[J]. 水产学报, 2005, 29(6): 798-803. (  0) 0) |
| [16] |
TAN Q S, LIU Q, CHEN X X, et al. Growth performance, biochemical indices and hepatopancreatic function of grass carp, Ctenopharyngodon idellus, would be impaired by dietary rapeseed meal[J]. Aquaculture, 2013, 414/415: 119-126. DOI:10.1016/j.aquaculture.2013.07.036 (  0) 0) |
| [17] |
金素雅. 四种菜籽饼粕在草鱼饲料中的应用研究[D]. 苏州: 苏州大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10285-1012285673.htm
(  0) 0) |
| [18] |
高贵琴, 熊邦喜, 赵振山, 等. 不同水平双低菜粕替代蛋白对鱼类生长的影响[J]. 水利渔业, 2004, 24(3): 55-57. DOI:10.3969/j.issn.1003-1278.2004.03.021 (  0) 0) |
| [19] |
黄云, 胡毅, 肖调义, 等. 双低菜粕替代豆粕对青鱼幼鱼生长及生理生化指标的影响[J]. 水生生物学报, 2012, 36(1): 41-47. (  0) 0) |
| [20] |
刘文斌, 王爱民, 王恬. 菜籽粕中芥子酸和硫甙对异育银鲫生长和生理机能的影响[J]. 南京农业大学学报, 2004, 27(1): 78-80. DOI:10.3969/j.issn.1671-7465.2004.01.021 (  0) 0) |
| [21] |
TAKⅡ K, KITA E, NAKAMURA M, et al. Evaluation of canola protein concentration as protein source of diet for red sea bream[J]. Fish Sci, 1999, 65(1): 150-154. DOI:10.2331/fishsci.65.150 (  0) 0) |
| [22] |
刘修英, 王岩, 王建华. 利用豆粕、菜粕和棉粕替代饲料中鱼粉对苏氏圆腹摄食、生长和饲料利用的影响[J]. 水产学报, 2009, 33(3): 479-487. (  0) 0) |
| [23] |
HIGGS D A, MCBRIDE J R, MARKERT J R, et al. Evaluation of tower and candle rapeseed (canola) meal and bronowski rapeseed protein concentrate as protein supplements in practical dry diets for juvenile chinook salmon (Oncorhynchus tshawytscha)[J]. Aquaculture, 1982, 29(1/2): 1-31. (  0) 0) |
| [24] |
林浩然. 鱼类生理学[M]. 广州: 广东高等教育出版社, 1999.
(  0) 0) |
| [25] |
尾崎久雄. 鱼类血液与循环生理[M]. 许学龙, 熊国强, 缪圣赐, 等译. 上海: 上海科学技术出版社, 1982: 27-182.
(  0) 0) |
| [26] |
聂国兴, 明红, 郑俊林, 等. 木聚糖酶对尼罗罗非鱼血液生理生化指标的影响[J]. 大连水产学院学报, 2009, 22(5): 361-365. (  0) 0) |
| [27] |
李凌, 吴灶和. 鱼类体液免疫研究进展[J]. 海洋科学, 2001, 25(11): 20-22. DOI:10.3969/j.issn.1000-3096.2001.11.007 (  0) 0) |
| [28] |
戴伟, 金成官, 傅玲琳, 等. 饲料铅暴露对罗非鱼肝胰脏抗氧化防御系统及显微结构的影响[J]. 浙江大学学报(农业与生命科学版), 2009, 35(3): 350-354. (  0) 0) |
| [29] |
管越强, 李利, 王慧春, 等. 低氧胁迫对日本沼虾呼吸代谢和抗氧化能力的影响[J]. 河北大学学报, 2010, 30(3): 301-306. DOI:10.3969/j.issn.1000-1565.2010.03.017 (  0) 0) |
| [30] |
ZENTENO-SAVIN T, SALDIEMA R, AHUEJOTE-SANDOVAL M. Superoxide radical production in response to environmental hypoxia in cultured shrimp[J]. Com Biochem Physiol: Part C:Toxicol Pharmacol, 2006, 142(3/4): 301-308. (  0) 0) |
| [31] |
BHARRHAN S, CHOPRA K, RISHI P. Vitamin E supplementation modulates endotoxin-induced liver damage in a rat model[J]. Am J Biomed Sci, 2010, 2(1): 51-62. (  0) 0) |
| [32] |
唐精, 叶元土, 李爱琴, 等. 饲料引起鱼体肝脏病变的成因及预防[J]. 广东饲料, 2012, 21(2): 45-48. DOI:10.3969/j.issn.1005-8613.2012.02.023 (  0) 0) |
| [33] |
吴志新, 覃江凤, 陈孝煊, 等. 双低菜籽粕对草鱼和鲤甲状腺、肝、肾组织结构的影响[J]. 华中农业大学学报, 2006, 25(4): 426-430. DOI:10.3321/j.issn:1000-2421.2006.04.021 (  0) 0) |
| [34] |
蒋春琴, 冷向军, 李小勤, 等. 饲料中菜粕和棉粕的不同配比对异育银鲫生长性能、血浆生化指标和棉酚残留的影响[J]. 水产学报, 2010, 34(12): 1917-1925. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37