2. 上海海洋大学 水产与生命学院,上海 201306
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China
硝基还原酶B (Nitroreductase B,nfsB)基因源于大肠埃希菌Escherichia coli B,其编码的硝基还原酶(Nitroreductase,NTR)蛋白能与包括甲硝唑(Metronidazole,Mtz)在内的含有硝基基团的化合物结合,产生具有细胞毒性的活性物质。该产物能够有效地结合于DNA双链上,抑制细胞核酸的合成,干扰细胞的生长,并最终导致细胞死亡[1-2]。因而,通过转基因等技术使某种细胞特异表达NTR,在Mtz的诱导下可对特定器官或组织进行条件性消除,这已成为研究器官功能和再生的有效方法[3-8]。
斑马鱼Danio rerio个体小、养殖简单、性成熟周期短、体外发育且胚体透明,相关的胚胎和遗传学操作技术成熟,不仅成为重要的脊椎动物模式物种,同时也可作为模型动物用于水产动物基础技术的相关研究[9]。NTR/Mtz系统在斑马鱼中也有所发展,在肝脏、心脏、胰腺等器官消融与再生的相关机制研究得到了良好应用[10],与哺乳动物比较更便于对标记细胞的实时观察和追踪。
近年来,鱼类生殖细胞移植技术有所发展,为鱼类快速繁育和种子保存提供新的可能[11]。以成熟个体作为“代理亲鱼”(受体鱼)时,通常选用三倍体个体或毒物处理亲鱼的方法以去除受体本身的生殖细胞[12-13],利用转基因技术构建鱼类NTR/Mtz系统或为受体鱼的制备提供新的思路和可能。研究者利用G4VP16/UAS系统构建了在卵巢特异表达硝基还原酶的转基因斑马鱼,可人为控制卵巢的消融,对于鱼类生殖系统发育与再生研究有重要意义[14]。在以上研究的基础上,本研究利用Tol2转座系统[15]构建斑马鱼卵细胞特异表达的转基因载体,获得转基因斑马鱼品系[Tg(zpc:nfsB-mCherry)],在透明带蛋白C(Zona pellucida C, zpc)基因[16]启动子控制下,该品系在卵巢组织特异表达NTR,Mtz作用可使其卵细胞凋亡,导致卵巢萎缩,或可作为“代理亲鱼”应用于异体生殖细胞移植研究。
1 材料与方法 1.1 试验动物斑马鱼Tuebingen(Tu)品系,养于循环水养殖系统中,水温为28.5 ℃,人工控制光照明暗周期为14 h: 10 h。仔鱼先以草履虫作为开口饲料,逐渐添加丰年虾及配合饲料,成鱼主要喂食配合饲料,每天早晚各投料1次。
1.2 主要试剂和仪器所有限制性内切酶、pMD18-T、Taq酶为TaKaRa公司产品;质粒小量提取试剂盒、胶回收试剂盒为Omega公司产品;二甲基亚砜(DMSO)、Mtz为Sigma公司产品;mMESSAGE mMACHINE® Kit为Life公司产品;PCR纯化试剂盒为Qiagen公司产品;原位细胞凋亡检测试剂盒为罗氏公司产品;体式荧光显微镜(SMZ1270)为Nikon公司产品;EVOS FL Auto为Life公司产品;显微注射仪为NARISHIGE公司产品;斑马鱼养殖水槽为上海海圣生物实验设备有限公司产品;LRH系列生化培养箱为上海一恒科技有限公司产品;冷冻切片机、RM2135型石蜡切片机为Leica公司产品。
1.3 构建转基因斑马鱼品系 1.3.1 Tol2-zpc-nfsB-mCherry质粒构建以斑马鱼基因组为模板,通过PCR的方法扩增出zpc基因启动子片段;分别以大肠埃希菌基因组DNA和含荧光蛋白基因mCherry序列的表达质粒(购自TaKaRa Clontech)为模板,通过PCR扩增出编码nfsB和mCherry基因的CDS序列,通过重叠PCR,扩增nfsB-mCherry的CDS片段;以含SV40-poly(A)序列的质粒为模板,通过PCR扩增出SV40-poly(A)片段。利用在线分析工具BLAST (http://www.ncbi.nlm.nih.gov/BLAST/)分析判断上述扩增片段,无误后将上述3个片段接入Tol2骨架中,构成Tol2-zpc-nfsB-mCherry质粒并测序验证(所有引物见表 1)。
|
|
表 1 质粒构建及品系筛选PCR引物 Table 1 PCR primers for plasmids construction and strain screening |
PCS质粒编码转座酶蛋白,该酶催化供体质粒发生转座反应[17]。PCS质粒Not Ⅰ酶内切线性化,纯化试剂盒纯化后,作为模板按mMESSAGE mMACHINE® Kit说明书,体外合成5′帽子结构的转座酶mRNA。
1.3.3 显微注射分光光度计测定Tol2-zpc-nfsB-mCherry质粒及转座酶mRNA的浓度,分别调整为200 ng·μL-1、100 ng·μL-1,等量混合,显微注射至一细胞期斑马鱼胚胎,注射部位在卵黄囊与胚体交汇处,每个胚胎注射约为1~2 nL。
1.3.4 转基因品系筛选经注射胚胎孵化的斑马鱼为F0代。F0饲养至性成熟挑选母鱼,与野生型公鱼交配,F1胚胎发育至囊胚期时,于荧光显微镜下挑选出现特异红色荧光的胚胎继续培育。F1至2月龄时剪尾鳍,提取DNA,用针对nfsB基因特异引物(nfsBS, nfsBA, 见表 1)进行检测,阳性个体用于品系构建或后续研究。取2~3月龄上述个体,卵巢组织于荧光显微镜下观察其荧光标记状况。
1.4 NTR/Mtz系统处理转基因斑马鱼品系5 mmol·L-1 Mtz用养殖水配置, φ为0.2%的DMSO助溶,随配随用。20尾转基因及4尾野生型雌性成鱼,在1 L养殖水槽中饲养,野生型剪掉部分尾鳍,以便区分。试验过程温度保持在(28±1) ℃,并注意避光以免Mtz分解。整个试验过程每天投喂1次,喂食结束,各组换用新鲜配置的Mtz溶液。
外观及解剖观察:采样时间分别为转基因鱼在处理第0、4、8、12天及撤销Mtz后第10、20天,野生型在处理第0、12天,每次1尾,用Tricaine麻醉,观察腹部大小变化;然后,将鱼的单侧腹部皮肤剪掉,暴露卵巢位置,观察卵巢的大小、形态。组织切片观察:用Bouns固定液固定处理0、4、8、12 d转基因鱼,梯度乙醇脱水, 二甲苯透明, 石蜡包埋, 横向连续切片(厚度约3 μm),H&E染色, 脱水封片,显微镜观察卵巢结构及卵细胞变化。TUNEL细胞凋亡检测:对处理1 d的野生型及转基因鱼用0.04 g·mL-1多聚甲醛固定,PBST冲洗,蔗糖脱水,取卵巢部位放入包埋剂,调整到合适位置,置于-20 ℃条件下,包埋剂凝固后进行冰冻切片(厚度约10 μm)。根据原位细胞凋亡检测试剂盒说明对冰冻切片进行TUNEL细胞凋亡检测。
2 结果与分析 2.1 获得Tg(zpc:nfsB-mCherry)转基因斑马鱼对每个片段测序,斑马鱼zpc启动子长416 bp,nfsB-mCherry融合蛋白cDNA序列长1 362 bp,SV40-poly(A)加尾信号长833 bp(图 1A),通过在线分析工具BLAST对测序结果进行核苷酸和氨基酸的序列比对分析,与预期完全吻合, 并接入Tol2,形成Tol2-zpc-nfsB-mCherry转基因表达载体(图 1B)。

|
图 1 转基因鱼质粒构建及荧光观察 Figure 1 Transgenic fish plasmid construction and fluorescence observation A:转基因表达元件;B:Tol2转基因表达载体;C、D分别为转基因F1代囊胚期自然光与荧光下图片; E、F分别为转基因F1代性成熟卵巢自然光与荧光下图片;标尺=50 μm。 |
筛选了20尾F0雌鱼,其中2尾产的胚胎囊胚期能观察到红色的特异荧光(图 1D);在2尾鱼产的400多颗卵中,共获得阳性胚胎76个;阳性个体培育至2月龄,通过PCR鉴定确认其已转入nfsB基因;选取部分经上述鉴定鱼,取卵巢,荧光下观察到卵巢组织有明显的特异荧光(图 1F)。
2.2 转基因斑马鱼卵巢消融与再生的外观及解剖观察转基因鱼Mtz处理之前卵巢中卵粒充盈,形态、大小与野生型类似(图 2A);4 d腹部外观大小基本无变化,卵巢轻度萎缩,卵粒轻微塌陷(图 2B);8 d鱼腹部明显变小,卵巢严重萎缩,卵粒变小,数量也明显减少(图 2C);12 d鱼腹部变小更加明显,甚至有些凹陷,基本没有卵粒,整个消融的卵巢形成明显的空腔(图 2D);撤销Mtz,恢复10 d鱼腹部开始隆起,解剖发现卵粒开始增加(图 2E);20 d鱼腹部已经恢复到浸泡之前的大小,解剖发现卵粒基本恢复正常(图 2F)。Mtz浸泡12 d的野生型鱼外观大小基本无变化,解剖发现卵巢中充满粗大卵粒(图 2G)。

|
图 2 转基因斑马鱼卵巢消融与再生的外观及解剖图 Figure 2 External appearance and internal ovarian morphology of Tg(zpc:nfsB-mCherry) female during the process of ovarian ablation and regeneration A:Tg(zpc:nfsB-mCherry)鱼处理前;B、C、D分别为Tg(zpc:nfsB-mCherry)鱼浸泡5 mmol·L-1 Mtz 4、8、12 d;E、F分别为Tg(zpc:nfsB-mCherry)鱼撤销Mtz恢复10、20 d;G:野生型鱼浸泡5 mmol·L-1 Mtz 12 d。 |
未经Mtz处理Tg(zpc:nfsB-mCherry)成鱼卵巢存在第Ⅱ、Ⅲ、Ⅳ时相细胞,以Ⅳ时相细胞为主,第Ⅳ时相卵母细胞已充分发育, 呈圆球形, 细胞质中充满粗大的卵黄颗粒(图 3A);Mtz处理3 d后,第Ⅳ时相卵母细胞出现萎缩,数量减少,其余细胞变化不明显(图 3B);8 d时,第Ⅲ时相、Ⅳ时相细胞皱缩,导致卵巢结构变得松散,边缘不整(图 3C);12 d时,各时期细胞基本消失,仅存极少数第Ⅱ时相细胞,可见卵巢的支撑结构(图 3D)。
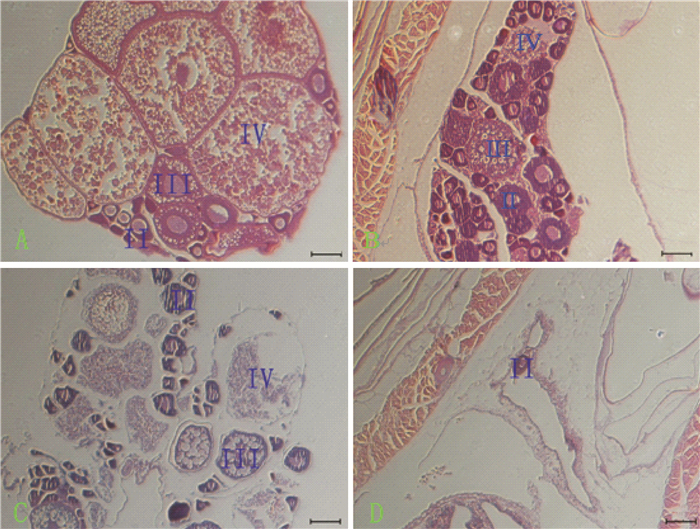
|
图 3 转基因斑马鱼卵巢消融的石蜡切片H&E染色 Figure 3 Images of Tg(zpc:nfsB-mCherry) female ovarian paraffin sections with H&E staining during ovarian ablation Ⅱ、Ⅲ、Ⅳ分别代表第Ⅱ、Ⅲ、Ⅳ时相卵母细胞; A为Tg(zpc:nfsB-mCherry)鱼Mtz处理前;B、C、D分别为Tg(zpc:nfsB-mCherry)鱼浸泡5 mmol·L-1 Mtz 4、8、12 d;标尺=100 μm。 |
通过TUNEL细胞凋亡检测,凋亡细胞DNA断裂产生的大量黏性3′—OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,被荧光素染成绿色小点。荧光显微镜下,虽然对照组(图 4B)和处理组(图 4D)均可观察到绿色荧光,但处理组的荧光强度远比对照组明显,且密集分布于卵壳位置,勾勒出卵细胞的基本形状,说明经Mtz处理1 d的转基因鱼卵细胞透明带位置出现了明显的细胞凋亡。对照组也能观察到微弱的荧光,表明卵巢作为代谢活跃的器官,存在正常的细胞凋亡现象。而转基因鱼在zpc启动子驱动下于透明带特异表达NTR,与Mtz结合导致大量卵细死亡;随着Mtz作用时间增加,凋亡细胞为组织重新吸收利用,卵巢便成为由支持细胞组成的空腔结构(图 2D)。
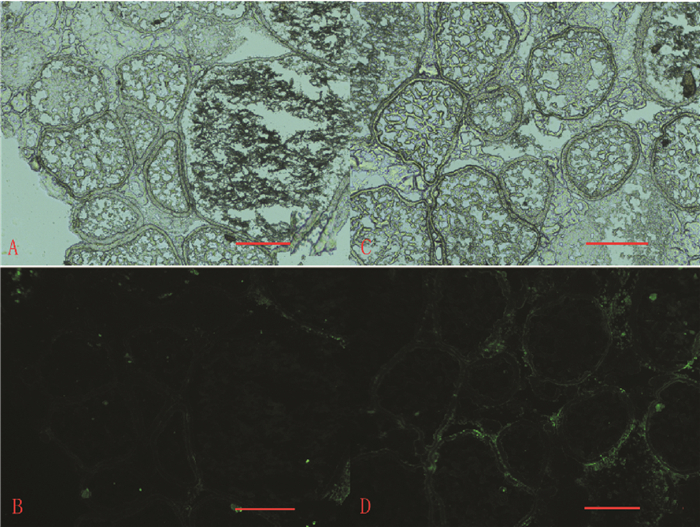
|
图 4 转基因斑马鱼Mtz (5 mmol·L-1)处理1 d卵巢的TUNEL检测 Figure 4 TUNEL detection of Tg(zpc:nfsB-mCherry) female ovarian after 1 d exposure to Mtz (5 mmol·L-1) A、B分别为野生型鱼卵巢自然光、荧光图片;C、D分别为Tg(zpc:nfsB-mCherry)鱼卵巢自然光、荧光图片;标尺=100 μm。 |
本研究获得了稳定遗传的转基因斑马鱼品系Tg(zpc:nfsB-mCherry),该品系可在卵巢组织特异表达NTR,因而可通过Mtz胁迫的方法实行对卵巢的条件性去除。Mtz作为一种抗厌氧菌和杀原虫药物,大剂量或长时间作用或对鱼体造成不良影响,故其作用时间和剂量是条件去除过程的关键问题[18]。斑马鱼关于Mtz的使用浓度相关报道集中于5~10 mmol·L-1[19-20],笔者也就Mtz对幼鱼的毒性进行预试验,发现10 mmol·L-1时短暂浸泡对斑马鱼的影响不太明显,而长期胁迫甚至可导致少量鱼的死亡,故若使用10 mmol·L-1的高浓度时应尽量缩短浸泡时间。
本研究主要针对成鱼卵巢,考虑到该器官相对于鱼体而言是较大的成熟组织,故采用低浓度(5 mmol·L-1)长时间(12 d)的浸泡,也取得了预期的效果。Curado等[10]用10 mmol·L-1的Mtz作用由不同启动子驱动NTR的转基因斑马鱼幼鱼,24 h后心脏、胰腺、肝脏等出现细胞消融,并伴随相应的功能缺陷;White等[14]采用5 mmol·L-1的Mtz作用转基因动物,也可导致卵巢的条件性去除;Hsu等[19]也是用5 mmol·L-1的Mtz处理转基因斑马14 d,精巢被完全或部分破坏,这与笔者的试验结果相吻合,说明5~10 mmol·L-1浸泡是较为合适的作用方式。本研究作用对象为成熟雌鱼,Mtz的给药方式除了浸泡,也可通过投喂方式给药。口服方法可使鱼体内Mtz保持合适浓度,减少体外高剂量药剂对鱼体鳃等组织的长期胁迫,可能是我们模型后续应用的更好选择。
在哺乳动物上,透明带除了作为受体防止多精入卵外,还能为卵细胞的发育提供营养,发育到一定阶段的卵母细胞营养物质靠其微绒毛和放射冠细胞的突起伸入透明带来获取[21-22]。本研究获得的转基因鱼在zpc启动子驱动下于卵细胞透明带特异表达NTR,在Mtz的作用初期,通过TUNEL检测可发现卵细胞透明带位置出现凋亡,推测NTR与Mtz形成复合物,结合细胞DNA双链发挥功能。透明带消融可能断绝卵母细胞发育的物质来源,随着卵细胞的逐渐消失造成整个卵巢的萎缩[23]。当撤销Mtz的胁迫,斑马鱼恢复20 d后,外观上卵巢基本恢复,30 d后与正常雄鱼交配仍可产生健康后代(结果在文章未体现),表明由于环境中没有Mtz,生殖相关干细胞发育成的卵细胞虽还表达NTR,但不会因复合物作用而凋亡,能逐渐发育成成熟卵细胞并恢复生殖功能。从目前研究分析,NTR/Mtz系统对成熟细胞的条件性去除都是可逆的,而针对于干细胞的消融可能对个体的影响更为复杂,因而,Mtz对我们获得的转基因品系发育早期的影响还值得进一步研究。
目前,提高鱼类异体(种)生殖细胞移植成功和转化效率可从供体和受体2方面入手:保障供体生殖细胞或干细胞的浓度、纯度、活力等;有效移除受体自身功能细胞,减少此类细胞对发育的影响。以斑马鱼作为受体的相关研究中,通常采用Morpholino方法在胚胎期针对dnd、vasa等早期发育基因干扰斑马鱼原始生殖细胞(PGC)的形成以去除受体本身生殖细胞[24]。研究又发现,PGC的缺失或减少可使鱼体趋向于雄性化发展[25],故在以成鱼作为受体的移植应用上或只能获得雄鱼个体,一定程度上限制了应用。本研究获得的斑马鱼品系能条件性消融生殖系用的功能性细胞——卵细胞,但仍保留卵巢的支持结构,作为受体应可接受外来的生殖原细胞甚至于PGC,或可作为雌性受体系统发展,为鱼类“代理亲鱼”技术的发展提供材料基础和技术思路。
| [1] |
孔德明, 秦帅, 李珊珊. 构建甲硝唑诱导转基因斑马鱼胰岛β细胞的破坏模型[J]. 贵阳中医学院学报, 2013, 35(3): 45-47. DOI:10.3969/j.issn.1002-1108.2013.03.0020 (  0) 0) |
| [2] |
FELMER R N, CLARK J A. The gene suicide system Ntr/CB1954 causes ablation of differentiated 3T3L1 adipocytes by apoptosis[J]. Biol Res, 2004, 37(3): 449-460. (  0) 0) |
| [3] |
李心乐. 斑马鱼松果体对视觉敏感性生物钟的维持作用及长时记忆缺陷突变体的筛选[D]. 天津: 南开大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10055-1014171904.htm
(  0) 0) |
| [4] |
CHEN C F, CHU C Y, CHEN T H, et al. Establishment of a transgenic zebrafish line for superficial skin ablation and functional validation of apoptosis modulators in vivo[J]. Plos One, 2011, 6(5): e20654-e20654. DOI:10.1371/journal.pone.0020654 (  0) 0) |
| [5] |
CHUNG A Y, KIM P S, KIM S, et al. Generation of demyelination models by targeted ablation of oligodendrocytes in the zebrafish CNS[J]. Mol Cells, 2013, 36(1): 82-87. DOI:10.1007/s10059-013-0087-9 (  0) 0) |
| [6] |
MATHIAS J R, ZHANG Z, SAXENA M T, et al. Enhanced cell-specific ablation in zebrafish using a triple mutant of Escherichia coli nitroreductase[J]. Zebrafish, 2014, 11(2): 85-97. DOI:10.1089/zeb.2013.0937 (  0) 0) |
| [7] |
SHIMIZU Y, ITO Y, TANAKA H, et al. Radial glial cell-specific ablation in the adult zebrafish brain[J]. Genesis, 2015, 53(7): 431-439. DOI:10.1002/dvg.v53.7 (  0) 0) |
| [8] |
WILLEMS B, BUTTNER A, HUYSSEUNE A, et al. Conditional ablation of osteoblasts in medaka[J]. Dev Biol, 2012, 364(2): 128-137. DOI:10.1016/j.ydbio.2012.01.023 (  0) 0) |
| [9] |
贾顺姬, 孟安明. 中国斑马鱼研究发展历程及现状[J]. 遗传, 2012, 34(9): 1082-1088. (  0) 0) |
| [10] |
CURADO S, STAINIER D Y R, ANDERSON R M. Nitroreductase-mediated cell/tissue ablation in zebrafish: A spatially and temporally controlled ablation method with applications in developmental and regeneration studies[J]. Nat Protoc, 2008, 3(6): 948-954. DOI:10.1038/nprot.2008.58 (  0) 0) |
| [11] |
SAITO T, GOTO-KAZETO R, KAWAKAMI Y, et al. The mechanism for primordial germ-cell migration is conserved between Japanese eel and zebrafish[J]. Plos One, 2011, 6(9): e24460. DOI:10.1371/journal.pone.0024460 (  0) 0) |
| [12] |
覃钦博, 戴婧, 刘少军, 等. 异源三倍体鲫鲂的遗传组成和生殖特性观察[J]. 水产学报, 2014, 38(3): 356-361. (  0) 0) |
| [13] |
王群. 双酚A诱导小鼠睾丸生殖细胞凋亡的分子机制[D]. 安徽: 安徽医科大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10366-1011162662.htm
(  0) 0) |
| [14] |
WHITE Y A R, WOODS D C, WOOD A W. A transgenic zebrafish model of targeted oocyte ablation and de novo oogenesis[J]. Dev Dynam, 2011, 240(8): 1929-1937. DOI:10.1002/dvdy.v240.8 (  0) 0) |
| [15] |
陈婷芳, 罗娜, 谢华平, 等. 利用Tol2转座子构建斑马鱼心脏组织特异表达转基因载体及其表达分析[J]. 生物工程学报, 2010, 26(2): 230-236. (  0) 0) |
| [16] |
ONICHTCHOUK D, ADUROJA K, BELTING H G, et al. Transgene driving GFP expression from the promoter of the zona pellucida gene zpc is expressed in oocytes and provides an early marker for gonad differentiation in zebrafish[J]. Dev Dynam, 2003, 228(3): 393-404. DOI:10.1002/dvdy.10392 (  0) 0) |
| [17] |
PENG K C, PAN C Y, CHOU H N, et al. Using an improved Tol2 transposon system to produce transgenic zebrafish with epinecidin-1 which enhanced resistance to bacterial infection[J]. Fish Shellfish Immun, 2010, 28(5): 905-917. (  0) 0) |
| [18] |
BURTIN P, TADDIO A, ARIBURNU O, et al. Safety of metronidazole in pregnancy: A meta-analysis[J]. Am J Obstet Gynecol, 1995, 172(2): 525-529. DOI:10.1016/0002-9378(95)90567-7 (  0) 0) |
| [19] |
HSU C C, HOU M F, HONG J R, et al. Inducible male infertility by targeted cell ablation in zebrafish testis[J]. Mar Biotechnol, 2010, 12(4): 466-478. DOI:10.1007/s10126-009-9248-4 (  0) 0) |
| [20] |
HUANG J, MCKEE M, HUANG H D, et al. A zebrafish model of conditional targeted podocyte ablation and regeneration[J]. Kidney Int, 2013, 83(6): 1193-1200. DOI:10.1038/ki.2013.6 (  0) 0) |
| [21] |
国玉蕊, 黄国宁, 王亚平, 等. 透明带结构与受精结局的关系分析[J]. 生殖医学杂志, 2010, 19(2): 154-156. DOI:10.3969/j.issn.1004-3845.2010.02.018 (  0) 0) |
| [22] |
徐丽. 卵透明带蛋白ZPC免疫抗受精机理的研究[D]. 北京: 中国科学院动物研究所, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y969522
(  0) 0) |
| [23] |
HU S Y, LIN P Y, LIAO C H, et al. Nitroreductase-mediated gonadal dysgenesis for infertility control of genetically modified zebrafish[J]. Mar Biotechnol, 2010, 12(5): 569-578. DOI:10.1007/s10126-009-9244-8 (  0) 0) |
| [24] |
SLANCHEV K, STEBLER J, GOUDARZI M, et al. Control of dead end localization and activity-implications for the function of the protein in antagonizing miRNA function[J]. Mech. Dev, 2009, 126(3): 270-277. (  0) 0) |
| [25] |
DRANOW D B, TUCKER R P, DRAPER B W. Germ cells are required to maintain a stable sexual phenotype in adult zebrafish[J]. Dev Biol, 2013, 376(1): 43-50. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37



