2. 华南农业大学 材料与能源学院,广东 广州 510642
2. College of Materials and Energy, South China Agricultural University, Guangzhou 510642, China
硝磺草酮(甲基磺草酮),化学名称为2-[4-(甲基磺酰基)-2-硝基苯酰基]-3-环己二酮,是一类能够抑制羟基苯基丙酮酸酯双氧化酶(HPPD), 使杂草产生白化症状的新型三酮类除草剂,适用于苗前与苗后[1]。硝磺草酮是在玉米田上单独使用或与阿特拉津和氯乙酰胺混用的广谱性除草剂,对环境友好[2]。但是随着硝磺草酮使用量和施用频数增加,对环境的潜在影响逐步体现[3]。因此,研究硝磺草酮的生物修复技术,对农产品安全生产和环境保护具有重要的前瞻意义。
微生物分解除草剂在农药降解中占很大比重[4], 生物修复高效、安全、花费少、应用范围广[5], 但菌株田间使用率低和田间不确定因素多,降解菌制剂开发力度小、难度大。微生物的固定化技术可以将优势菌种固定,使其保持较高的活性,而且可以反复、连续利用,从而提高降解效率[6-8],具有单位体积内微生物细胞密度高、反应迅速、稳定性高、耐毒害能力强等优点[9]。目前,蔗渣已成功运用于造纸工业、乙醇、氢气和木糖醇生产、食用菌栽培、高性能吸附材料开发等[10]。蔗渣在生产乙醇和木糖醇的过程中,是将目标微生物或细胞固定在蔗渣上,然后通过化学反应生产目标产物[11]。已有研究[12]表明利用蔗渣和海绵作为载体的固定化微生物除油效果良好。选用蔗渣作为农药残留降解菌制剂的载体材料,制作方便、资源丰富、成本低廉、商业化前景广阔,具有不可小觑的发展潜力。本文筛选并评价了MSB、MSB-Mo、MSB-Cl及活性炭对降解菌HZ-2的固菌能力,以期为固定化微生物技术在农药降解方面的应用提供理论依据。
1 材料与方法 1.1 材料供试菌株:以硝磺草酮为碳源的菌株HZ-2,由华南农业大学昆虫毒理研究室从农药厂废水处理池活性污泥中筛选而得。根据其生理生化特性和16S rDNA序列同源性分析,将该菌株鉴定为短小芽孢杆菌Bacillus pumilus[13]。
LB液体培养基:蛋白胨10 g·L-1,酵母提取物5 g·L-1,氯化钠10 g·L-1;固体培养基为液体培养基添加15 g·L-1的琼脂。
改性蔗渣MSB、MSB-Mo及MSB-Cl由华南农业大学材料与能源学院蒋刚彪教授课题组提供,具体改性方法见文献[14]。活性炭40和100目,购自上海海诺炭业有限公司。
药剂:硝磺草酮标准品,纯度98%(w),由广东省佛山市盈辉作物科学有限公司提供。
1.2 方法 1.2.1 降解菌的培养与降解菌制剂的制备将菌株HZ-2接种于LB固体培养基平板上,30 ℃恒温培养36 h,挑取生长良好的单菌落,无菌操作条件下接种到LB液体培养基中,于30 ℃、180 r·min-1摇床培养,4 800 r·min-1离心10 min收集菌体,用无菌水洗涤后稀释成不同浓度的菌悬液。取0.1 g载体材料,加入108 cfu·mL-1菌液2 mL后密封,30 ℃、180 r·min-1震荡培养,挂膜24 h后离心,无菌水冲洗沉淀,20 ℃真空烘至近干。多次制备密封待用。
1.2.2 载体中降解菌的生长动态测定将固有降解菌的载体材料0.1 g置于50 mL LB液体培养基中,用同等质量的载体材料处理及108 cfu·mL-1菌液2 mL处理为对照,30 ℃、180 r·min-1振荡培养,测定培养0、24、48 h后的D600 nm。
1.2.3 硝磺草酮在LB培养基中添加回收率的测定取灭菌新鲜LB培养基50 mL,添加硝磺草酮母液,使其最终质量浓度分别为1、5、10 mg·L-1, 3个重复。加二氯甲烷30 mL后超声20 min,混合液移入分液漏斗,用30 mL二氯甲烷分2次冲洗,冲洗液一并移入分液漏斗,摇匀,剧烈振荡3~5 min,静置分层,下层经20 g无水硫酸钠过滤至圆底烧瓶,重复萃取3次,滤液并入烧瓶,45 ℃浓缩至近干,用乙腈分3次洗涤圆底烧瓶并定容至10 mL,最后取2 mL经0.45 μm有机滤膜过滤至进样瓶,HPLC法检测。
1.2.4 降解菌制剂活性的初步测定将固菌制剂0.1 g置于50 mL LB液体培养基中,培养基中初始硝磺草酮50 mg·L-1,震荡培养3 d后,离心取上清液,HPLC法检测。
HPLC检测参照文献[13]:HP-1100型高效液相色谱工作站(Agilent,美国),C18反相柱(Kromasil C18 4.6 mm×150 mm, 5 μm, 100 A),流动相为V(甲醇): V(w为0.05%的磷酸溶液)=55: 45,流速1 mL·min-1,柱温30 ℃,检测波长268 nm,进样量10 μL。
1.2.5 硝磺草酮在土壤中添加回收率的测定取20 g土壤于250 mL三角瓶,添加硝磺草酮母液,使其最终浓度为1、5、10 mg·kg-1, 3个重复,加入60 mL V(蒸馏水): V(乙腈) =1: 5的混合溶液超声30 min,过滤至装有5 g氯化钠的具塞量筒,震荡分层,取上清液25 mL于圆底烧瓶,55 ℃浓缩至近干,用乙腈分3次洗涤圆底烧瓶并定容至10 mL,最后取2 mL溶液经0.45 μm有机滤膜过滤至进样瓶,待HPLC法检测。
1.2.6 降解菌制剂在土壤中的活性测定取10 g灭菌土壤于150 mL三角瓶,添加硝磺草酮母液,使其最终浓度为100 mg·kg-1。加入0.1 g降解菌制剂和10 mL无菌水后震荡均匀,以直接加入菌液的土壤处理为对照,封闭震荡培养5 d。HPLC法测定土壤中硝磺草酮的残留量,计算降解率。
1.2.7 添加葡萄糖对制剂降解活性的影响在每0.1 g降解菌制剂中添加5 mg葡萄糖,加入10 g灭菌土壤置于150 mL三角瓶,加入10 mL无菌水后震荡均匀,使土壤硝磺草酮终浓度为50 mg·kg-1,封闭震荡培养,测定3、5、7 d后土壤中硝磺草酮的残留量,计算降解率。
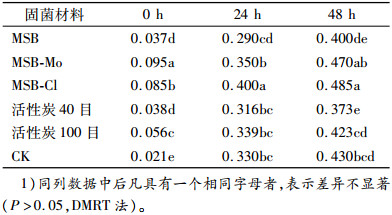
2 结果与分析 2.1 载体材料的固菌增殖能力的初步评价将降解菌HZ-2分别固定于改性蔗渣(MSB、MSB-Mo及MSB-Cl)以及活性炭(40和100目)5种载体材料中,分别测定培养0、24、48 h后的D600 nm(菌液稀释20倍)(表 1)。结果表明,开始培养时,D600 nm差异较大,这可能是由于各种载体材料吸光度不同;培养24 h后,5种供试载体材料D600 nm均显著提高;培养48 h后,5种材料固菌后D600 nm均较高,说明这些材料均具备较强的固菌能力,降解菌均得到了进一步的增殖,改性蔗渣MSB-Mo、MSB-Cl的固菌能力稍强于其他载体材料。
|
|
表 1 供试载体材料固菌后的D600 nm Table 1 D600 nm of tested carrier material after immobilizing bacteria |
硝磺草酮在LB培养基中的添加质量浓度为1、5和10 mg·L-1时,添加回收率分别为108.24%、91.96%和91.79%,变异系数分别为1.74%、2.84%和0.60%, 均小于5.00%;硝磺草酮在土壤中的添加浓度为1、5、10 mg·kg-1时,添加回收率分别为82.32%、82.74%和88.75%,变异系数分别为0.96%、3.75%和1.62%, 均小于5.00%,符合残留检测要求,表明试验所采用的LB培养基和土壤中提取硝磺草酮的方法稳定可靠。
2.3 降解菌制剂对LB培养基和土壤中硝磺草酮的降解能力改性蔗渣固菌制剂对硝磺草酮的降解效果明显,降解率均大于85%。活性炭材料制剂降解率显著低于改性蔗渣材料,这可能与蔗渣的结构特点有关。蔗渣富含纤维素、疏松多孔,对降解菌有良好的固定能力;而且蔗渣本身具有强烈的吸附作用,能吸附土壤中的重金属[15]。
在这3种改性蔗渣材料中,MSB-Mo、MSB-Cl效果突出,降解率分别达96.35%和93.22%,显著高于MSB的89.78%,更显著优于活性炭载体处理组(40目为64.05%和100目为43.22%)的降解率。其中,MSB-Mo相较于MSB-Cl效果更好,故后续其他试验未再研究活性炭的处理效果,而以3种改性蔗渣材料作为研究对象。
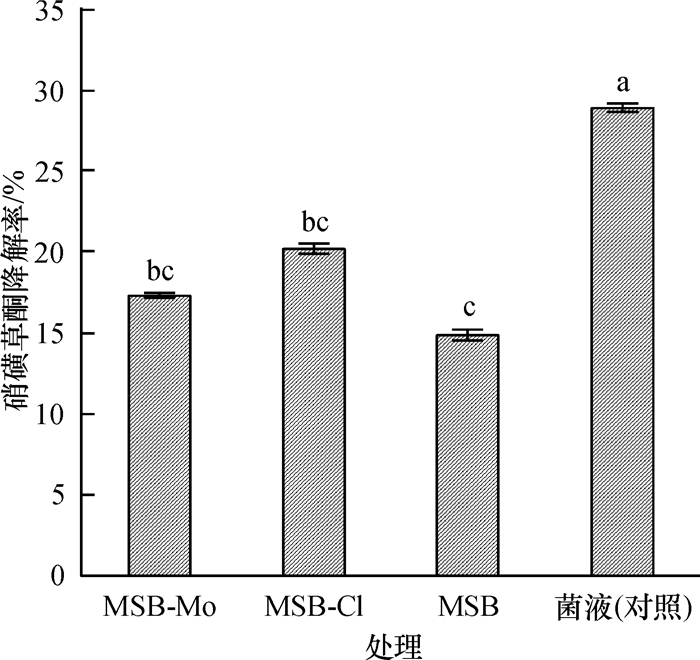
降解菌制剂对土壤中硝磺草酮的降解能力见图 1。结果表明,处理5 d后,各处理降解率均不足30%,不能满足实际生产的要求。在LB培养基和土壤条件下硝磺草酮降解率差异较大的原因,可能是载体材料未能提供足够的营养物质,降解菌不能及时繁殖,降解菌数量不足而导致降解率低下。
|
图 1 载体固菌制剂对土壤硝磺草酮的降解作用 Figure 1 Degradation of mesotrione in soil by immobilized microbial preparations 柱子上凡具有一个相同字母者, 表示差异不显著(P>0.05, DMRT法)。 |
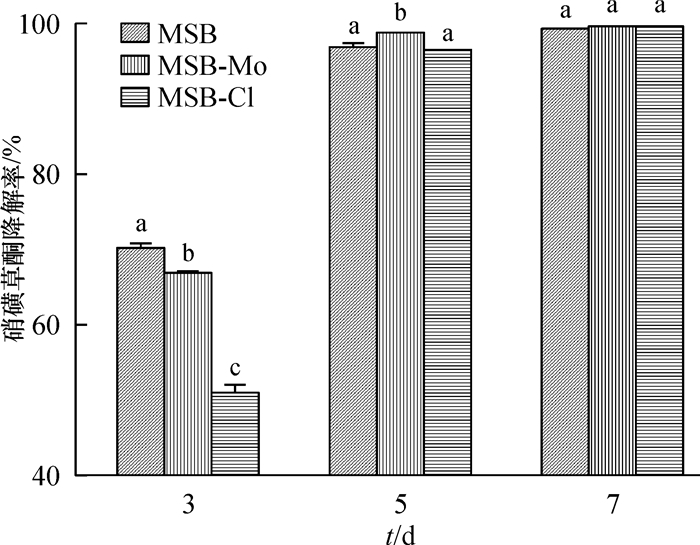
在上述载体固菌制剂中添加葡萄糖,使制剂初步具备菌株基本营养条件,为其在土壤中定植、生长、抵御其他微生物的营养竞争等提供可能。从图 2中可以看出,处理3 d后,硝磺草酮降解率达50%以上,处理7 d后,改性蔗渣MSB、MSB-Mo和MSB-Cl为载体的降解菌制剂对土壤硝磺草酮的降解率分别为99.22%、99.49%和99.41%,说明添加葡萄糖能提高改性蔗渣作为载体的降解菌制剂的降解能力。结合降解菌制剂对LB培养基中硝磺草酮的降解能力影响的结果,改性蔗渣MSB-Mo是固定降解菌株的最佳载体材料。
|
图 2 添加葡萄糖后改性蔗渣固菌制剂对土壤硝磺草酮的降解作用 Figure 2 Degradation of mesotrione in soil by modified bagasse as immobilized microbial preparations after adding glucose 相同时间、不同柱子上凡具有一个相同字母者,表示差异不显著(P>0.05, DMRT法)。 |
固定化是一种常用的技术手段,固定化微生物技术可以提高微生物密度、加快微生物生化反应速率和提高微生物对环境的耐受力[16]。载体的种类是决定固定化微生物性能的关键因素之一[17]。从本研究来看,改性蔗渣对硝磺草酮的降解率显著优于活性炭。天然疏松多孔的蔗渣不仅能作为微生物的附着载体提供微生物生长所需的营养物质,而且还能充当疏松剂提高土壤的透气性,可用于微生物的固定。国内外已有研究[18-20]将蔗渣载体应用于微生物发酵、生产丁醇以及降解苯酚等,但鲜见其应用于农药降解残留的研究。本研究结果表明,改性蔗渣MSB、MSB-Mo、MSB-Cl固菌后与50 mg·L-1硝磺草酮在LB培养基中共培养3 d,对硝磺草酮的降解率均高于80%,显著优于活性炭;葡萄糖的适量添加可显著加强载体固菌制剂降解土壤硝磺草酮的效果,改性蔗渣MSB、MSB-Mo、MSB-Cl载体制剂按照质量比5%的比例添加葡萄糖,7 d后对土壤中起始50 mg·kg-1硝磺草酮的降解率均高于99%。这些结果可为将蔗渣开发成环境污染物降解制剂的载体材料提供重要参考。今后将进一步深入研究其作用机制和应用技术等。
| [1] |
苏少泉. 硝磺酮的开发、选择性及生物学特性[J]. 农药研究与应用, 2009, 13(5): 1-6. (  0) 0) |
| [2] |
STEPHENSON D O, BOND J A, WALKER E R, et al. Evaluation of mesotrione in Mississippi Delta corn production[J]. Weed Technol, 2004, 18(4): 1111-1116. DOI:10.1614/WT-03-260R1 (  0) 0) |
| [3] |
BAFISSON I, CROUZET O, BESSE-HOGGAN P, et al. Isolation and characterization of mesotrione-degrading Bacillus sp. from soil[J]. Environ Pollut, 2009, 157(4): 1195-1201. DOI:10.1016/j.envpol.2008.12.009 (  0) 0) |
| [4] |
SARMAH A K, SABADIE J. Hydrolysis of sulfonylurea herbicides in soils and aqueous solutions: A review[J]. J Agr Food Chem, 2002, 50(22): 6253-6265. DOI:10.1021/jf025575p (  0) 0) |
| [5] |
朱鲁生, 辛承友, 王倩, 等. 莠去津高效降解细菌HB-5的固定化研究[J]. 农业环境科学学报, 2006, 25(5): 1271-1275. DOI:10.3321/j.issn:1672-2043.2006.05.035 (  0) 0) |
| [6] |
王建龙. 生物固定化技术与水污染控制[M]. 北京: 科学出版社, 2002, 15-18.
(  0) 0) |
| [7] |
窦晶晶, 冯贵颖, 呼世斌, 等. 一株多菌灵降解菌包埋条件及降解特性[J]. 中国环境科学, 2011, 31(3): 431-436. (  0) 0) |
| [8] |
张建辉, 孔瑛, 侯影飞, 等. 聚乙烯醇包埋石油脱硫菌UP-2的研究[J]. 中国环境科学, 2006, 26(S1): 92-96. (  0) 0) |
| [9] |
HOCHSTRAT R, CORVINI P F X, WINTGENS T. MINOTAURUS: Microorganism and enzyme immobilization: Novel techniques and approaches for upgraded remediation of underground, wastewater and soil[J]. Rev Environ Sci Bio, 2013, 12(1): 1-4. DOI:10.1007/s11157-012-9293-8 (  0) 0) |
| [10] |
王允圃, 李积华, 刘玉环, 等. 甘蔗渣综合利用技术的最新进展[J]. 中国农学通报, 2010, 26(16): 370-375. (  0) 0) |
| [11] |
HANDE A, MAHAJAN S, PRABHUNE A. Evaluation of ethanol production by a new isolate of yeast during fermentation in synthetic medium and sugarcane bagasse hemicellulosic hydrolysate[J]. Ann Microbiol, 2013, 63(1): 63-70. DOI:10.1007/s13213-012-0445-4 (  0) 0) |
| [12] |
李艳红, 李英利, 解庆林, 等. 固定化混合菌处理高盐含油废水[J]. 环境工程, 2012, 30(1): 18-21. (  0) 0) |
| [13] |
韩海涛, 刘婕, 高云飞, 等. 硝磺草酮降解菌的分离鉴定及其降解特性[J]. 华中农业大学学报, 2013, 32(3): 62-66. DOI:10.3969/j.issn.1000-2421.2013.03.012 (  0) 0) |
| [14] |
何连芳, 陈翠锦, 林钻涛, 等. 甘蔗渣接枝四乙烯五胺制备治理印染废水的新型吸附剂[J]. 生态科学, 2011, 30(4): 441-445. DOI:10.3969/j.issn.1008-8873.2011.04.013 (  0) 0) |
| [15] |
HANDE P L, GHIMIRE K N, INOUE K. Adsorption behavior of heavy metals onto chemically modified sugarcane bagasse[J]. Bioresource Technol, 2010, 101(6): 2067-2069. DOI:10.1016/j.biortech.2009.11.073 (  0) 0) |
| [16] |
马尧. 高效阿特拉津降解菌的固定化方法筛选与优化[D]. 哈尔滨: 东北农业大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10224-2010264364.htm
(  0) 0) |
| [17] |
胡金星, 苏晓梅, 韩慧波, 等. 固定化微生物技术修复多氯联苯污染土壤的应用前景[J]. 应用生态学报, 2014, 25(6): 1806-1814. (  0) 0) |
| [18] |
LU L P, ZHANG B B, XU G R. Efficient conversion of high concentration of glycerol to monacolin-k by solid-state fermentation of Monascus purpureus using bagasse as carrier[J]. Bioproc Biosyst Eng, 2013, 36(3): 293-299. DOI:10.1007/s00449-012-0784-3 (  0) 0) |
| [19] |
孔祥平, 贺爱永, 陈佳楠, 等. 化学改性甘蔗渣对固定化细胞发酵产丁醇的影响[J]. 生物工程学报, 2014, 30(2): 305-309. (  0) 0) |
| [20] |
BASAK B, BHUNIA B, DEY A. Studies on the potential use of sugarcane bagasse as carrier matrix for immobilization of Candida tropicalis PHB5 for phenol biodegradation[J]. Int Biodeter Biodegr, 2014, 93: 107-117. DOI:10.1016/j.ibiod.2014.05.012 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37