2. 华南农业大学 热带亚热带生态研究所,广东 广州 510642
2. Institute of Tropical and Subtropical Ecology, South China Agricultural University, Guangzhou 510642, China
福寿螺Pomacea canaliculate是原产于南美洲亚马逊河流域的一种大型淡水螺类,隶属于软体动物门Mollusca腹足纲Gastropoda前鳃亚纲Prosobranchia新进腹足目Caenogastropada瓶螺科Ampullariidae瓶螺属Pomacea。它作为一种外来入侵生物,已入侵包括我国在内的许多亚洲国家,造成了严重危害[1-2]。2000年,福寿螺被列为世界100种恶性外来入侵物种之一。福寿螺的强大繁殖力和抗逆性是其形成入侵危害的有利条件。目前有关福寿螺繁殖能力的研究报道较多,也对其生殖系统结构及胚胎发育等方面进行过研究。目前对于软体动物卵巢发育规律的研究已有一些报道,比如前鳃亚纲盔螺科的细角螺Hemifusus tematamus[3]和管角螺H.tuba[4]、马蹄螺科的塔形马蹄螺Trochus pyramis[5]和蛾螺科的香螺Neptunea cumingi[6],后鳃亚纲阿地螺科的泥螺Bullacta exarata[7]等等。新进腹足目被认为包含了大部分定义的中腹足目Mesogastropoda和全部的新腹足目Neogastropoda。研究福寿螺卵巢的发育规律和卵母细胞的发生过程,对掌握其繁殖生理活动的结构基础具有重要意义,因此本研究从显微水平对福寿螺卵巢的发育及卵子的发生进行了较为细致的观察,以丰富及完善福寿螺性腺发育的组织结构基础,也为从生殖干扰方面出发,对福寿螺进行生态防控提供理论依据。
1 材料与方法 1.1 材料试验用福寿螺采自番禺野外池塘,依次采取幼螺,成螺,体质量范围0.5 ~ 40.0 g。
1.2 方法挑选不同大小的福寿螺,解剖分离出性腺,用布安氏液(Bouin’solution)固定、乙醇梯度脱水、二甲苯透蜡包埋、切片厚度4 μm、脱蜡、复水、苏木精-伊红(HE)染色、脱水、透明、中性树胶封片后,光学显微镜下观察并拍照。
2 结果与分析 2.1 福寿螺卵巢的结构福寿螺卵巢位于雌螺肝脏螺旋近壳轴一侧,淡黄色或乳白色,树枝状,分支细小密集,贴附于肝脏表面,被乳白色或黄褐色结缔组织包裹,周围有肝脏的黄褐色花斑,不易区分,用固定液固定后斑纹消失。各分支逐级汇合,最终在底部汇合于输卵管主干(图 1)。

|
图 1 福寿螺卵巢的解剖位置(未固定的样品) Figure 1 Anatomic location of the ovary of Pomacea canaliculate(unfixed sample) li:肝脏,ov:卵巢。 |
根据光学显微镜下观察的结果,福寿螺的卵巢是一种管状分枝型腺体。从切片的结果来看,生殖管的横断面类似于滤泡结构,主干部分由生殖上皮构成,在生殖上皮的周围分布着大量的结缔组织(图 2A)。生殖管分为生殖管壁和生殖管腔,生殖管壁是由原始生殖细胞和支持细胞构成的生殖上皮,基膜明显,外面通过结缔组织与肝脏相连,各生殖管之间为结缔组织(图 2B)。
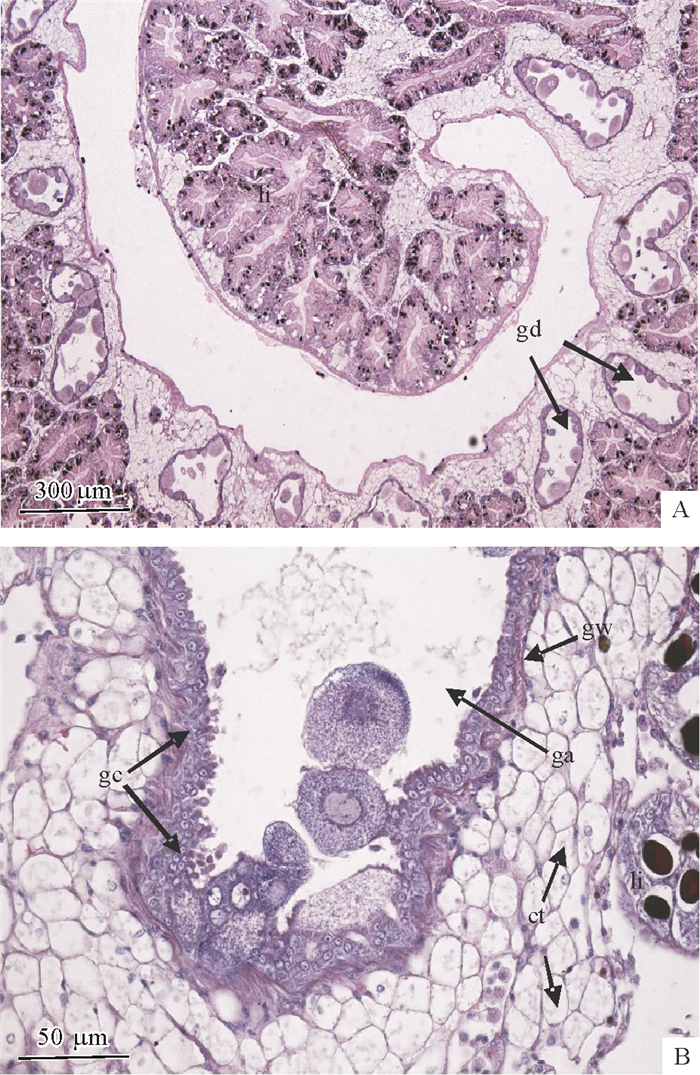
|
图 2 福寿螺卵巢组织切面 Figure 2 Ovary tissue section of Pomacea canaliculate ct:结缔组织,ga:生殖管腔,gc:生殖细胞,gd:生殖管,gw:生殖管壁,li:肝脏; A:组织全貌,B:组织中的细胞结构。 |
根据生殖管腔的大小及内部生殖细胞的发育情况,可将福寿螺卵巢发育分为增殖期、生长期、成熟期、排放期和休止期。
1) 增殖期:生殖管尚未完全形成,肝脏内侧边缘只有疏松的结缔组织排列。生殖管壁基膜不明显,生殖管腔中分布着大量的组织液,各级卵原细胞和卵母细胞较少(图 3A)。
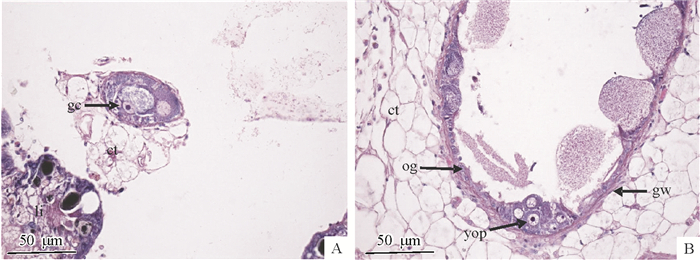
|
图 3 卵巢发育增殖和生长期 Figure 3 The proliferation and growth stages of ovarian development ct:结缔组织,gc:生殖细胞,gw:生殖管壁,li:肝脏,og:卵原细胞,yop:卵黄合成前期卵母细胞; A:卵巢发育增殖期, B:卵巢发育生长期。 |
2) 生长期:生殖管完全形成,基膜明显,生殖管腔大,生殖管壁上有不同发育时期的生殖细胞,周围疏松结缔组织和致密结缔组织丰富(图 3B)。
3) 成熟期:生殖管腔很大,分支很多,密集分布在肝脏内侧,周围疏松结缔组织很丰富。生殖管横切面形状不规则,管壁上分布着大量的卵黄合成期卵母细胞和成熟卵细胞,也有少量卵原细胞和其他时期的卵母细胞(图 4A、4B)。
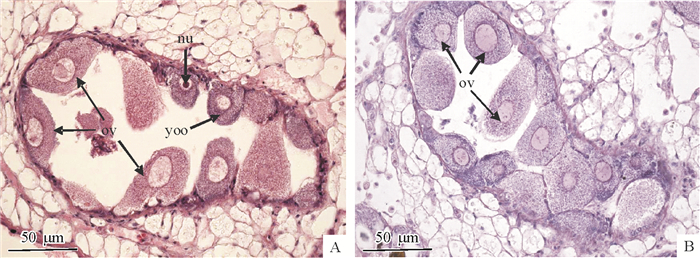
|
图 4 卵巢发育成熟期 Figure 4 The mature stage of ovarian development nu:核仁,ov:成熟卵子,yoo:卵黄合成期卵母细胞; A、B:来源于不同切片样品。 |
4) 排放期:此期生殖管腔最大,其典型的特征是大量成熟卵子已从管壁上游离下来,进入管腔内(图 5A、5B)。
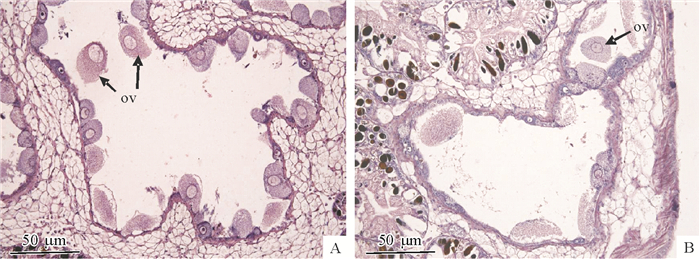
|
图 5 卵巢发育排放期 Figure 5 The spawning stage of ovarian development ov:成熟卵子; A、B:来源于不同切片样品。 |
5) 休止期:排放期结束后,生殖管内成熟卵子都已排尽,其他时期的卵母细胞也消失,仅有少量的卵原细胞和卵母细胞分布在生殖管壁的基底膜上,腔内有少量残余物,周围疏松结缔组织也萎缩减少(图 6)。
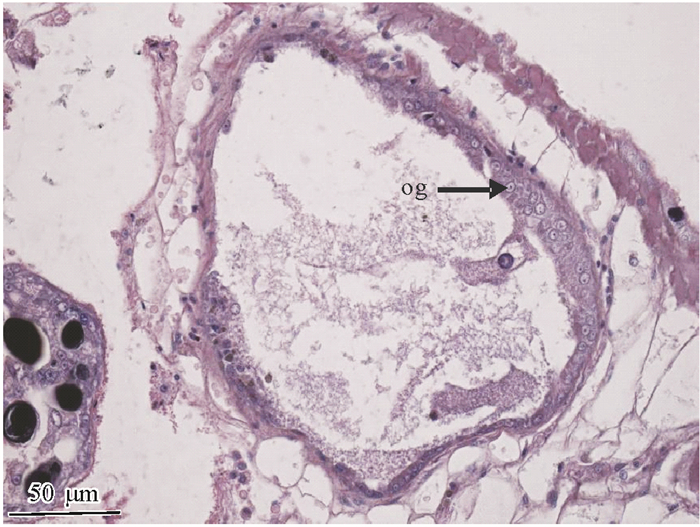
|
图 6 卵巢发育休止期 Figure 6 The resting stage of ovarian development og:卵原细胞。 |
软体动物的卵子发生起源于生殖管壁上的原始生殖细胞,依次经过卵原细胞期、初级卵母细胞期和成熟期。卵原细胞发育分化为初级卵母细胞,初级卵母细胞又分为卵黄合成前期和卵黄合成后期,最终发育成熟。
1) 卵原细胞:卵巢增殖期卵原细胞的数量最多,主要分布在生殖管壁的基底膜上,形状大多为圆形,体积小,细胞中央有一个小的细胞核。胞体染色较深,呈蓝紫色。卵巢发育的其他时期,卵原细胞紧贴生殖管壁分布(图 7A)。
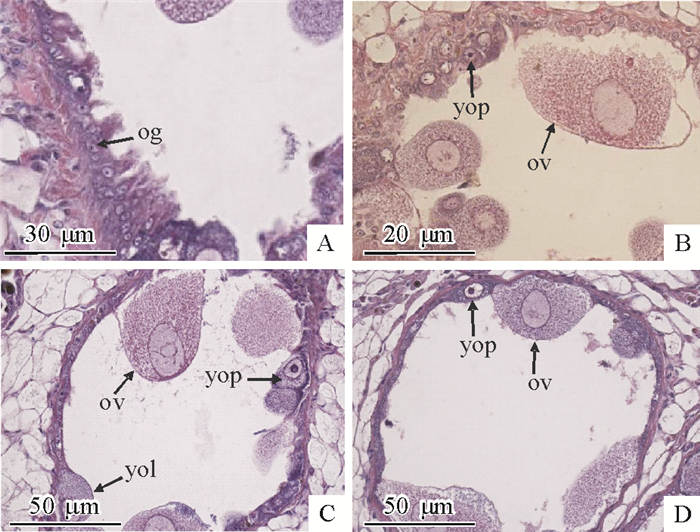
|
图 7 福寿螺卵子发生 Figure 7 Oogenesis of Pomacea canaliculate og:卵原细胞,ov:成熟卵子,yop:卵黄合成前期卵母细胞,yol:卵黄合成后期卵母细胞; A、B、C、D:来源于不同个体组织。 |
2) 卵黄合成前期:细胞梭形或圆形,两端稍细,中部膨大。细胞体积稍有增大,核较大,位于细胞中部膨大处,胞质染成浅紫红色,核深紫红色。此时期的细胞质中仅出现极少量的原始卵黄颗粒(图 7B)。
3) 卵黄合成后期:细胞体积进一步增大,核仁逐渐消失,细胞质中充满了卵黄颗粒(图 7C)。
4) 成熟卵细胞:此时期细胞体积最大,呈圆形或椭圆形,核仁完全消失,细胞核内仅能见到着色较浅的核质。随着卵母细胞逐渐成熟,胞体逐步伸向生殖管腔,一端形成柄状附着于管壁,一端游离于管腔。有脱离生殖管壁的趋势,或者已经完全游离于生殖管腔中(图 7D)。
3 讨论与结论 3.1 福寿螺卵巢的结构类型福寿螺雌雄异体,卵巢位于肝脏螺旋部内侧。腹足类许多种类的生殖腺属于滤泡型腺体[8-10],由滤泡(Follicle)、生殖管(Genital canal)和生殖导管(Gonoduct)3个部分组成。滤泡为生殖管分支末端膨大形成的囊泡状结构,外围为滤泡壁,也称生殖上皮,由生殖细胞和支持细胞2种类型的细胞组成,中间的空腔为滤泡腔。滤泡是生殖细胞发生的部位。
经过切片观察发现福寿螺的卵巢结构并不是典型的滤泡型腺体,而是管状分枝型腺体。福寿螺卵子的发生是在生殖管的生殖上皮进行的。多数软体动物卵巢的发育情况是卵原细胞在滤泡壁上发育,成熟后的卵细胞逐渐脱离滤泡壁以游离状态存在,最后由滤泡腔经输卵管小分枝进入输卵管主干排出体外[11],福寿螺卵巢的发育情况也是从生殖管壁上开始的,成熟后的卵细胞逐渐脱离生殖管壁以游离状态存在,最后由生殖管腔经输卵管小分枝排出体外。
3.2 福寿螺性腺发育周期腹足类性腺的发育与动物自身因素和环境因素相关,研究其性腺的发育规律对掌握它的生殖季节、估算其繁殖力、了解繁殖生理活动等有重要意义。许多贝类在性腺发育周期中,表现出很明显的阶段性,人们常将它们性腺的发育过程分为若干不同时期,即为性腺发育的分期。有关软体动物性腺发育分期,国内外学者主要依据滤泡腔的大小、腔内生殖细胞的成熟程度以及生殖腺的发育规律为标准,将其划分为5个期[12]:增殖期(Proliferation stage)、生长期(Growth stage)、成熟期(Mature stage)、排放期(Spawning stage)和休止期(Resting stage)。通过对福寿螺卵巢组织切片观察可知,生殖管腔中生殖细胞的数量及分布状况变化明显,所以我们将福寿螺卵巢的发育分为增殖期、生长期、成熟期、排放期和休止期5个时期。这一规律与大多数软体动物类似[3-4, 10]。
3.3 福寿螺卵子的发生福寿螺的卵子是在卵巢的生殖管内发生的,其细胞核中的核仁有较大的变化。从卵原细胞到卵黄合成后期,核仁不断增大,从卵黄合成开始,核仁有降解的趋势。核仁会解体是因为染色体上的DNA双螺旋结构解旋形成松散的单链[13],并随着核体积的扩大单链进一步分散,DNA单链经翻译、合成大量各类RNA,所以在成熟的卵子中只有少量的核仁或没有核仁[14]。最后形成的成熟卵子经输卵管排出。在软体动物胚胎发育中所需要的营养由蛋白腺分泌的卵蛋白提供[15-16],福寿螺也遵循这一规律,因此在卵细胞发育过程中,胞质中的卵黄颗粒会有一定数量的积累[17]。
3.4 福寿螺强大繁殖力原因分析经过研究发现,福寿螺的卵巢为管状分枝型的结构,分支数量多,所以每次可以排出大量的成熟卵子,形成由大量卵粒组成的团块。福寿螺性腺中的生殖细胞并非同步成熟,一次排完。根据研究结果,福寿螺生殖细胞是区域性同步化发生的,即同一生殖管中的卵区域性地连续分批成熟、排放。因此福寿螺在繁殖季节可以多次交配、多次产卵,有利于提高生殖力,再加上福寿螺体内含有大量的生殖细胞[18-19],卵巢组织中成熟卵细胞数量极多,这为福寿螺的快速繁殖提供了基础。雌螺的子宫容积大并且能够容纳大量的成熟卵子,所以一次受精后可以多次产卵[20]。这种发育特征与泥螺、贻贝、扇贝等相似。此外,福寿螺胚胎在体外发育,很大程度上减少了福寿螺的繁殖能量投入,促进了繁殖量的提升。
正是由于这些结构和生理机制上的特点,导致了雌性福寿螺有着强大的产卵能力,这就解释了福寿螺具有强大繁殖能力的结构基础和生理机制。
致谢:感谢华南农业大学测试中心黄吉雷老师给予的支持和帮助!
| [1] |
HAYES K A, JOSHI R C, THIENGO S C, et al. Out of South America: Multiple origins of non-native apple snails in Asia[J]. Divers Distrib, 2008, 14(4): 701-712. DOI:10.1111/j.1472-4642.2008.00483.x (  0) 0) |
| [2] |
杨叶欣, 胡隐昌, 李小慧, 等. 福寿螺在中国的入侵历史、扩散规律和危害的调查分析[J]. 中国农学通报, 2010, 26(5): 245-250. (  0) 0) |
| [3] |
曹伏君, 罗杰, 李长玲, 等. 细角螺的生殖系统组织学研究[J]. 热带海洋学报, 2010, 29(6): 57-64. DOI:10.3969/j.issn.1009-5470.2010.06.009 (  0) 0) |
| [4] |
罗杰, 曹伏君, 李长玲, 等. 管角螺生殖系统解剖学及组织学观察[J]. 水产学报, 2011, 35(4): 569-578. (  0) 0) |
| [5] |
李芳远, 冯永勤, 吴洪流, 等. 塔形马蹄螺雄性生殖系统的组织学研究[J]. 海南大学学报(自然科学版), 2008, 26(2): 153-156. DOI:10.3969/j.issn.1004-1729.2008.02.011 (  0) 0) |
| [6] |
高岩, 侯林. 香螺雄性生殖系统的显微结构研究[J]. 水产科学, 2004, 23(1): 10-13. (  0) 0) |
| [7] |
应雪萍, 陈鸟, 华恩宠, 等. 泥螺生殖系统的组织学研究[J]. 东海海洋, 2002, 20(3): 24-31. DOI:10.3969/j.issn.1001-909X.2002.03.003 (  0) 0) |
| [8] |
柯才焕, 李复雪. 台湾东风螺精子发生和精子形态的超微结构研究[J]. 动物学报, 1992, 38(3): 233-240. DOI:10.3321/j.issn:0001-7302.1992.03.005 (  0) 0) |
| [9] |
沈亦平, 张锡元. 合浦珠母贝精子发生过程的超微结构观察[J]. 武汉大学学报(自然科学版), 1992, 38(6): 113-119. (  0) 0) |
| [10] |
姜永华, 颜素芬, 严正凛. 九孔鲍卵子发生及卵巢发育的组织学观察[J]. 动物学杂志, 2009, 44(1): 80-86. DOI:10.3969/j.issn.0250-3263.2009.01.012 (  0) 0) |
| [11] |
AL-MOHANNA S Y, AL-RUKHAIS L B, MEAKIN R H. Oogenesis in Amiantis umbonella (Mollusca: Bivalvia) in Kuwait Bay, Kuwait[J]. J Mar Biol Assoc UK, 2003, 83(5): 1065-1072. DOI:10.1017/S0025315403008282h (  0) 0) |
| [12] |
ARELLANO N, GUZMAN S, ORDONEZ E. Gonadal cycle of Tegula eiseni (Jordan 1936)(Mollusca:Gastropoda) in Bahia Asunción, Baja California Sur, Mexico[J]. J Shellfish Res, 2009, 28(3): 577-580. DOI:10.2983/035.028.0321 (  0) 0) |
| [13] |
余祥勇, 王梅芳, 曹新云, 等. 斗嫁虫戚卵子发生和雌性性腺组织学研究[J]. 水生生物学报, 2010, 34(5): 913-921. (  0) 0) |
| [14] |
NAJMUDEEN T M. Ultrastructural studies of oogenesis in the variable abalone Haliotis varia (Vetigastropoda: Haliotidae)[J]. Aquat Bio, 2008, 2(2): 143-151. (  0) 0) |
| [15] |
MATSUMOTO T, YAMANO K, KITAMURA M, et al. Ovarian follicle cells are the site of vitellogenin synthesis in the Pacific abalone Haliotis discus hannai[J]. Comp Biochem Physiol:Part A:Mol Integr Physiol, 2008, 149(3): 293-298. DOI:10.1016/j.cbpa.2008.01.003 (  0) 0) |
| [16] |
ECKELBARGER K J, DAVIS V. Ultrastructure of the gonad and gametogenesis in the eastern oyster, Crassostrea virginica: I: Ovary and oogenesis[J]. Mar Biol, 1996, 127(1): 79-87. DOI:10.1007/BF00993647 (  0) 0) |
| [17] |
HODGSON A, ECKELBARGER K. Ultrastructure of the ovary and oogenesis in six species of Patellid limpets (Gastropoda: Patellogastropoda) from South Africa[J]. Invertebr Biol, 2000, 119(3): 265-277. (  0) 0) |
| [18] |
王志高, 谭济才, 刘军, 等. 福寿螺齿舌、性腺和卵粒结构扫描电镜观察[J]. 广东农业科学, 2010, 37(10): 110-112. DOI:10.3969/j.issn.1004-874X.2010.10.043 (  0) 0) |
| [19] |
MOCHIDA O. Spread of freshwater Pomacea snails (Pilidae, Mollusca) from Argentina to Asia[J]. Micronesica, 1991, 31(Suppl 3): 51-62. (  0) 0) |
| [20] |
熊洪林, 付学梅, 陈嶙, 等. 福寿螺适应环境的繁殖生物学基础[J]. 四川动物, 2013, 32(2): 255-259. DOI:10.3969/j.issn.1000-7083.2013.02.021 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37


