2. 深圳市晨光乳业有限公司, 广东 深圳 518107
2. Shenzhen Chenguang Dairy Co., Ltd., Shenzhen 518107, China
牛奶营养丰富, 在人们的日常生活中占有十分重要的地位。近年来, 随着人们生活水平的不断提高和对奶制品需求量的逐年增加, 国家制定了一系列有利于奶业发展的政策, 奶牛的生产性能和标准化生产水平均得到进一步提高。同时, 我国南方地区奶业发展也十分迅速, 奶牛生产性能测定(Dairy herd improvement, DHI)在生产中得到较广泛的应用, 取得了显著成效。但是, 由于南方地区高温高湿的气候特点, 以及长期以来对奶牛选育种工作的重视力度不够, 奶牛总体上还存在着良种数量少、单产水平不高、种群资源复杂、遗传素质较差等问题, 因此加快我国南方地区奶牛的遗传改良, 提高牛群的整体产量以及乳品质量已成为亟待解决的问题。
近年来, 随着分子生物学以及DNA检测技术的飞快发展, 分子遗传标记如单核苷酸多态性(Single nucleotide polymorphism, SNP)已被广泛应用到遗传育种研究的各个领域[1-2], 其中飞行质谱基因分型技术被认为是目前最准确的检测SNP的方法之一, 在动物的分子标记分型方面有高通量、高准确率等特点, 应用前景广阔[3]。另外, 奶牛的产奶性状(包括产奶量、乳蛋白量、乳蛋白率、乳脂量和乳脂率等)是受到人们广泛关注的重要经济性状, 这类性状受微效多基因控制, 并受到环境因素的影响[4]。在奶牛产奶性状的选择方面, 传统的选育种方法侧重于表型选择, 世代间隔较长, 选育进展较慢, 因此把灵敏度极高的一些DNA分析技术运用到奶牛育种中, 可以在DNA水平上筛选到与产奶性状密切相关的遗传标记, 以实现奶牛的早期选择, 缩短育种周期, 加快遗传进展。
目前, 发现与产奶性状密切相关的候选基因有很多。有研究表明, 转运蛋白颗粒复合体9(TRAPPC9)、二酰甘油酰基转移酶(DGAT1)、Na+, K+-ATP酶(ATP1A1)和生长激素受体(GHR)基因与奶牛的产奶性状存在显著相关[3, 5-12]。本研究主要针对与产奶性状相关的TRAPPC9、DGAT1、ATP1A1和GHR基因变异多态性进行检测, 并与产奶性状进行相关性分析, 以探讨相关基因及其多态座位作为南方荷斯坦奶牛产奶性状标记辅助选择的可行性, 为南方荷斯坦奶牛的分子育种工作的开展奠定基础。
1 材料与方法 1.1 材料 1.1.1 试验群体与表型数据以广东地区某奶牛场的中国荷斯坦奶牛为试验对象, 选择前3胎有完整的DHI数据记录的279头个体, 采集耳组织样本保存备用。
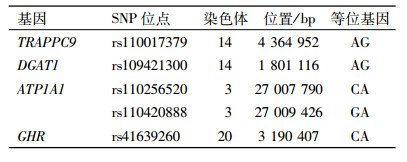
1.1.2 相关基因标记信息通过文献查阅以及数据库检索, 选取与奶牛产奶性状关联程度较高的4个候选基因(TRAPPC9, DGAT1, ATP1A1和GHR)为研究对象, 相关变异座位信息见表 1。
|
|
表 1 关联分析所选的5个SNP座位 Table 1 List of five SNPs selected for association analysis |
利用OMEGA组织DNA提取试剂盒推荐方法进行DNA抽提, EB缓冲液溶解, NanoDrop2000核酸浓度仪和凝胶电泳检测DNA质量, 将合格的DNA置于2 mL离心管-80 ℃条件保存备用。
1.2.2 飞行质谱分型技术利用飞行质谱Sequenom平台进行SNP分型[13], 结果由MassARRAYRT软件系统实时读取并完成分析, 全部样本接受重复检测以验证准确度。
1.3 数据统计与分析 1.3.1 表型和基因型数据的质量控制要求有完整的DHI表型数据, 产奶量1.5~90.0 kg·d-1范围内; 乳脂率和乳蛋白率在1.5%~8.5%范围内; 每胎的测定记录不少于5条; 在用于后续分析之前, SNP基因型缺失大于10%的个体需要剔除。
1.3.2 关联分析模型采用动物模型对数据进行拟合, 通过SAS(9.2)软件的MIXED过程对奶牛产奶性状和基因型进行关联分析。模型:y=μ+bM+G+e, 式中, y为产奶性状(产奶量、乳蛋白量、乳蛋白率、乳脂量、乳脂率)观察值, μ为群体均值, b为协变量M的回归系数, M为产犊月份效应, G为基因型效应, e为随机残差效应。
1.3.3 多重比较方法利用Bonferroni法进行多重比较分析检验。
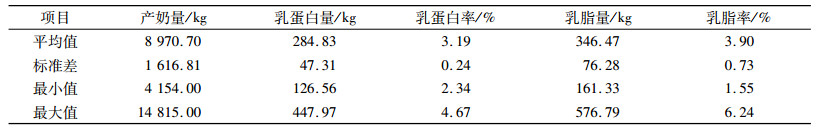
2 结果与分析 2.1 产奶相关性状的统计分析对305 d奶牛的产奶量、乳蛋白量、乳蛋白率、乳脂量、乳脂率等5个性状进行分析, 结果见表 2。由表 2可知, 试验群体总体生产水平较高, 但个体间差异较大, 有较大的选育空间和进一步选育的必要。
|
|
表 2 产奶性状的数据资料 Table 2 Data of milk production traits |
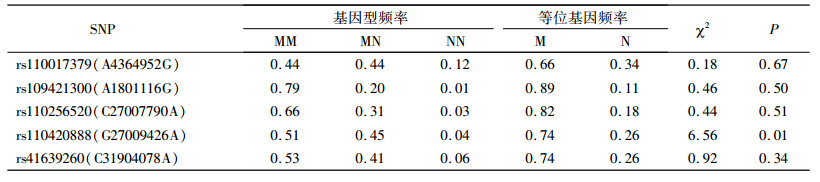
奶牛耳组织DNA经10 g· L-1琼脂糖凝胶电泳检测, 条带明亮, 点样孔干净, 无蛋白污染。采用NanoDrop2000核酸浓度仪测定, 95%以上样本质量浓度大于100 ng·μL-1, D260 nm/D280 nm及D260 nm/D230 nm均在1.8~2.1之间, 浓度和纯度都可以满足飞行质谱试验要求。通过飞行质谱分型技术分析验证, 结果可靠。利用Excel对5个SNP座位的等位基因频率和基因型频率进行分析, 并进行Hardy-Weinberg平衡检验, 结果表明, 除ATP1A1基因rs110420888座位处于Hardy-Weinberg不平衡状态外(P < 0.05), 其余4个SNP座位均处于Hardy-Weinberg平衡状态(P>0.05), 具体结果见表 3。
|
|
表 3 5个SNP座位等位基因频率和基因型频率 Table 3 Genotypic frequencies and allele frequencies of five SNPs in Chinese Holsteins |
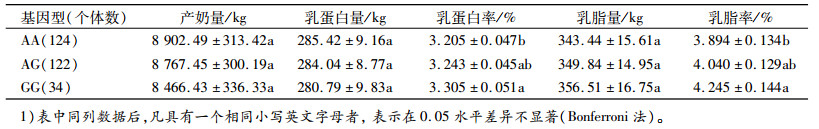
采用SAS(9.2)软件分析了TRAPPC9基因rs110017379座位不同基因型对产奶性状的影响(表 4)。由表 4可见, 该座位对乳蛋白率和乳脂率性状的效应均达到显著水平(P < 0.05), 对产奶量、乳脂量和乳蛋白量等性状的效应不显著(P>0.05)。
|
|
表 4 TRAPPC9基因SNP与产奶性状关联分析(最小二乘均值±标准误)1) Table 4 Associations of SNPs of TRAPPC9 gene with milk production traits in Chinese Holsteins (LSM±SE) |
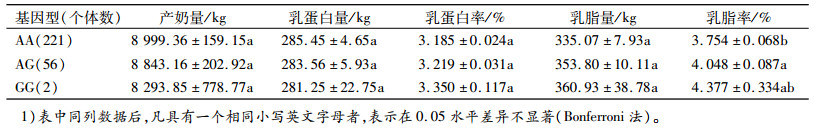
多重比较结果表明, GG基因型个体的乳蛋白率和乳脂率性状显著高于AA基因型(P < 0.05);不同基因型间产奶量、乳蛋白量和乳脂量性状差异不显著(表 4)。
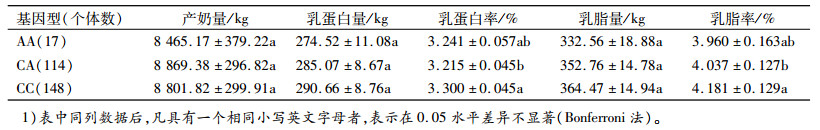
2.4 DGAT1基因SNP与产奶性状的关联分析采用SAS(9.2)软件分析了DGAT1基因rs109421300座位不同基因型对产奶性状的影响(表 5)。由表 5可见, 该座位对乳脂率的效应达到显著水平(P < 0.05), 对其他几个产奶性状的效应不显著(P>0.05)。
|
|
表 5 DGAT1基因SNP与产奶性状关联分析(最小二乘均值±标准误)1) Table 5 Associations of SNPs of DGAT1 gene with milk production traits in Chinese Holsteins (LSM±SE) |
多重比较结果表明:AG基因型个体乳脂率显著高于AA基因型(P < 0.05);不同基因型个体间产奶量、乳蛋白量、乳蛋白率和乳脂量差异不显著(表 5)。
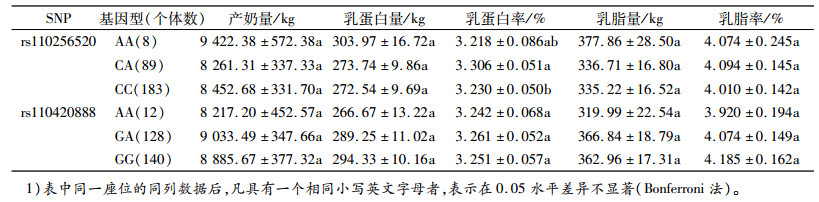
2.5 ATP1A1基因SNP与产奶性状的关联分析采用SAS(9.2)软件分析了ATP1A1基因rs110256520座位和rs110420888座位不同基因型对产奶性状的影响(表 6)。由表 6可见, 只有rs110256520座位对乳蛋白率的效应达到显著水平(P < 0.05)。
|
|
表 6 ATP1A1基因SNP与产奶性状关联分析(最小二乘均值±标准误)1) Table 6 Associations of SNPs of ATP1A1 gene with milk production traits in Chinese Holsteins (LSM±SE) |
多重比较结果(表 6)表明:rs110256520座位CA基因型个体乳蛋白率显著高于CC基因型(P < 0.05);不同基因型个体间产奶量、乳蛋白量、乳脂量和乳脂率性状差异不显著(P>0.05)。
2.6 GHR基因SNP与产奶性状的关联分析采用SAS(9.2)软件分析了GHR基因rs41639260座位不同基因型对产奶性状的影响(表 7)。由表 7可见, 该座位对乳蛋白率和乳脂率的效应均达到显著水平(P < 0.05), 对产奶量、乳蛋白量和乳脂量的效应不显著(P>0.05)。
|
|
表 7 GHR基因SNP与产奶性状关联分析(最小二乘均值±标准误)1) Table 7 Associations of SNPs of GHR gene with milk production traits in Chinese Holsteins (LSM±SE) |
多重比较结果(表 7)表明:CC基因型个体的乳蛋白率和乳脂率均显著高于CA基因型的(P < 0.05)。不同基因型个体间产奶量、乳蛋白量和乳脂量差异不显著(P>0.05)。
3 讨论与结论本研究发现, 群体中除ATP1A1基因rs110420888座位处于Hardy-Weinberg不平衡状态外(P < 0.05), 其余4个座位均处于Hardy-Weinberg平衡状态(P>0.05)。造成Hardy-Weinberg不平衡状态的原因可能与人工授精技术的应用和群体内非随机交配所致。
本研究表明, TRAPPC9基因rs110017379座位与多个产奶性状关联显著, 其中与乳脂率相关显著(P < 0.05), 与Jiang等[14]的GWAS结果一致。后者研究认为, TRAPPC9基因上还存在6个显著SNP座位, 其中ARS-BFGL-NGS-100840座位与产奶量、乳蛋白量和乳脂率相关显著, ARS-BFGL-NGS-56327、UA-IFASA-5306、UA-TFASA-5765、ARS-BFGL-BAC-25166和Hapmap27703-BTC-053907座位与乳脂率关联显著[14]。另有研究表明, 牛TRAPPC9基因上有3 000多个SNP座位, 其中28个SNP在外显子上[15-16]。本研究选用的南方荷斯坦奶牛群体中, GG基因型乳蛋白率和乳脂率显著高于AA型, 其中A基因是优势等位基因, 因此, 在奶牛选育中可以增加对GG基因型个体的选育, 从而提高牛奶品质。上述结果说明, TRAPPC9基因多态性十分丰富, 可能是影响乳成分, 特别是乳脂率性状的重要候选基因, 需要对其结构和功能进行深入研究。
本研究表明, DGAT1基因rs109421300座位与乳脂率性状存在显著相关(P < 0.05), 与其他几个产奶性状相关不显著(P>0.05)。这与Raven等[17]研究结果有差异。后者认为, 该座位与产奶量、乳蛋白量、乳蛋白率、乳脂量、乳脂率等5个产奶性状都存在显著相关[17]。另有研究表明, DGAT1基因位于奶牛14号染色体的着丝粒末端, 处于影响泌乳性状的主效QTL上, 是三酰甘油合成中的唯一关键酶[7-18]; 在雌性小鼠中敲除DGAT1基因, 表现出完全抑制泌乳, 很可能是由于DGAT1编码蛋白的缺乏导致乳腺中三酰甘油合成的不足[8]。目前, 对于DGAT1基因的结构功能和作用机理研究较多, DGAT1基因被证明是影响产奶性状的主效基因, 也是影响乳脂率的1个重要候选基因[9]。因此, 在我国南方奶牛分子育种实践中, 该基因应作为影响产奶性状的重要基因进行深入研究和开发利用。
有研究表明, ATP1A1基因编码Na+, K+-ATP酶的a1亚基, a1亚基在各个组织中都广泛表达, 并唯一在红细胞中表达; Na+, K+-ATP酶是细胞膜表面的1种跨膜蛋白, 是细胞膜上重要的主动转运系统, 在维持细胞稳态和生理活动及细胞正常代谢中有着重要的作用[10]。另据报道, ATP1A1基因rs110256520座位CA基因型是奶牛耐热性状最优基因型, 可以将该座位作为影响奶牛耐热性状的分子遗传标记应用到奶牛育种[5-6]。本研究表明, ATP1A1基因rs110256520座位与乳蛋白率存在显著相关(P < 0.05), 其中CA基因型个体乳蛋白率显著高于CC基因型。本研究所用的荷斯坦奶牛群体长期处于高温高湿的热应激环境中, 而热应激不仅会使奶牛产奶量下降, 同时还会影响乳成分, 牛奶中的乳脂率、乳蛋白率和乳糖率等都会因高温而降低[19]。因此, rs110256520座位可以作为南方荷斯坦奶牛耐热性状和产奶性状的遗传标记应用到奶牛选育中去。
研究表明, GHR基因是产奶性状的主效基因, 位于奶牛20号染色体上, 与影响乳蛋白率的QTL紧密连锁, 编码生长激素受体蛋白, 可与生长激素结合, 在动物生长、发育等代谢过程中起关键作用[20]。关于奶牛GHR基因的遗传多态性及其与生产性能相关的研究报道已经很多[9, 11, 21-22]。本研究表明, GHR基因rs41639260座位对乳蛋白率和乳脂率的影响均达到显著水平(P < 0.05), 与Chamberlain等[23]研究相一致。本研究选用的南方荷斯坦奶牛群体中, CC基因型乳蛋白率和乳脂率显著高于CA基因型, 其中C是优势等位基因, 生产高品质奶, 可以对CC基因型个体进行分子标记选择。因此, 在南方奶牛育种中, 可以根据不同的育种目标和市场需要, 利用GHR基因对奶牛群体进行标记辅助选择。
本研究中5个SNP座位与产奶量关联分析结果均不显著, 可能是因为南方地区奶牛饲养、环境以及选育等因素致使奶牛产奶量远远没有达到自身潜力, 从而掩盖了基因效应; 也可能是由于试验群体数量不足所致。在进一步的研究中, 应加大研究群体, 筛查更多的基因和标记, 为南方荷斯坦奶牛的分子标记辅助选育奠定基础。
| [1] |
THAKUR S, SINGH P K, RATHOUR R, et al. Genotyping and development of single-nucleotide polymorphism (SNP) markers associated with blast resistance genes in rice using GoldenGate assay[J]. Mol Breeding, 2014, 34(3): 1449-1463. DOI:10.1007/s11032-014-0129-9 (  0) 0) |
| [2] |
MARQUES E, GRANT J R, WANG Z, et al. Identification of candidate markers on bovine chromosome 14 (BTA14) under milk production trait quantitative trait loci in Holstein[J]. J Anim Breed Genet, 2011, 128(4): 305-313. DOI:10.1111/jbg.2011.128.issue-4 (  0) 0) |
| [3] |
CARTA A, CASU S, SALARIS S. Invited review:Current state of genetic improvement in dairy sheep[J]. J Dairy Sci, 2009, 92(12): 5814-5833. DOI:10.3168/jds.2009-2479 (  0) 0) |
| [4] |
ELBAYOMI K, ARABY I, AWAD A, et al. Molecular study of some candidate genes affecting milk production traits in holstein cattle[J]. AJVS, 2015, 45(1): 146. DOI:10.5455/ajvs. (  0) 0) |
| [5] |
LIU Y, LI D, LI H, et al. A novel SNP of the ATP1A1 gene is associated with heat tolerance traits in dairy cows[J]. Mol Biol Rep, 2011, 38(1): 83-88. DOI:10.1007/s11033-010-0080-8 (  0) 0) |
| [6] |
LIU Y X, ZHOU X, LI D Q, et al. Association of ATP1A1 gene polymorphism with heat tolerance traits in dairy cattle[J]. Genet Mol Res, 2010, 9(2): 891-896. DOI:10.4238/vol9-2gmr769 (  0) 0) |
| [7] |
SPELMAN R J, FORD C A, MCELHINNEY P, et al. Characterization of the DGAT1 gene in the New Zealand dairy population[J]. J Dairy Sci, 2002, 85(12): 3514-3517. DOI:10.3168/jds.S0022-0302(02)74440-8 (  0) 0) |
| [8] |
LARDIZABAL K D, MAI J T, WAGNER N W, et al. DGAT2 is a new diacylglycerol acyltransferase gene family:Purification, cloning, and expression in insect cells of two polypeptides from mortierella ramanniana with diacylglycerol acyltransferase activity[J]. J Biol Chem, 2001, 276(42): 38862-38869. DOI:10.1074/jbc.M106168200 (  0) 0) |
| [9] |
SUN D, JIA J, MA Y, et al. Effects of DGAT1 and GHR on milk yield and milk composition in the Chinese dairy population[J]. Anim Genet, 2009, 40(6): 997-1000. DOI:10.1111/age.2009.40.issue-6 (  0) 0) |
| [10] |
YU S P. Na+, K+-ATPase:The new face of an old player in pathogenesis and apoptotic/hybrid cell death[J]. Biochem Pharmacol, 2003, 66(8): 1601-1609. DOI:10.1016/S0006-2952(03)00531-8 (  0) 0) |
| [11] |
王丽娟. 催乳素基因、生长激素受体基因多态性与奶牛产奶性状关联性分析[D]. 济南: 山东大学, 2008.
(  0) 0) |
| [12] |
齐超, 谢岩, 吴晓平, 等. 基于全基因组信息鉴定中国荷斯坦牛产奶性状基因及功能注释[J]. 畜牧兽医学报, 2012(6): 872-877. (  0) 0) |
| [13] |
SCHAEFFELER E, ZANGER U M, EICHELBAUM M, et al. Highly multiplexed genotyping of thiopurine s-methyltransferase variants using maldi-tof mass spectrometry:Reliable genotyping in different ethnic groups[J]. Clin Chem, 2008, 54(10): 1637-1647. DOI:10.1373/clinchem.2008.103457 (  0) 0) |
| [14] |
JIANG L, LIU J F, SUN D X, et al. Genome wide association studies for milk production traits in Chinese Holstein population[J]. PLoS One, 2010, 5(10): e136611. (  0) 0) |
| [15] |
HARHAY G P, SONSTEGARD T S, KEELE J W, et al. Characterization of 954 bovine full-CDS cDNA sequences[J]. BMC Genomics, 2005, 6(1): 166. DOI:10.1186/1471-2164-6-166 (  0) 0) |
| [16] |
SMITH T P, GROSSE W M, FREKING B A, et al. Sequence evaluation of four pooled-tissue normalized bovine cDNA libraries and construction of a gene index for cattle[J]. Genome Res, 2001, 11(4): 626-630. DOI:10.1101/gr.170101 (  0) 0) |
| [17] |
RAVEN L A, COCKS B G, HAYES B J. Multibreed genome wide association can improve precision of mapping causative variants underlying milk production in dairy cattle[J]. BMC Genomics, 2014, 15(1): 62. DOI:10.1186/1471-2164-15-62 (  0) 0) |
| [18] |
GRISART B, FARNIR F, KARIM L, et al. Genetic and functional confirmation of the causality of the DGAT1 K232A quantitative trait nucleotide in affecting milk yield and composition[J]. Proc Natl Acad Sci USA, 2004, 101(8): 2398-2403. DOI:10.1073/pnas.0308518100 (  0) 0) |
| [19] |
WEST J W. Effects of heat-stress on production in dairy cattle[J]. J Dairy Sci, 2003, 86(6): 2131-2144. DOI:10.3168/jds.S0022-0302(03)73803-X (  0) 0) |
| [20] |
JIANG L, LIU X, YANG J, et al. Targeted resequencing of GWAS loci reveals novel genetic variants for milk production traits[J]. BMC Genomics, 2014, 15(1): 1. DOI:10.1186/1471-2164-15-1 (  0) 0) |
| [21] |
BLOTT S, KIM J J, MOISIO S, et al. Molecular dissection of a quantitative trait locus:A phenylalanine-to-tyrosine substitution in the transmembrane domain of the bovine growth hormone receptor is associated with a major effect on milk yield and composition[J]. Genet, 2003, 163(1): 253-266. (  0) 0) |
| [22] |
VⅡTALA S. The role of the bovine growth hormone receptor and prolactin receptor genes in milk, fat and protein production in Finnish Ayrshire dairy cattle[J]. Genet, 2006, 173(4): 2151-2164. DOI:10.1534/genetics.105.046730 (  0) 0) |
| [23] |
CHAMBERLAIN A J, HAYES B J, SAVIN K, et al. Validation of single nucleotide polymorphisms associated with milk production traits in dairy cattle[J]. J Dairy Sci, 2012, 95(2): 864-875. DOI:10.3168/jds.2010-3786 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37