球孢白僵菌Beauveria bassiana是目前研究较深入、应用广泛的一种昆虫病原真菌, 其致病性强、杀虫范围广, 在多种害虫的防治中取得了显著的经济、社会和生态效益[1]。我国曾大规模地应用球孢白僵菌防治马尾松毛虫Dendrolimus punctatus Walker, 并取得了巨大的成功[2-3]。球孢白僵菌也广泛应用于防治亚洲玉米螟Ostrinia furnacalis, 特别是我国东北地区利用白僵菌防治越冬代玉米螟成为玉米螟生物防治的重要方法[4-5]。
球孢白僵菌侵染寄主昆虫一般要经历分生孢子的附着、萌发与穿透表皮, 菌丝在血腔内生长、产生毒素、致死寄主、入侵所有器官继而穿出表皮, 产生新一代分生孢子、继续扩散流行等阶段。球孢白僵菌的致病机理不像化学农药那样依靠自身毒力杀死害虫, 而是通过吸收寄主体内水分和养分满足自身菌丝生长, 导致寄主体内生理代谢紊乱或代谢发生障碍而死亡。关于寄主昆虫对球孢白僵菌的免疫作用已有一些研究, 大腊螟Galleria mellonalla幼虫感染球孢白僵菌后在最佳条件和热激条件下产生不同的体液免疫能力[6]; 接种球孢白僵菌分生孢子对桑天牛Apriona germari幼虫血细胞数量有显著的影响[7]。对亚洲玉米螟幼虫注射不同剂量球孢白僵菌芽生孢子后, 其血细胞总数发生变化, 活体与离体血细胞均对芽生孢子产生包囊作用, 但是在活体条件下血细胞粘附在芽生孢子表面形成包囊, 而在离体条件下包囊形成的速度较慢, 其致密程度不如活体状态, 表明亚洲玉米螟对球孢白僵菌芽生孢子具有细胞防御能力[8]。膜翅目寄生蜂腰带长体茧蜂Macrocentrus cingulum是亚洲玉米螟的重要天敌, 腰带长体茧蜂的卵不会被亚洲玉米螟血细胞囊胞化, 因而可以在其体内完成发育, 这一现象说明寄主昆虫与寄生物具有复杂的免疫与抗免疫关系[9-10]。
亚洲玉米螟血细胞系SYSU-OfHe-C由中山大学胡建博士创建, 可连续继代培养[11]。本研究将考察球孢白僵菌对亚洲玉米螟血细胞SYSU-OfHe-C的毒性及其形态的影响, 进一步研究亚洲玉米螟幼虫与球孢白僵菌的免疫互作关系, 促进利用球孢白僵菌防治亚洲玉米螟生物防治技术的发展。
1 材料与方法 1.1 材料亚洲玉米螟幼虫血细胞系SYSU-OfHe-C由中山大学生命科学学院胡建博士馈赠。球孢白僵菌BbTS01菌株是华南农业大学天然农药与化学生物学教育部重点实验室从西藏日喀则市白朗县土壤中分离获得。
EX-CELL420培养基(美国Sigma公司); 胎牛血清(Gibco公司); MTT(南京凯基生物科技发展有限公司); CCK-8(日本同仁公司); 二甲基亚砜DMSO(美国Sigma公司); 吐温80(天津市富宇精细化工有限公司)。
酶标仪(iMark, 伯乐生命医学产品有限公司); 倒置显微镜(MF52型, 广州市明美光电技术有限公司); 96孔板(美国Corning Incorporated公司), 血球计数板(上海求精生化试剂仪器有限公司)。
1.2 方法亚洲玉米螟幼虫血细胞系SYSU-OfHe-C采用EX-CELL420培养基添加φ为10%的胎牛血清, 27 ℃恒温培养, 每隔3~4 d传代1次, 取对数期细胞用于试验。球孢白僵菌BbTS01菌株取斜面菌种接种于PDA平板上培养约2周, 收集分生孢子。取分生孢子100 mg, 用2 g·L-1的吐温水1 mL配成悬浮液, 采用血球计数板计数, 调整浓度为107 mL-1备用。
1.2.1 球孢白僵菌对血细胞系SYSU-OfHe-C细胞的毒力测定1) MTT法:96孔板每孔加入90 μL受试细胞悬浮液, 静置培养24 h, 待细胞浓度为1×105 mL-1时, 分别滴加10 μL球孢白僵菌分生孢子悬浮液, 使球孢白僵菌分生孢子终浓度分别达到3.5×106、3.5×105、3.5×104、3.5×103 mL-1, 以2 g·L-1吐温水为对照, 以不加细胞的完全培养基为本底, 每个处理重复4次。在27 ℃恒温培养箱中培养24 h后, 每孔加入50 μL的1×MTT, 27 ℃培养4 h, 吸出上清液(悬浮细胞用此法时经1 000 r·min-1离心后去除上清液), 每孔加入150 mL DMSO使甲臜溶解, 摇匀; 酶标仪测定波长处检测每孔的D490 nm。2) CCK-8法:细胞培养与处理方法同上述MTT法, 接种球孢白僵菌分生孢子并培养24 h后, 向每孔加入10 μL CCK-8溶液, 注意不形成气泡, 将培养板在培养箱内孵育1~4 h, 酶标仪测定D450 nm。
1.2.2 球孢白僵菌对血细胞系SYSU-OfHe-C细胞形态的影响96孔板每孔加入90 μL受试细胞悬浮液, 静置24 h, 接种球孢白僵菌分生孢子悬浮液使其终浓度为3.5×104 mL-1, 倒置显微镜下监测球孢白僵菌与血细胞的生长情况, 每隔30 min拍照记录。取上述接种球孢白僵菌后培养24 h的亚洲玉米螟血细胞, 在光学显微镜与扫描电子显微镜下观察其形态变化, 并拍照记录。
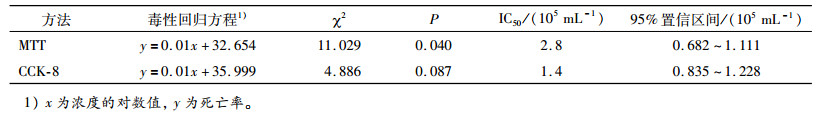
1.3 数据处理试验结果采用SPSS软件分析细胞死亡率, 改良寇氏法[12]计算IC50值。
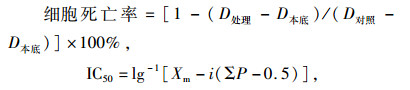
|
式中, Xm为处理最大浓度的对数值; i为各浓度倍比浓度的对数值; ΣP为各组死亡率之和; 0.5为经验常数。
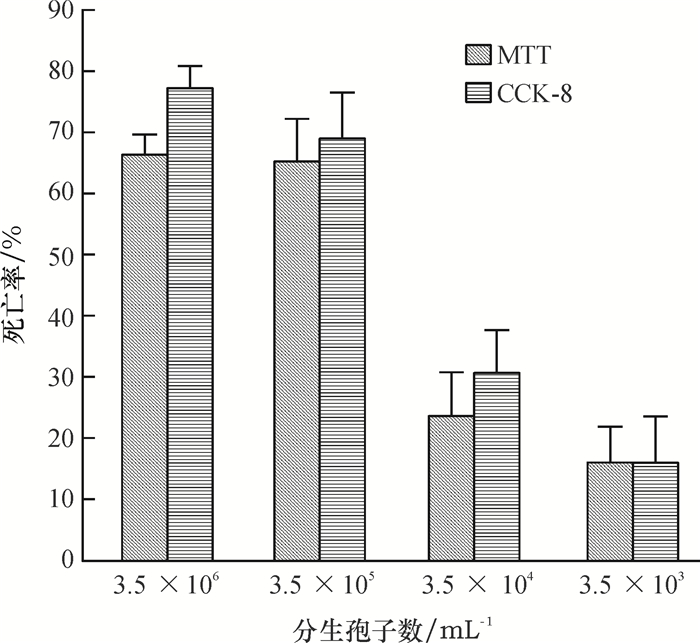
2 结果与分析 2.1 球孢白僵菌对血细胞系SYSU-OfHe-C细胞的毒力测定球孢白僵菌对SYSU-OfHe-C细胞的毒力测定结果见图 1, 不同浓度的球孢白僵菌分生孢子悬浮液处理24 h后, SYSU-OfHe-C细胞的死亡率不同, 随着球孢白僵菌分生孢子悬浮液浓度的增大, SYSU-OfHe-C细胞的死亡率增加, 总体上看, CCK-8法与MTT法的结果相差不大, 但前者测得的SYSU-OfHe-C细胞死亡率更高一点, 当球孢白僵菌分生孢子悬浮液浓度为3.5×106 mL-1, CCK-8法测得的SYSU-OfHe-C细胞死亡率达77.3%, MTT法为66.4%;球孢白僵菌分生孢子悬浮液浓度为3.5×103 mL-1, CCK-8法与MTT法的死亡率分别为15.2%和15.6%。CCK-8法与MTT法测得球孢白僵菌对SYSU-OfHe-C细胞的毒力回归方程见表 1, 从表 1可知MTT法测得球孢白僵菌分生孢子对SYSU-OfHe-C细胞的IC50(2.8×105 mL-1)稍高于CCK-8法的IC50(1.4×105 mL-1)。
|
图 1 球孢白僵菌处理24 h后SYSU-OfHe-C细胞的死亡率 Figure 1 The mortality rate in SYSU-Of He-C cells at 24 hours after treatment of Beauveria bassiana |
|
|
表 1 球孢白僵菌对SYSU-OfHe-C细胞的毒力回归方程和IC50值 Table 1 The toxicity regression equation and IC50 value of Beauveria bassiana against SYSU-OfHe-C cells |
在光学显微镜下观察发现, 在接种球孢白僵菌分生孢子后, 大约10 h分生孢子萌发长出菌丝, 此后菌丝不断伸长, 亚洲玉米螟血细胞开始移动、数量变少且形态改变, 至24 h左右, 球孢白僵菌菌丝长满整个视野, 未见囊胞化与吞噬作用(图 2)。

|
图 2 球孢白僵菌与SYSU-OfHe-C细胞生长的实时监测 Figure 2 Real-time monitoring of the growth of Beauveria bassiana and SYSU-OfHe-C cells a:SYSU-OfHe-C细胞; b:球孢白僵菌菌丝; 标尺为100 μm。 |
接种球孢白僵菌分生孢子24 h后, SYSU-OfHe-C细胞部分从近似圆形变长或者变为不规则形状, 似乎还原成浆血细胞和类绛色细胞的原始形状, 但未见吞噬与囊胞化等细胞免疫现象发生。另外, 也发现少数SYSU-OfHe-C细胞聚集、破碎、细胞减少, 以及出现空泡和瘤状突起等现象(图 3)。在扫描电镜下还观察到球孢白僵菌菌丝穿透SYSU-OfHe-C细胞的现象(图 4)。

|
图 3 球孢白僵菌对SYSU-OfHe-C细胞形态的影响 Figure 3 Effects of Beauveria bassiana on the morphology of SYSU-OfHe-C cells CK:对照; A1~A4表示球孢白僵菌处理浓度分别为3.5×103、3.5×104、3.5×105、3.5×106 mL-1; ag:细胞聚集, ex:细胞膨胀, va:空泡, db:细胞破碎, str:瘤状突起; 标尺为100 μm。 |

|
图 4 扫描电镜下的球孢白僵菌菌丝与SYSU-OfHe-C细胞的相互作用 Figure 4 The interaction between Beauveria bassiana mycelia and SYSU-OfHe-C cells under scanning electron microscopy A:对照; B:处理; a、b分别表示对照组和处理组SYSU-OfHe-C细胞; c:球孢白僵菌菌丝。 |
本研究运用MTT和CCK-8法测定了球孢白僵菌对SYSU-OfHe-C细胞的毒力, 结果有一定差异, 可能原因是:使用MTT法检测时, 需要使用裂解液溶解甲臜晶体沉淀, 可能遇到颗粒不完全溶解、吸取上清的操作中带走部分细胞等问题, 导致MTT法的结果容易出现细胞死亡率比实际情况偏低的情况; 而CCK-8是一种综合指标较好的细胞毒性检测试剂, 对细胞的毒性相当低, 其检测原理和检测条件与MTT法略有差异。CCK-8法产生的甲臜是水溶性的, 可以省去后续的溶解步骤, 减少一定的误差, 使试验结果更加稳定, 尽管当有还原物质存在时会影响CCK-8的测定, 但CCK-8法一般比MTT法更加灵敏、稳定, 而且重复性较好。
昆虫细胞免疫反应是由血细胞介导的, 主要依赖血细胞对外来异物的吞噬、集结和包囊[13]。包囊反应在昆虫细胞免疫反应中占有很重要的位置, 对昆虫细胞免疫反应的研究必定要进行囊胞化分析。本试验未发现亚洲玉米螟细胞系SYSU-OfHe-C对球孢白僵菌的囊胞化与吞噬作用等细胞免疫现象, 可能原因之一是SYSU-OfHe-C本身特性决定的, 其缺乏血浆的某些成份, 影响了其囊胞化效率[11]; 也与球孢白僵菌本身的特性有关, 球孢白僵菌是一种通过营养竞争策略使寄主昆虫生病的虫生真菌, 通过增加入侵量和快速分裂或生长来逃避寄主昆虫的免疫防御[14]; 也可能与血细胞的密度有关[15], 自然情况下, 亚洲玉米螟体内血细胞密度约为1.0×107~4.0×107 mL-1[9], 本研究采用细胞密度为1.0×105 mL-1, 低于亚洲玉米螟体内血细胞密度, 有可能造成SYSU-OfHe-C细胞囊胞化作用降低。
球孢白僵菌等微生物制剂的广泛应用是农业发展的重要方向, 亚洲玉米螟是我国重要的农业害虫, 生物因子在控制亚洲玉米螟种群数量方面起着十分重要的作用[16]。通过研究球孢白僵菌对亚洲玉米螟血细胞系SYSU-OfHe-C的毒力作用和对其细胞形态及生长的影响, 为进一步深入研究亚洲玉米螟幼虫与球孢白僵菌的免疫互作奠定基础, 有利于促进球孢白僵菌对亚洲玉米螟的生物防治。
| [1] |
季宏平. 生物制剂白僵菌防治玉米螟研究[J]. 玉米科学, 2001, 9(1): 75-76. (  0) 0) |
| [2] |
季香云, 杨长举. 白僵菌的致病性与应用[J]. 中国生物防治, 2003, 19(2): 82-85. (  0) 0) |
| [3] |
李增智, 黄勃, 陈名君, 等. 分子时代的白僵菌研究[J]. 菌物学报, 2011, 30(6): 823-835. (  0) 0) |
| [4] |
KHALED M, RAHMAN A, BARTA M, et al. Effect of combining Beauveria bassiana and Nosema pyrausta on the mortality of Ostrinia nubilalis[J]. Cent Eur J Biol, 2010, 5(4): 472-480. (  0) 0) |
| [5] |
张振铎, 李国忠, 王江, 等. 玉米螟生物防治措施的复合应用研究[J]. 昆虫知识, 2010, 47(6): 1208-1211. (  0) 0) |
| [6] |
IWONA W, PATRYK K, TERESA J. Humoral immune response of Galleria mellonella larvae after infection by Beauveria bassiana under optimal and heat-shock conditions[J]. J Insect Physiol, 2009, 55(6): 525-531. DOI:10.1016/j.jinsphys.2009.01.014 (  0) 0) |
| [7] |
王达, 苏筱雨, 黄大庄, 等. 桑天牛幼虫血淋巴对球孢白僵菌的防御反应[J]. 林业科学, 2009, 45(4): 83-87. DOI:10.3321/j.issn:1001-7488.2009.04.014 (  0) 0) |
| [8] |
陶淑霞, 李玉, 刘家富, 等. 球孢白僵菌对亚洲玉米螟幼虫血细胞数量和包囊作用的影响[J]. 植物保护学报, 2011, 38(6): 527-531. (  0) 0) |
| [9] |
HU J, ZHU X X, FU W J. Passive evasion of encapsulation in Macrocentrus cingulum Brischke (Hymenoptera:Braconidae), a polyembryonic parasitoid of Ostrinia furnacalis Guenee(Lepidoptera:Pyralidae)[J]. J Insect Physiol, 2003, 49(4): 367-375. DOI:10.1016/S0022-1910(03)00021-0 (  0) 0) |
| [10] |
胡建, 符文俊. 亚洲玉米螟幼虫血细胞的包囊行为[J]. 动物学研究, 2003, 24(6): 435-440. DOI:10.3321/j.issn:0254-5853.2003.06.006 (  0) 0) |
| [11] |
HU J, FENG X P, YANG Z G, et al. A continuous cell line, SYSU-OfHe-C, from hemocytes of Ostrinia furnacalis possesses immune ability depending on the presence of larval plasma[J]. Dev Comp Immunol, 2014, 45(1): 10-20. DOI:10.1016/j.dci.2014.01.025 (  0) 0) |
| [12] |
周绪正, 张继瑜, 赵成莹, 等. 小鼠和大鼠口服氢溴酸槟榔碱的急性毒性试验[J]. 动物医学研究进展, 2007, 9(28): 34-36. (  0) 0) |
| [13] |
WILLOTT E, HALLBERG C A, TRAN H Q. Influence of calcium on Manduca sexta plasmatocyte spreading and network formation[J]. Arch Insect Biochem Physiol, 2002, 49(4): 187-202. DOI:10.1002/(ISSN)1520-6327 (  0) 0) |
| [14] |
尹飞, 胡琼波, 钟国华, 等. 昆虫病原真菌抗血淋巴免疫的机理[J]. 中国生物防治, 2009(Z1): 63-70. (  0) 0) |
| [15] |
赵华福, 刘佳, 胡建. 一种体外分析亚洲玉米螟幼虫血细胞包囊的改进方法[J]. 动物学研究, 2007, 28(6): 675-680. DOI:10.3321/j.issn:0254-5853.2007.06.016 (  0) 0) |
| [16] |
段小莉, 何康来, 王振营, 等. 亚洲玉米螟越冬幼虫主要寄生性天敌及病原菌致死率的考察[J]. 中国生物防治学报, 2014, 30(6): 823-827. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37