荞麦Fagopyrum起源于中国的西南地区,是我国重要的杂粮作物之一[1]。荞麦具有食药兼用特性,营养价值丰富、药用保健效果较好[2-3]。例如荞麦所富含的黄酮类化合物,尤其是芦丁具有明显的降血糖、降血脂和降血压功效[4]。由于荞麦具有生育期短、耐贫瘠特性,特别适合在高寒地区种植[5]。普通荞麦Fagopyrum esculentum又名甜荞,包含栽培和野生类型。栽培甜荞种植面积较广,在我国南北地区均有栽培。野生甜荞是栽培甜荞的祖先,主要分布于中国西南地区,特别是西藏、云南和四川,其形态与栽培甜荞非常相似,但具有落花、落果习性[1, 6-7]。植物丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)是生物信号传递网络中的重要信号分子[8-10]。MAPK级联途径通过调节植物细胞分裂、分化及凋亡等过程,调控植株生长和发育[9, 11-12]。不仅如此,MAPK信号通路还在植物激素代谢以及逆境胁迫应答调控方面发挥重要作用[11, 13-15]。高华健等[16]研究发现MAPK通过调节H2O2和生长素的平衡可以调控水稻幼苗根系的生长。梁卫红等[17]研究发现逆境胁迫如高盐、低温和脱落酸能使OsMAPK14基因表达上调,进而降低逆境对水稻生长发育的影响。此外,有研究指出MAPK可与IDA(Inflorescence deficient in abscission)、HAE(受体蛋白激酶HAESA)和HSL2(HAESA-like 2)共同作用,调控离层细胞的程序化死亡,进而参与调控植物花器官的脱落过程[18]。目前鲜见有关荞麦MAPK基因的相关报道。本试验根据前期转录组基因测序所得到MAPK的Unigene序列,设计特异性引物,经PCR扩增测序分析普通荞麦栽培品种与野生种质间此基因片段序列的差异,以期为荞麦MAPK基因功能研究与荞麦的花果器官脱落、起源与进化等相关研究提供理论依据。
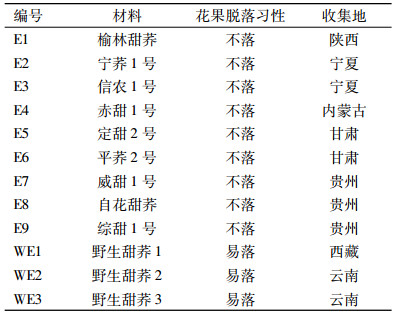
1 材料与方法 1.1 材料普通荞麦:9个栽培品种,3个具有落花、落果习性的野生种质,均由贵州师范大学荞麦产业技术研究中心提供(表 1)。使用1.25 mL· L-1新洁尔灭溶液对种子消毒后放置于25 ℃光照培养箱,待种子发芽后播种于含腐殖土的花盆。
|
|
表 1 供试的普通荞麦材料 Table 1 The common buckwheat materials used in this study |
根据前期转录组基因测序所得到的荞麦Unigene序列,进行基因功能注释和数据库基因序列比对,获得荞麦MAPK序列片段。根据MAPK基因序列片段的保守区域,利用Primer5.0软件设计正向特异性引物5′-GTGTTGCTCACCAGTTGGATT-3′和反向特异性引物5′-GTCAGTGGGGTGACCTATCTT-3′。幼苗期对供试材料植株嫩叶进行取样,使用改良CTAB法提取DNA,PCR扩增参考陈晴晴等[19]的方法。PCR反应体系总体积为60 μL,包含2×Taq PCR MasterMix 30 μL,5 μmol·L-1引物各6 μL,40 ng·μL-1 DNA模板和ddH2O 9 μL。扩增反应体系为:94 ℃预变性10 min;94 ℃变性60 s,退火45 s,72 ℃延伸1 min,循环35次;72 ℃延伸10 min。扩增产物经琼脂糖凝胶电泳检测后送上海生工生物工程有限公司进行测序。
1.3 序列分析与进化树的构建在本地数据库(未发表)对前期转录组测序所获得的荞麦MAPK基因的Unigene序列进行Nucleotide blast,获得荞麦MAPK基因的cDNA序列;在NCBI数据库(http://blast.ncbi.nlm.nih.gov)上使用Nucleotide blast对测序获得的基因片段序列进行在线比对;使用Protein blast进行氨基酸序列的在线比对。使用ClustalW软件进行多序列比对分析;使用DNAssist2.2和MEGA6软件进行核酸和氨基酸序列差异分析;使用MEGA6软件构建系统进化树。在网页(http://swissmodel.expasy.org/workspace)上使用Swiss-model对MAPK片段进行蛋白质结构在线预测[20-22]。
2 结果与分析 2.1 荞麦MAPK基因序列对荞麦转录组基因测序所得到的Unigene进行基因功能注释和数据库基因序列比对,获得MAPK的Unigene序列。在本地基因组数据库中对该Unigene基因序列进行Nucleotide blast分析,获得荞麦MAPK序列。生物信息学分析发现,该基因cDNA序列全长为2 835 bp,碱基组成为A占29.5%、C占20.6%、G占22.1%、T占27.8%。荞麦MAPK基因含有1个1 827 bp的开放阅读框(ORF),编码609个氨基酸。从图 1可知,该ORF区域编码的氨基酸包含TDY的三肽模块,为植物D组MAPK蛋白的典型结构。NCBI数据库在线使用Nucleotide blast对所获得的荞麦MAPK基因序列进行比对。结果发现荞麦MAPK基因序列与陆地棉Gossypium hirsutum、烟草Nicotiana tabacum、可可Theobroma cacao等数十个物种上百个已知MAPK家族基因序列的相似性高于70%,属于高度同源。因此,认为该基因为植物MAPK基因D组中的一员。

|
图 1 荞麦MAPK基因的开放阅读框序列及其编码的氨基酸序列 Figure 1 The open reading frame and its coding amino acid sequence of buckwheat MAPK gene *标记MAPK典型的TDY结构。 |
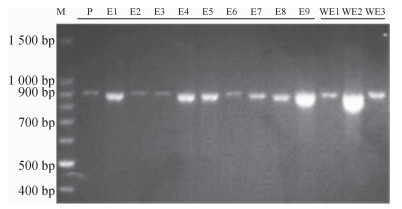
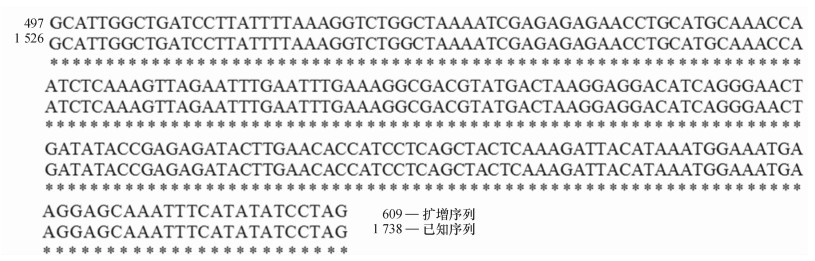
提取普通荞麦9个栽培品种和3个野生种质植株幼嫩叶片的DNA,利用特征引物扩增MAPK基因序列。琼脂糖凝胶电泳检测发现,12个供试材料中PCR扩增得到的产物在约900 bp处产生特异性条带;测序结果发现,E1中产生的特异条带序列片段为886 bp(图 2)。对序列片段进行本地数据库Nucleotide blast比对分析,结果发现该片段部分序列与普通荞麦MAPK基因cDNA片段部分序列相似性达到100%(图 3),说明PCR扩增产物即为普通荞麦MAPK基因片段。
|
图 2 普通荞麦特异引物PCR扩增结果 Figure 2 Amplification products of common buckwheat DNA using specified primers M:Marker条带;P:阳性对照。 |
|
图 3 普通荞麦DNA序列比对结果 Figure 3 The output of common buckwheat DNA sequence alignment |
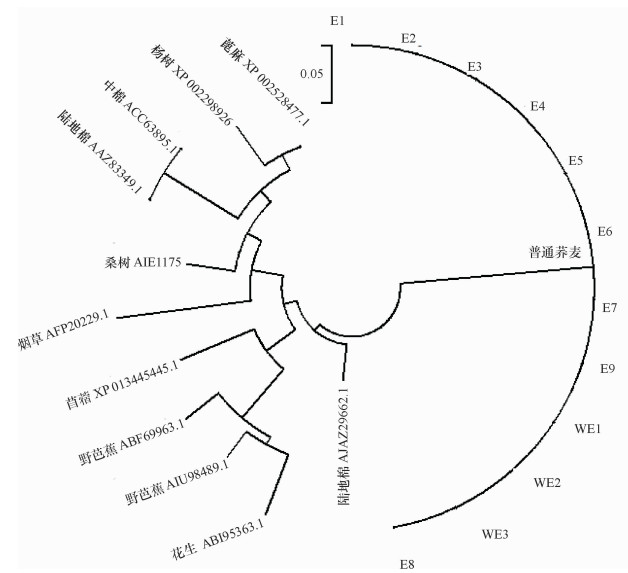
利用DNAssist软件对E1中目标片段基因序列进行分析,结果发现该片段含有1个序列为300 bp的开放阅读框(ORF),编码1个MAPK蛋白保守结构域,与烟草、陆地棉、桑树等20余个物种中上百个已知的MAPK家族蛋白序列相似性达78%~88%。通过Protein blast比对得到与普通荞麦MAPK蛋白片段序列相似性较高的烟草(AFP20229.1)、陆地棉(AJA29662.1;AAZ83349.1)、中棉(ACC63895.1)、野芭蕉(ABF69963.1;AIU98489.1)、苜蓿(XP 013445445.1)、杨树(XP 002298926.1)、花生(ABI95363.1)、蓖麻(XP 002528477.1)、桑树(AIE11757.1)MAPK蛋白片段序列。利用MEGA6软件对其进行系统进化分析,从聚类图可知,同一物种或亲缘关系较近物种的MAPK序列差异较小,被聚在一起。由图 4可知,普通荞麦栽培品种与野生种质的MAPK蛋白被聚在一起,亲缘关系近。
|
图 4 不同植物MARK蛋白序列的聚类分析 Figure 4 Phylogenetic tree of MAPK protein sequences from different plant species |
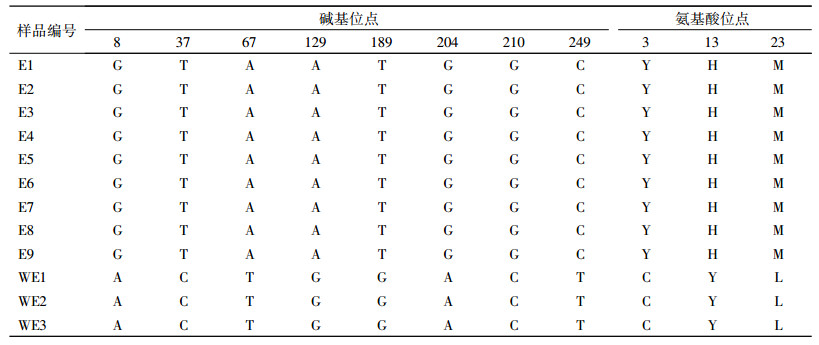
对12个供试材料扩增得到的目标基因片段序列进行分析,结果发现该片段序列的相对碱基组成频率差别不大,A为28.81%、T(U)为32.73%、C为18.30%,G为20.15%,A+T含量(61.54%)明显高于C+G(38.46%)。使用ClustalW对该片段序列进行多重比较分析,去掉序列两端缺失导致排列不整齐的位点,对其中793个位点进行多态性统计,结果发现在12个供试材料中该基因序列片段的不变位点为723个,多态位点为70个(包含简约信息位点数43个)。其中,在9个栽培品种间多态位点仅为22个(包含简约信息位点数10个),3个野生材料间多态位点为25个。
使用ClustalW对12个供试材料MAPK基因片段序列进行比较,结果发现普通荞麦9个栽培品种ORF区域序列无位点差异,高度保守;3个野生材料中ORF区域序列也无位点差异,高度保守;但栽培品种与野生材料ORF区域序列含有8个差异位点。对ORF编码的氨基酸序列进行分析发现,普通荞麦栽培品种与野生材料ORF结构域氨基酸序列存在3个变异位点(表 2)。
|
|
表 2 普通荞麦栽培品种与野生种质间MARK ORF片段的碱基和氨基酸差异位点 Table 2 The differential sites of the nucleotides and amino acids in MARK ORF fragments between cultivars and wild types of common buckwheat |
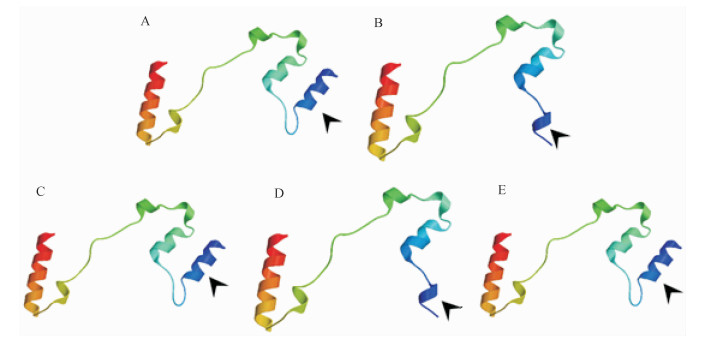
使用Swiss-model对MAPK的ORF片段进行蛋白质结构在线预测,结果发现普通荞麦栽培品种和野生种质材料间ORF蛋白结构存在明显的构象差异。从图 5中可知,与栽培品种相比,3个氨基酸差异位点导致野生种质材料ORF蛋白的1个α-螺旋构象发生改变。进一步对3个氨基酸位点单位点置换后进行蛋白质结构预测,结果发现ORF第13位点组氨酸(H)→酪氨酸(Y)发生转换导致蛋白结构域发生构象变化(图 5D),而其余2个氨基酸位点的转换并不影响蛋白的构象(图 5C、5E)。
|
图 5 普通荞麦MARK蛋白结构域分析 Figure 5 Domain analysis of MAPK protein of common buckwheat A:栽培品种;B:野生种质; C、D、E分别为栽培品种MAPK蛋白第3位点Y→C(C)、第13位点H→Y(D)和第23位点M→L(E)发生转换后的结构域;箭头指向结构发生改变的区域。 |
荞麦起源于我国西南地区,种植历史悠久。荞麦生育期短、生长适应性强、抗逆性较强,在历史上一直作为一种重要的救灾粮食作物[5]。植物MAPK基因是MAPK级联信号途径中的关键信号分子,在逆境胁迫应答方面具有重要调控作用[10-11]。生物信息学分析发现荞麦MAPK序列全长为2 835 bp,包含1个1 827 bp的ORF,编码609个氨基酸。植物MAPK具有典型的TEY区或TDY区的模块,其中,TEY类分为A、B、C 3组,TDY类则单独为D组[11]。荞麦MAPK序列中含有2个TDY模块,属于D组MAPK蛋白。
通过PCR扩增和目标片段测序得到的目标基因片段的部分序列与MAPK基因部分序列相似性达到100%,因此认为PCR扩增得到的产物即为普通荞麦MAPK基因片段。特定基因序列间的差异可作为研究物种进化关系的依据[23]。在线Blast比对发现,普通荞麦MAPK片段序列与近缘植物,例如陆地棉的MAPK1基因(KM190106.1)序列相似性高于80%,其ORF区域编码1个MAPK蛋白保守结构域,与陆地棉(AJA29662.1;AAZ83349.1)MAPK蛋白等序列相似性均高于80%,说明植物MAPK基因序列在进化过程中较为保守。李凤梅[25]研究发现植物丝裂原活化蛋白激酶激酶(MAPKK)基因序列高度保守。本研究发现12个供试材料间MAPK基因片段序列793个位点中多态位点为70个,ORF区域序列多态位点仅为8个。尤其是9个栽培甜荞间MAPK基因片段ORF区域序列无差异位点,3个野生甜荞间MAPK基因片段ORF区域序列无位点差异,说明栽培驯化过程中普通荞麦MAPK基因序列高度保守。
Cho等[18]研究发现,MAPK基因参与调控了植物花器官的花梗离层细胞程序化死亡的过程,进而介导花器官的脱落。Meng等[26]研究指出,拟南芥中MAPK级联信号下游ERECTA受体蛋白激酶通过促进细胞增殖进而调控花梗形态建成。野生甜荞是栽培甜荞的祖先,易落花落果[1]。克服落花落果习性一直是普通荞麦栽培驯化的一个主要目标。对普通荞麦MAPK基因片段ORF区域序列分析发现,栽培甜荞与野生甜荞间存在8个碱基差异位点,编码3个差异氨基酸,导致1个α-螺旋构象发生改变。此外,研究还发现9个栽培甜荞间ORF区域序列高度一致,3个野生甜荞间ORF区域序列也保持高度一致。说明人工栽培驯化对这3个差异氨基酸位点的选择具有高度一致性。与9个栽培甜荞相比,供试的3个野生甜荞均具有落花落果习性。对3个差异氨基酸位点进行单位点置换的蛋白结构预测,结果发现α-螺旋构象变化是由ORF区域第13位点组氨酸(H)→酪氨酸(Y)发生置换所导致,暗示其可能与野生甜荞落花进化为不落花型栽培甜荞事件有关。研究结果为进一步研究荞麦MAPK基因功能以及栽培进化提供了理论基础。
致谢:感谢贵州师范大学黎瑞源老师给予的支持和帮助!
| [1] |
陈庆富. 荞麦属植物科学[M]. 北京: 科学出版社, 2012, 1-9.
(  0) 0) |
| [2] |
AHMED A, KHALID N, AHMED A, et al. Phytochemicals and biofunctional properties of buckwheat: A review[J]. J Agri Sci, 2014, 152(3): 349-369. (  0) 0) |
| [3] |
WIJNGAGRD H H, ARENDT E K. Buckwheat[J]. Cereal Chem, 2006, 83(4): 391-401. (  0) 0) |
| [4] |
SEDEJ I, SAKAČ M, MANDIĆ A, et al. Buckwheat (Fagopyrum esculentum Moench) grain and fractions: Antioxidant compounds and activities[J]. J Food Sci, 2012, 77(9): 954-959. (  0) 0) |
| [5] |
JACQUEMART A L, LEDENT J F O, QUINET M, et al. Is buckwheat (Fagopyrum esculentum Moench) still a valuable crop today?[J]. Eur J Plant Sci Biotech, 2012, 6(Special Issue 2): 1-10. (  0) 0) |
| [6] |
OHNISHI O. Discovery of the wild ancestor of common buckwheat[J]. Fagopyrum, 1991, 11: 5-10. (  0) 0) |
| [7] |
OHNISHI O, ASANO N. Genetic diversity of Fagopyrum homotropicum, a wild species related to common buckwheat[J]. Gen Res Crop Evol, 1999, 46(4): 389-398. (  0) 0) |
| [8] |
朱斌, 梁颖. 植物MAPK C族基因的研究进展[J]. 生物技术通报, 2012(11): 27-31. (  0) 0) |
| [9] |
崔菁菁, 刘玮. 植物特有的TDY类丝裂原活化蛋白激酶研究综述[J]. 现代农业科技, 2008(14): 271-272. DOI:10.3969/j.issn.1007-5739.2008.14.200 (  0) 0) |
| [10] |
BOUDSOCQ M, DANQUAH A, DE ZÉLICOURT A, et al. Plant MAPK cascades: Just rapid signaling modules?[J]. Plant Signal Behav, 2015, 10(9): e1062197. (  0) 0) |
| [11] |
张腾国, 刘玉冰, 夏小慧. 植物MAP激酶级联途径研究进展[J]. 西北植物学报, 2008, 28(8): 1704-1714. DOI:10.3321/j.issn:1000-4025.2008.08.032 (  0) 0) |
| [12] |
龚小卫, 姜勇. 丝裂原活化蛋白激酶(MAPK)生物学功能的结构基础[J]. 中国生物化学与分子生物学报, 2003, 19(1): 5-11. DOI:10.3969/j.issn.1007-7626.2003.01.002 (  0) 0) |
| [13] |
张茂迎, 宗晓娟, 李德全. 植物MAPK级联途径参与调控ABA信号转导[J]. 生命科学, 2010, 22(8): 736-743. (  0) 0) |
| [14] |
NAKAGAMI H, PITZSCHKE A, HIRT H. Emerging MAP kinase pathways in plant stress signalling[J]. Trends Plant Sci, 2005, 10(7): 339-346. (  0) 0) |
| [15] |
DANQUAH A, DE ZÉLICOURT A, COLCOMBET J, et al. The role of ABA and MAPK signaling pathways in plant abiotic stress responses[J]. Biotech Adv, 2014, 32(1): 40-52. (  0) 0) |
| [16] |
高华健, 任静, 蔡凤香, 等. MAPK调节水稻幼苗根系生长的分子机制[J]. 江苏农业科学, 2014, 42(1): 18-21. DOI:10.3969/j.issn.1002-1302.2014.01.006 (  0) 0) |
| [17] |
梁卫红, 毕佳佳, 彭威风, 等. 水稻促分裂原活化蛋白激酶基因OsMPK14的克隆及表达分析[J]. 中国水稻科学, 2010, 24(2): 125-130. DOI:10.3969/j.issn.1001-7216.2010.02.04 (  0) 0) |
| [18] |
CHO S K, LARUE C T, CHEVALIER D, et al. Regulation of floral organ abscission in Arabidopsis thaliana[J]. Proc Nati Acad Sci USA, 2008, 105(40): 15629-15634. (  0) 0) |
| [19] |
陈晴晴, 石桃雄, 陈庆富. 荞麦不同种间BW10KD过敏蛋白基因序列比较[J]. 广东农业科学, 2013, 40(9): 133-139. DOI:10.3969/j.issn.1004-874X.2013.09.039 (  0) 0) |
| [20] |
ARNOLD K, BORDOLI L, KOPP J, et al. The SWISS-MODEL workspace: A web-based environment for protein structure homology modeling[J]. Bioinformatics, 2006, 22: 195-201. (  0) 0) |
| [21] |
SCHWEDE T, KOPP J, GUEX N, et al. Swiss-model: An automated protein homology-modeling server[J]. Nucl Acids Res, 2003, 31(13): 3381-3385. (  0) 0) |
| [22] |
GUEX N, PEITSCH M C. Swiss-model and the swiss-pdb viewer: An environment for comparative protein modeling[J]. Electrophoresis, 1997, 18: 2714-2723. DOI:10.1002/(ISSN)1522-2683 (  0) 0) |
| [23] |
岳鹏, 陈庆富. 植物种子蛋白的分子生物学研究进展[J]. 种子, 2011, 30(1): 58-62. DOI:10.3969/j.issn.1001-4705.2011.01.017 (  0) 0) |
| [24] |
肖文娟, 宾金华, 武波. 植物体中的MAPK[J]. 植物学通报, 2004, 21(2): 205-215. DOI:10.3969/j.issn.1674-3466.2004.02.011 (  0) 0) |
| [25] |
李凤梅. 植物丝裂原活化蛋白激酶激酶的生物信息学分析[J]. 北方园艺, 2010(3): 196-199. (  0) 0) |
| [26] |
MENG X, WANG H, HE Y, et al. A MAPK cascade downstream of ERECTA receptor-like protein kinase regulates Arabidopsis inflorescence architecture by promoting localized cell proliferation[J]. Plant Cell, 2012, 24(12): 4948-4960. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37