骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMSCs)具有多分化潜能,可分化为脂肪细胞、肌细胞、骨细胞、软骨细胞等。猪BMSCs向脂肪细胞的分化对机体不同部位(肌内、皮下和腹部)的脂肪沉积具有重要调控作用,进而影响猪的胴体品质和肉品质[1]。钙离子作为机体重要的第2信使可参与调控细胞增殖、分化、凋亡等生物学过程,但其是否参与了猪BMSCs成脂分化过程还不清楚。因此,研究猪BMSCs成脂分化中细胞膜钙离子通道及受体基因的表达变化,是后续研究钙离子信号调控猪BMSCs成脂分化的前提。
猪BMSCs成脂分化形成脂肪细胞包括2个阶段:首先是BMSCs成脂定向分化为脂肪前体细胞,然后是前体脂肪细胞分化为成熟的脂肪细胞[2]。锌指蛋白423(Zinc finger protein 423, Zfp423)是调控BMSCs成脂定向的一个关键基因[3],可促进BMSCs成脂定向形成脂肪前体细胞,而脂肪前体细胞高表达其标志基因脂肪前体细胞因子(Preadipocyte factor 1, Pref-1)[4]。此外,骨形态发生蛋白(Bone morphogenetic protein, BMP)作为多功能生长因子在脂肪生成中也起着至关重要的作用[5-6]。
胞外钙离子可通过细胞膜上的钙离子通道和钙敏感受体(Calcium-sensing receptor, CaSR)来调节胞内钙离子浓度和相关信号通路,进而影响多项细胞生理功能[7]。细胞膜上的钙离子通道包括电压门控钙通道(Voltage-gated calcium channel, VGCC)、瞬时受体电位离子通道(Transient receptor potential, TRP)和钙库调控的钙通道(Store-operated calcium channel, SOC)等。CaSR是细胞膜上能够感受胞外钙离子浓度的G-蛋白偶联受体。研究表明,细胞膜钙离子通道[8-10]和钙敏感受体[11]都可参与调控脂肪前体细胞的成脂分化。但猪BMSCs成脂分化过程中细胞膜钙离子通道和CaSR基因的表达变化及其作用还不清楚。
因此,本试验以猪BMSCs为研究对象,研究其成脂分化中不同时间细胞膜钙离子通道、CaSR基因以及成脂定向相关基因(Zfp423、Pref-1和BMP2/4)的表达,旨在揭示猪BMSCs成脂分化中细胞膜钙离子通道及CaSR基因的表达模式,为后续进一步研究钙信号在猪BMSCs成脂分化中的作用奠定基础。
1 材料与方法 1.1 材料健康的5日龄长白公猪,购于广州力智农业有限公司。DMEM/F12培养基、胎牛血清、胰蛋白酶、青霉素、链霉素和Percoll分离液为Gibco公司产品。辛酸、油酸、地塞米松和胰岛素为Sigma公司产品。
1.2 试验方法 1.2.1 猪骨髓间充质干细胞的分离纯化及成脂分化选5日龄的长白小公猪,采用红细胞裂解法、Percoll密度梯度离心法、差速贴壁法等,从猪骨髓中分离纯化出BMSCs,具体分离纯化步骤参考我们已建立的方法[12]。取第4代的猪BMSCs,待细胞生长至汇合度约90%时,诱导细胞进行成脂分化(诱导液:含50 nmol·L-1胰岛素、50 nmol·L-1地塞米松、50 μmol·L-1油酸、0.5 mmol·L-1辛酸和含体积分数为5%胎牛血清的DMEM/F12培养基),细胞隔天换液,共培养10 d。
1.2.2 测定指标及方法采用油红O染色,观察猪BMSCs成脂分化5、10 d的聚酯情况,并用三酰甘油测定试剂盒检测细胞内三酰甘油的含量。分别于猪BMSCs成脂分化的第0、1、2、5和10天收取细胞样品,采用Trizol法抽提细胞RNA,用Oligo(dT)引物和AMV反转录酶进行反转录,RT-PCR反应体系为SYBR Premix Ex Taq,上、下游引物和cDNA模板,以β-actin为内参,荧光定量PCR法检测胞膜钙离子通道(CACNA2D1、Orai1、TRPC1、TRPM7、TRPV1)和钙敏感受体(CaSR)基因、成脂定向相关基因(Zfp423、Pref-1、BMP2、BMP4)的mRNA表达水平。相关基因的引物序列见表 1。
|
|
表 1 荧光定量PCR所用引物序列 Table 1 Primer sequences used for real-time quantitative PCR |
采用Sigmaplot 12.5软件进行统计分析,不同时间点基因表达水平比较采用单因素方差分析方法。
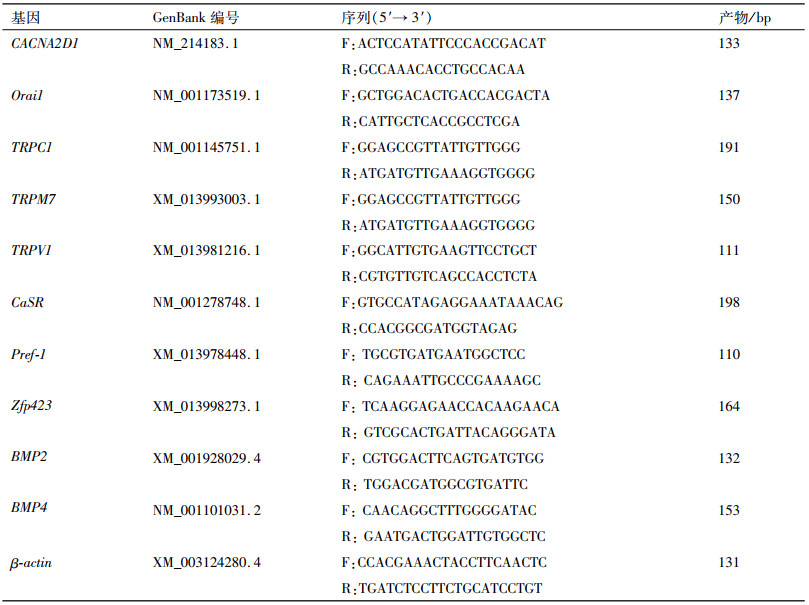
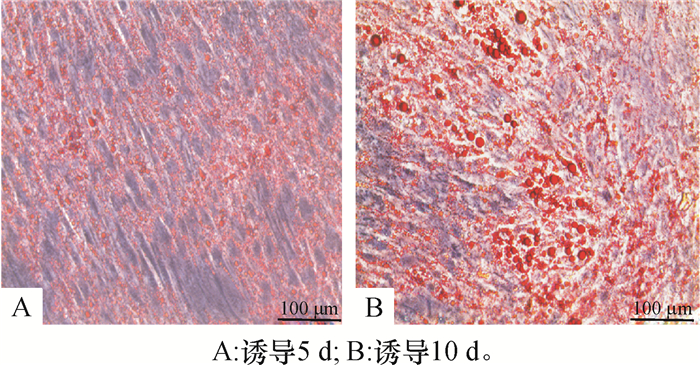
2 结果与分析 2.1 猪BMSCs的成脂分化将猪BMSCs分别进行成脂诱导5、10 d,用油红O和三酰甘油试剂盒检测细胞聚酯情况。由油红O染色结果可知,猪BMSCs第5天开始出现小脂滴,第10天细胞成脂十分明显(图 1);同时三酰甘油检测结果显示,猪BMSCs成脂分化10 d细胞内三酰甘油的质量摩尔浓度显著高于成脂分化5 d(P < 0.001)(图 2),以上结果表明猪BMSCs被成功诱导分化为成熟的脂肪细胞。
|
图 1 猪BMSCs成脂分化过程中油红O染色结果 Figure 1 The oil red O staining result of porcine BMSCs during the adipogenic differentiation |
|
图 2 猪BMSCs成脂分化过程中三酰甘油(TG)质量摩尔浓度的变化 Figure 2 Triacylglycerol(TG) assay of porcine BMSCs during the adipogenic differentiation 图中数据为平均值±标准误,***表示差异极显著(独立样本t检验分析,P < 0.001)。 |
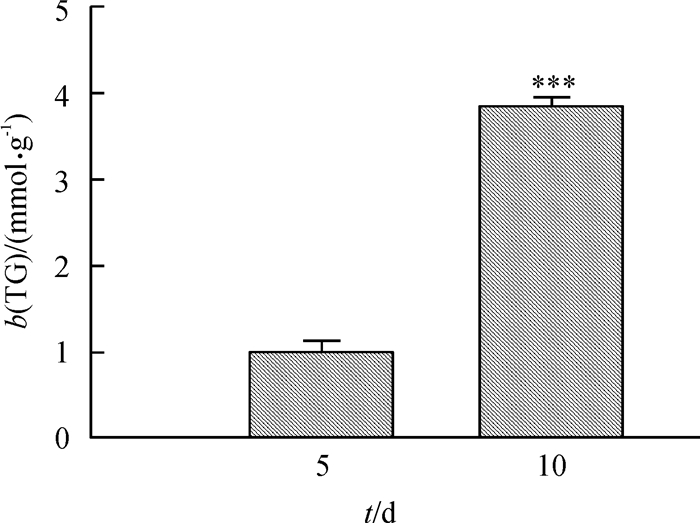
L-型电压门控钙离子通道亚基CACNA2D1基因mRNA相对表达量在猪BMSCs成脂分化前5 d逐渐升高,在第5天达到最高,并显著高于(P < 0.05)其他时间的相对表达量,第10天相对表达量最低(图 3A)。钙库调控的钙通道Orai1基因mRNA表达趋势与CACNA2D1基因类似,第5天相对表达量显著高于(P < 0.05)其他时间(图 3B)。瞬时受体电位离子通道TRPC1基因mRNA相对表达量在成脂分化的第2、5天显著高于(P < 0.05)其他时间(图 3C);TRPM7基因在第5天的mRNA相对表达量显著高于(P < 0.05)其他时间,第10天mRNA相对表达量显著低于(P < 0.05)其他时间(图 3D);TRPV1基因在第2天的mRNA相对表达量显著高于(P < 0.05)其他时间,同时第5天的相对表达量也显著高于(P < 0.05)第0、1、10天(图 3E);钙敏感受体CaSR基因在成脂分化第5天的mRNA相对表达量极显著高于(P < 0.01)其他时间(图 3F)。综上所述,细胞膜上的钙离子通道及CaSR基因mRNA表达都在猪BMSCs成脂分化的第2、5天时有明显提高。
|
图 3 猪BMSCs成脂分化过程中细胞膜钙离子通道(A-E)与CaSR(F)基因的mRNA表达模式 Figure 3 The mRNA expression patterns of calcium channel and CaSR genes in plasma membrane during the adipogenic differentiation of porcine BMSCs 图中数据为平均值±标准误,同一分图中不同诱导时间的柱上凡是有一个相同小写字母者,表示差异不显著(单因素方差分析,P > 0.05)。 |
在猪BMSCs成脂分化过程中,脂肪前体细胞标志基因Pref-1的mRNA相对表达量在分化第5天最高,显著高于(P < 0.05)其他时间的mRNA相对表达量。此外,第6天的mRNA相对表达量也显著高于(P < 0.05)第0、1、2、8、10天的mRNA相对表达量(图 4A)。成脂定向标志基因Zfp423在成脂分化第2、5天的mRNA相对表达量显著高于(P < 0.05)其他时间的mRNA相对表达量(图 4B);成脂定向关键细胞因子BMP2和BMP4基因在成脂分化第5天的mRNA相对表达量最高,且显著高于(P < 0.05)其他时间的mRNA相对表达量(图 4C、4D)。
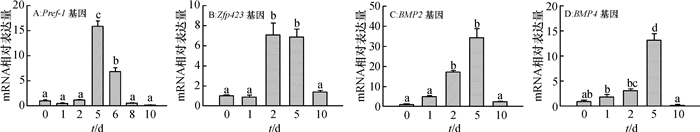
|
图 4 猪BMSCs成脂分化中成脂定向相关基因的mRNA表达模式 Figure 4 The mRNA expression patterns of adipogenic determination genes during the adipogenic differentiation of porcine BMSCs 图中数据为平均值±标准误,同一分图中不同诱导时间柱上凡是有一个相同小写字母者,表示差异不显著(单因素方差分析,P > 0.05)。 |
间充质干细胞(MSCs)成脂分化一般包括MSCs成脂定向形成脂肪前体细胞以及脂肪前体细胞终末分化为成熟脂肪细胞2个阶段[2]。本试验中,油红O染色结果和三酰甘油检测结果显示,在成脂分化中期(第5天)和末期(第10天)有脂滴形成,且末期细胞聚酯含量显著高于中期,说明当前诱导体系可成功诱导猪BMSCs成脂分化形成脂肪细胞,可进行后续的相关研究。
为进一步研究猪BMSCs成脂分化的不同阶段,我们又进一步研究了成脂定向相关基因的表达,间充质干细胞的成脂定向分化受到一系列关键因子的调控[13]。其中,Zfp423基因对于间充质干细胞定向形成脂肪前体细胞起关键的决定作用[13-14],本试验中发现Zfp423基因在猪BMSCs成脂分化第2、5天时表达量最高,提示在当前成脂诱导体系中,第2~5天是成脂定向的关键阶段;同时,大量研究发现成脂定向关键因子BMP2和BMP4可诱导间充质干细胞系C3H10T1/2、脂肪前体细胞系3T3-L1以及猪原代脂肪前体细胞分化为脂肪细胞[6, 15-17]。本试验结果显示猪BMSCs成脂分化第5天时,BMP2和BMP4基因mRNA相对表达量极显著高于其他时间的相对表达量,提示其在该时间对成脂定向具有一定作用;此外,研究表明Pref-1基因作为脂肪前体细胞标志基因在脂肪前体细胞中高度表达,在成熟脂肪细胞中表达量降低[4],我们的结果也发现Pref-1基因mRNA在第5天的表达水平最高,在第10天的表达水平很低,说明分化第5天时猪BMSCs已成脂定向分化为脂肪前体细胞。以上结果表明,猪BMSCs成脂分化第5天是研究其成脂定向和终末分化的关键节点,为进一步深入研究其成脂定向和终末分化的机制提供了前期基础。
本试验中,猪BMSCs成脂分化过程中细胞膜钙离子通道和CaSR基因的mRNA表达变化显示,在成脂分化第5天时,细胞膜钙离子通道及CaSR基因的表达量较高,这与成脂定向相关基因的表达变化趋势一致,提示细胞膜钙离子通道和CaSR基因可能参与了猪BMSCs的成脂定向。Sun等[18]发现,阻断L-型电压门控钙离子通道可促进小鼠原代脂肪前体细胞分化聚酯,提示L-型电压门控钙离子通道在脂肪前体细胞分化中起着重要作用。本试验中L-型电压门控钙离子通道亚基CACNA2D1基因在成脂分化第5天时的高表达提示其可能参与了猪BMSCs成脂分化过程。研究发现,在人脂肪前体细胞中TRPC1、Orai1基因均有表达,且在人脂肪前体细胞成脂分化中起着重要的调控作用[19],本试验中猪BMSCs成脂分化第5天时TRPC1、Orai1基因的mRNA表达量均显著提高,提示其可能也参与了猪BMSCs的成脂分化。Joo等[20]发现TRPV1基因在3T3-L1脂肪前体细胞有表达,可调控脂肪前体细胞的分化,本试验中TRPV1基因mRNA在第2、5天的高表达,提示其可能在猪BMSCs成脂分化过程中起着重要作用。此外,有文章表明,TRPM7基因在3T3-L1脂肪前体细胞中表达量很高且可促进3T3-L1脂肪前体细胞的增殖和分化[21],本试验中TRPM7基因的mRNA在猪BMSCs成脂分化中的表达变化也提示其可能发挥着潜在的重要作用。本试验中发现CaSR基因在猪BMSCs成脂分化前5 d表达量逐渐增加,与我们结果类似的是,人SW872细胞系诱导成脂肪细胞时CaSR基因的表达量也逐渐增加[22]。以上结果提示,细胞膜钙离子通道和CaSR基因在成脂分化过程中的差异表达可能参与了猪BMSCs成脂分化的调节,其具体作用和机制有待进一步深入研究。
综上所述,在猪BMSCs成脂分化第5天,成脂定向相关基因(Zfp423、Pref-1、BMP2和BMP4)和细胞膜钙离子通道(CACNA2D1、Orai1、TRPC1、TRPM7和TRPV1)以及CaSR基因的mRNA相对表达量显著提高,说明了第5天是猪BMSCs成脂定向形成脂肪前体细胞的关键时期,而细胞膜钙离子通道及CaSR基因可能参与了这一过程的调控。以上结果揭示了猪BMSCs分化成脂过程中细胞膜钙离子通道、钙敏感受体及成脂定向相关基因的表达模式,为后续研究钙信号调控猪BMSCs成脂分化的分子机制提供了前期基础。
| [1] |
DU M, HUANG Y, DAS A K, et al. Meat science and muscle biology symposium: Manipulating mesenchymal progenitor cell differentiation to optimize performance and carcass value of beef cattle[J]. J Anim Sci, 2013, 91(3): 1419-1427. DOI:10.2527/jas.2012-5670 (  0) 0) |
| [2] |
TANG Q Q, LANE M D. Adipogenesis: From stem cell to adipocyte[J]. Annu Rev Biochem, 2012, 81: 715-736. DOI:10.1146/annurev-biochem-052110-115718 (  0) 0) |
| [3] |
WEI S J, ZHANG L F, ZHOU X, et al. Emerging roles of zinc finger proteins in regulating adipogenesis[J]. Cell Mol Life Sci, 2013, 70(23): 4569-4584. DOI:10.1007/s00018-013-1395-0 (  0) 0) |
| [4] |
GESTA S, TSENG Y H, KAHN C R. Developmental origin of fat: Tracking obesity to its source[J]. Cell, 2007, 131(2): 242-256. DOI:10.1016/j.cell.2007.10.004 (  0) 0) |
| [5] |
王松波, 束刚, 朱晓彤, 等. 骨形态发生蛋白在脂肪生成中的作用[J]. 中国生物化学与分子生物学报, 2009, 25(11): 997-1002. (  0) 0) |
| [6] |
WANG S, ZHOU G, SHU G, et al. Glucose utilization, lipid metabolism and BMP-Smad signaling pathway of porcine intramuscular preadipocytes compared with subcutaneous preadipocytes[J]. Cell Physiol Biochem, 2013, 31(6): 981-996. DOI:10.1159/000350116 (  0) 0) |
| [7] |
BRINI M, CALI T, OTTOLINI D, et al. Intracellular calcium homeostasis and signaling[J]. Met Ions Life Sci, 2013, 12: 119-168. DOI:10.1007/978-94-007-5561-1 (  0) 0) |
| [8] |
BISHNOI M, KONDEPUDI K K, BABOOTA R K, et al. Role of transient receptor potential channels in adipocyte biology[J]. Expert Rev Endocrinol Metabol, 2013, 8(2): 173-182. DOI:10.1586/eem.13.4 (  0) 0) |
| [9] |
GRAHAM S J, BLACK M J, SOBOLOFF J, et al. Stim1, an endoplasmic reticulum Ca2+ sensor, negatively regulates 3T3-L1 preadipocyte differentiation[J]. Differentiation, 2009, 77(3): 239-247. DOI:10.1016/j.diff.2008.10.013 (  0) 0) |
| [10] |
CHEN K H, XU X H, LIU Y, et al. TRPM7 channels regulate proliferation and adipogenesis in 3T3-L1 preadipocytes[J]. J Cell Physiol, 2014, 229(1): 60-67. (  0) 0) |
| [11] |
VILLARROEL P, REYES M, FUENTES C, et al. Adipogenic effect of calcium sensing receptor activation[J]. Mol Cell Biochem, 2013, 384(1/2): 139-145. (  0) 0) |
| [12] |
DU M Q, HUANG Y Q, LU N S, et al. Characterization and differentiation into adipocytes and myocytes of porcine bone marrow mesenchymal stem cells[J]. J Integr Agr, 2014, 13(4): 837-848. DOI:10.1016/S2095-3119(13)60497-9 (  0) 0) |
| [13] |
CHEN M H, TONG Q. An update on the regulation of adipogenesis[J]. Drug Discov Today, 2013, 10(1/2): e15-e19. (  0) 0) |
| [14] |
GUPTA R K, ARANY Z, SEALE P, et al. Transcriptional control of preadipocyte determination by Zfp423[J]. Nature, 2010, 464(7288): 619-623. DOI:10.1038/nature08816 (  0) 0) |
| [15] |
谢在春, 陈琼玉, 杨松海, 等. BMP2具有诱导C3H10T1/2细胞成脂肪分化的能力[J]. 中国生物化学与分子生物学报, 2008, 24(2): 142-147. DOI:10.3969/j.issn.1007-7626.2008.02.010 (  0) 0) |
| [16] |
HUANG H, SONG T J, LI X, et al. BMP signaling pathway is required for commitment of C3H10T12 pluripotent stem cells to the adipocyte lineage[J]. Proc Natl Acad Sci USA, 2009, 106(31): 12670-12675. DOI:10.1073/pnas.0906266106 (  0) 0) |
| [17] |
HAMMARSTEDT A, HEDJAZIFAR S, JENNDAHL L, et al. WISP2 regulates preadipocyte commitment and PPAR gamma activation by BMP4[J]. Proc Natl Acad Sci USA, 2013, 110(7): 2563-2568. DOI:10.1073/pnas.1211255110 (  0) 0) |
| [18] |
SUN C, QI R, WANG L, et al. p38 MAPK regulates calcium signal-mediated lipid accumulation through changing VDR expression in primary preadipocytes of mice[J]. Mol Biol Rep, 2012, 39(3): 3179-3184. DOI:10.1007/s11033-011-1084-8 (  0) 0) |
| [19] |
HU R, HE M L, HU H, et al. Characterization of calcium signaling pathways in human preadipocytes[J]. J Cell Physiol, 2009, 220(3): 765-770. DOI:10.1002/jcp.v220:3 (  0) 0) |
| [20] |
JOO J I, KIM D H, CHOI J W, et al. Proteomic analysis for antiobesity potential of capsaicin on white adipose tissue in rats fed with a high fat diet[J]. J Proteome Res, 2010, 9(6): 2977-2987. DOI:10.1021/pr901175w (  0) 0) |
| [21] |
CHEN K H, XU X H, LIU Y, et al. TRPM7 channels regulate proliferation and adipogenesis in 3t3-l1 preadipocytes[J]. J Cell Physiol, 2014, 229(1): 60-67. (  0) 0) |
| [22] |
HE Y H, HE Y, LIAO X L, et al. The calcium-sensing receptor promotes adipocyte differentiation and adipogenesis through PPAR gamma pathway[J]. Mol Cell Biochem, 2012, 361(1/2): 321-328. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37