玉米Zea may L.是我国重要的粮食作物,在粮食、饲料、工业、能源等方面都有着重要的应用[1]。据统计,到2020年我国将实现粮食增产500亿kg, 其中玉米增产占53%[2]。提高玉米产量对于我国粮食安全及经济发展具有重要战略意义。
亚洲玉米螟Ostrinia furnacalis是鳞翅目螟蛾科昆虫,是影响我国玉米生产的主要害虫。玉米螟咬食玉米茎、叶、穗等,对玉米的产量及品质产生直接影响,其危害贯穿玉米生产的各个阶段,造成玉米减产20%~30%[3]。转Bt基因的玉米,通过表达cry1Ab、cry1Ac、cry1Ie等杀虫晶体蛋白,从而产生对玉米螟等害虫的抗性[4-5]。1990年科学家首次利用转基因技术获得转Bt基因的玉米植株[6-7],近年来我国在抗虫转基因玉米的研究方面也取得了诸多成果[8-9]。cry1Ab是抗虫转基因玉米研发过程中的重要基因,是应用得最多且应用最成熟的抗虫基因。据ISAAA 2016年统计数据显示,世界各国已批准允许作为食物及饲料的抗虫转基因玉米有115个,其中有52个是含有cry1Ab基因的转基因玉米;BT11、BT176、MON810等转cry1Ab基因玉米自交系作为第1批抗虫转基因玉米材料在抗虫转基因玉米育种上具有广泛的应用并取得了显著的效果;近年来,有关转基因玉米食用安全性评价的研究报道不断出现,众多研究一致表明,其食用安全性及营养特性与非转基因玉米相比无显著差异[10-12]。因此,利用cry1Ab基因进行抗虫转基因玉米的研发在经验及理论上具有独特的优势,为加快我国抗虫转基因玉米的研发进程,有必要深入研究克隆得到的不同种cry1Ab基因。cry1Ab13基因是由中国农业科学院植物保护研究所病虫害生物学国家重点实验室从苏云金芽孢杆菌Bacillus thuringiensis(Bt)BtC005中克隆得到的抗虫基因,其编码的杀虫晶体蛋白对鳞翅目昆虫具有高效杀虫活性[13]。本研究利用分子生物学技术将cry1Ab13基因连接到含有Bar基因的植物表达载体pCAMBIA3300上,并利用农杆菌介导法将其导入玉米自交系H99中,通过除草剂筛选、PCR检测及抗虫性鉴定,以获得抗玉米螟的转基因玉米植株,为抗虫转基因玉米品种的种质创制提供材料。
1 材料与方法 1.1 供试材料与试剂含pUC57-cry1Ab13质粒菌株及植物表达载体pCAMBIA3300-Bar由吉林省农业科学院提供。基因受体玉米自交系H99幼胚、大肠埃希菌Escherichia coli菌株DH5α、农杆菌Agrobacterium菌株EHA105均由吉林农业大学植物生物技术中心提供。亚洲玉米螟幼虫由吉林农业大学农业综合技术现代化研究所提供。构建表达载体所用ClonExpress MultiS One Step Cloning Kit试剂盒购自Vazyme公司。玉米基因组提取试剂盒购自康为世纪公司。试验所用培养基:LB、YEP、诱导、侵染、共培养、筛选、分化和生根培养基均参照关淑艳等[14]方法。
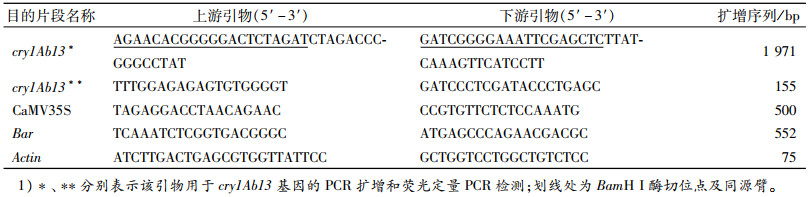
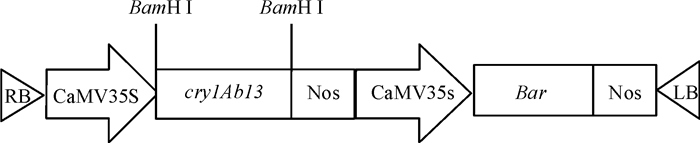
1.2 重组植物表达载体的构建提取pUC57-cry1Ab13质粒及pCAMBIA3300-Bar质粒,以CaMV35S启动子下游BamH I识别位点作为cry1Ab13基因插入位点,根据ClonExpress MultiS One Step Cloning Kit所提供的Clon Express快速克隆技术要求对载体及目的片段进行分析,设计特异性引物(表 1)。以pUC57-cry1Ab13质粒为模板PCR扩增cry1Ab13基因,回收目的基因片段(1 971 bp)和BamH I酶切pCAMBIA3300-Bar质粒所得的线性化载体,根据ClonExpress MultiS One Step Cloning Kit说明书进行操作,同源重组反应得到重组植物表达载体pCAMBIA3300-CaMV35S-cry1Ab13-Nos-CaMV35S-Bar-Nos(图 1)。
|
|
表 1 引物信息1) Table 1 Primer information |
|
图 1 重组植物表达载体T-DNA区结构图 Figure 1 T-DNA region of plant recombinant expression vector |
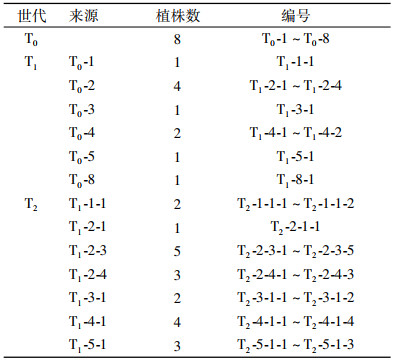
玉米自交系H99自交授粉11 d后挑取幼胚用作工程菌侵染宿主, 玉米幼胚挑取见郭新梅等[15]的方法。农杆菌介导玉米幼胚的遗传转化及转化后玉米组织培养再生植株,参见刘强等[16]的方法。
1.4 转基因植株的分子检测 1.4.1 转基因玉米植株的PCR检测对6叶期玉米叶片涂抹3倍正常工作浓度草胺膦溶液逐代进行抗除草剂转基因植株筛选,提取对草胺膦表现抗性的植株基因组DNA,方法见康为世纪公司植物基因组DNA提取试剂盒说明书。以玉米转基因植株基因组DNA为模板,分别以非转基因植株基因组DNA和重组植物表达载体质粒为对照(CK)和阳性对照,利用表 1所示特异性引物对cry1Ab13基因、CaMV35S启动子、Bar基因分别进行扩增。PCR程序为94 ℃预变性5 min;94 ℃变性57 s,退火温度分别为56 ℃、50 ℃、55 ℃,反应57 s,72 ℃延伸70 s,30个循环;72 ℃后延伸10 min;经PCR检测呈阳性的转基因植株进行套袋自交,以同样的方法进行逐代筛选。
1.4.2 转基因玉米植株的Southern blotting检测利用CTAB法大量提取T2代PCR检测为阳性和非转基因植株5~6叶期心叶基因组,利用HindⅢ对基因组DNA进行充分单酶切过夜,扩增cry1Ab13基因并纯化目的片段用于制备杂交探针,利用随机引物法根据Roche公司的DIG High Prime DNA Labeling and Detection Starter Kit I说明书进行探针标记,用10 g·L-1的琼脂糖凝胶对基因组酶切片段进行分离,转膜、固定、杂交等具体操作步骤及所用试剂配制参照文献[17]。
1.4.3 转基因玉米植株的实时荧光定量PCR检测以非转基因植株为对照,分别提取非转基因植株和Southern杂交检测为阳性的T2转基因植株6叶期心叶总RNA,并反转录成cDNA作为PCR扩增模板,以引物(表 1)扩增cry1Ab13,以肌动蛋白Actin基因(GenBank登录号:NM_001252731.2)作为内参基因同时进行PCR扩增。扩增条件为:95 ℃预变性3 min;95 ℃变性20 s,56 ℃反应30 s,共40次循环。利用SYBR Green染料标记的实时荧光定量PCR对来自不同转化事件的转基因植株cry1Ab13基因的相对表达量进行分析(SYBR Premix Ex TaqTM试剂盒购自TaKaRa公司)。每个样本设置3次生物学重复,并进行3次技术重复。
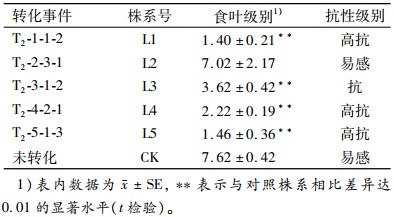
1.5 转基因玉米植株的抗虫性鉴定 1.5.1 转基因植株的田间抗虫性鉴定将T2代转基因种子与H99自交系种子(对照)播种于大田,并对转基因群体材料进行筛选,选取筛选到的阳性植株进行接虫试验。于植株6~8叶期时,将初孵玉米螟幼虫于清晨湿度较高时接于玉米心叶中,每株植株接虫30头,14 d后调查食叶级别,抗虫性评价标准参照文献[18],1~3级:虫孔针刺状;4~6级:虫孔火柴头大小;7~9级:虫孔大于火柴头。抗性级别分类: 1.00~2.09级(高抗),2.10~ 4.09级(抗虫),4.10~6.09级(中抗),6.10~8.09级(感虫),8.10~9.00级(高感)。
1.5.2 转基因植株的苗期室内抗虫性鉴定将经Southern检测阳性的植株收获的转基因种子与非转基因植株种子(对照)按株系分别种于塑料盆内,每盆15粒,经除草剂筛选及PCR检测后去除阴性及多余植株,每盆保留5株转基因阳性植株。待植株长至5~6叶期时进行接虫,每株植株接25头初孵玉米螟幼虫于心叶中,置于人工气候室培养,接虫14 d后调查玉米虫害级别,逐株调查,以5株的均值作为该株系的抗虫级别,抗虫性鉴定标准同“1.5.1”。
1.5.3 转基因植株籽粒及苞叶抗虫性鉴定取Southern blotting检测阳性的转基因玉米授粉后13 d的籽粒和最内层苞叶分别饲喂玉米螟幼虫,以非转基因玉米材料作为对照。将等量的籽粒和苞叶分别置于培养皿内,每个培养皿内接10头初孵玉米螟幼虫,置于人工气候室培养。每株设3次重复,每天检查玉米螟取食和存活情况,及时更换同1株的籽粒及苞叶,分别在第4、8、12天统计玉米螟死亡率。
2 结果与分析 2.1 重组植物表达载体的鉴定提取重组表达载体质粒,利用cry1Ab13基因特异性引物进行目的基因扩增,得到特异性扩增产物,大小与目的基因cry1Ab13(1 971bp)大小一致(图 2)。重组质粒经BamHⅠ单酶切,可得到2个大小不等片段,大片段长度与线性化pCAMBIA3300-Bar长度一致,小片段与cry1Ab13基因大小一致。进一步对重组质粒中的插入片段进行测序,测序结果与目的基因cry1Ab13相似性达100%。综上可以证明cry1Ab13基因已经成功连接到pCAMBIA3300-Bar插入位点处,表达载体pCAMBIA3300-cry1Ab13-Bar构建成功。
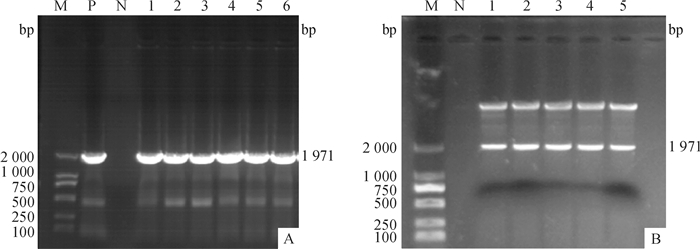
|
图 2 重组植物表达载体pCAMBIA3300-cry1Ab13-Bar的PCR(A)与酶切验证(B) Figure 2 Verification of the recombinant vector pCAMBIA3300-cry1Ab13-Bar using PCR(A) and digestion(B) M:DNA marker DL 2000;P:阳性对照;N:阴性对照;1~6:重组质粒。 |
利用农杆菌介导法将pCAMBIA3300-cry1Ab13-Bar导入玉米幼胚,经过筛选培养、分化和生根共获得50株再生苗,将50株三叶期再生幼苗室内移栽到土壤,共有30株幼苗成活。
2.3 转基因植株的分子鉴定 2.3.1 转基因植株的PCR检测结果提取抗除草剂转基因植株基因组DNA,分别对cry1Ab13基因、CaMV35S启动子及Bar基因进行特异性PCR扩增,扩增产物进行10 g·L-1的琼脂糖凝胶检测,筛选具有以上3种基因条带的T1代和T2代转基因植株如图 3、4所示,筛选到的转基因阳性植株按株系逐代编号,结果见表 2。
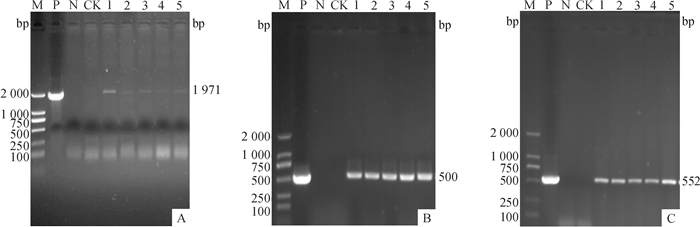
|
图 3 部分T1代转基因玉米PCR检测结果 Figure 3 PCR detection of some T1 generation transgenic maize M:DNA marker DL 2000;P:阳性对照;N:阴性对照;CK:非转基因植株;1~5:转基因植株; A、B、C分别为对cry1Ab13基因、CaMV35S启动子及Bar基因的扩增结果。 |
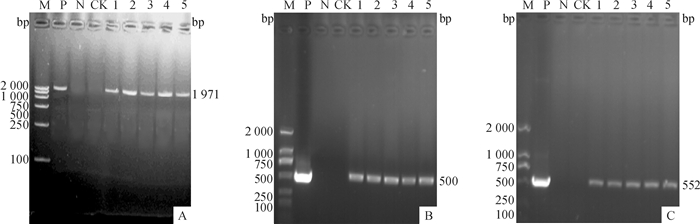
|
图 4 部分T2代转基因玉米PCR检测结果 Figure 4 PCR detection of some T2 generation transgenic maize M:DNA marker DL 2000;P:阳性对照;N:阴性对照;CK:非转基因植株;1~5:转基因植株; A、B、C分别为对cry1Ab13基因、CaMV35S启动子及Bar基因的扩增结果。 |
|
|
表 2 PCR检测阳性玉米植株 Table 2 PCR-positive maize plants |
选取T2代植株PCR检测结果为阳性的植株进行Southern blotting检测,以cry1Ab13基因扩增片段作为阳性对照,非转基因植株DNA作为阴性对照,20株PCR阳性植株中有5株经Southern杂交出现明显杂交信号(图 5),其中T2-2-3-1为3拷贝,其余均为单拷贝,非转基因植株无明显杂交信号出现,并且不同植株的杂交条带位置存在差异。证明外源基因cry1Ab13已整合到了玉米基因组中,并且随机整合到了玉米基因组的不同位置。
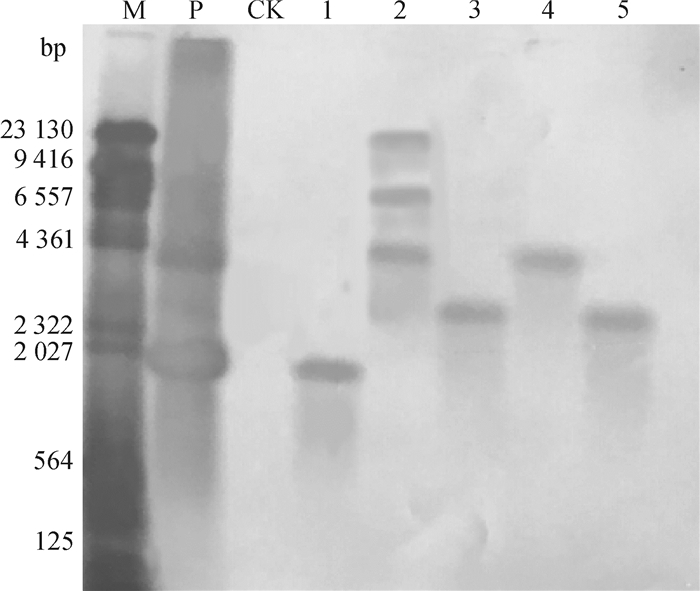
|
图 5 T2代转基因玉米cry1Ab13基因的Southern杂交检测 Figure 5 Southern blotting detection of cry1Ab13gene in T2 transgenic maize M:λHind Ⅲ DNA marker;P:阳性对照;CK:非转基因植株;1~5分别为转基因植株T2-1-1-2、T2-2-3-1、T2-3-1-2、T2-4-2-1和T2-5-1-3。 |
实时荧光定量PCR结果显示, 溶解曲线均有单峰出现,表明反应特异性较好,无引物二聚体及非特异性产物的干扰;扩增曲线光滑平稳,荧光吸收图谱S型曲线性状完好,符合定量检测要求。各株内参基因Ct值在19~20之间,目的基因Ct值在25~34之间,不同植株cry1Ab13基因的Ct值具有明显的差异,且植株T2-2-3-1内参基因Ct=19.34,cry1Ab13基因在设定的40个循环内未检测到Ct值,说明外源基因在不同转基因事件中表达量具有明显差异,转基因植株T2-2-3-1中cry1Ab13基因未表达。各植株中cry1Ab13基因相对表达量见图 6。
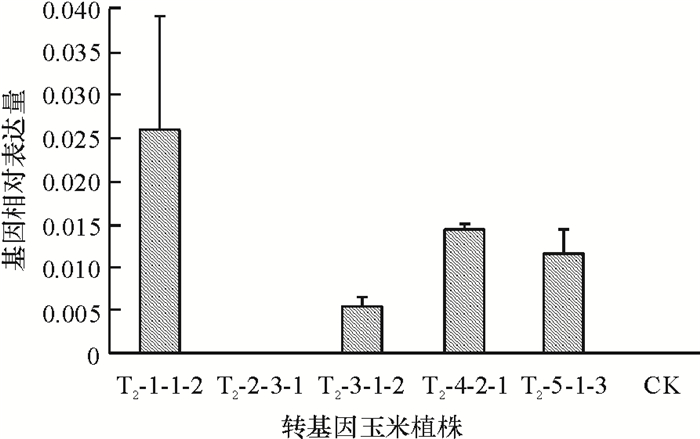
|
图 6 转基因玉米中cry1Ab13基因相对表达量 Figure 6 Relative expression of cry1Ab13gene in transgenic maize 基因相对表达量用2-ΔCT表示, 其中ΔCT=Ct cry1Ab13 -Ct Actin;CK:非转基因植株;图中所示数据为x±SE,n=9。 |
T2代转基因植株的田间接虫试验表明,PCR阳性T2代转基因植株对亚洲玉米螟具有较强的抗性(图 7A),接虫14 d后植株生长良好,心叶大多表现为未受虫害或仅有少量针状虫孔,而非转基因的对照组则受虫害严重(图 7B),心叶及外部叶片均有大量较大虫孔,对玉米螟表现为高度敏感性,但也有个别PCR阳性植株抗虫性较差, 与对照组无显著差异。

|
图 7 转基因玉米植株田间抗虫性鉴定 Figure 7 Evaluation of resistance of transgenic maize plants to Ostrinia furnacalis in the field A:转基因植株;B:非转基因植株。 |
为更准确地鉴定转基因植株的抗虫性,将Southern杂交阳性植株自交后代于室内按株系(编号L1~L5)种植,接虫试验结果表明,各Southern blotting阳性植株后代株系对玉米螟抗性表现不同,L1、L5植株的心叶有少量针刺状(直径≤1 mm)虫孔;L4的虫孔为针刺状,数量稍多于L1与L5;L3的心叶上有大量的针刺状虫孔;L2的心叶上有少量直径大于2 mm的虫孔;对照株系心叶上的虫孔稍多于L2,虫孔的直径也大于2 mm。逐株统计各株系的抗虫级别,对相同接虫处理条件下的转基因株系与对照株系抗虫性差异显著性进行t检验,检验结果(表 3)与试验观测结果相符,L1、L4、L5达到高抗水平,L3达到3级抗性水平,转化事件T2-2-3-1后代株系L2对玉米螟抗性较差,与对照组无显著差异(P > 0.05)。
|
|
表 3 室内转基因玉米株系苗期对玉米螟的抗性级别 Table 3 The resistant levels of transgenic maize lines to Ostrinia furnacalis at seeding stage indoor |
分别在饲喂转基因玉米籽粒及苞叶4、8、12 d后统计3次重复试验各组玉米螟死亡率,并对各组结果与非转基因的对照组结果进行独立样本t检验,结果见图 8。除植株T2-2-3-1的籽粒及苞叶对玉米螟的抗性较差,与对照组无显著差异外,转基因植株对玉米螟的抗性明显高于非转基因对照株。转cry1Ab13基因的试验组玉米螟幼虫生长缓慢,随饲喂时间增加死亡率不断提高,喂食8 d后试验组玉米螟死亡率达到80%左右,而非转基因的对照组玉米螟幼虫生长速度快,死亡率低,饲喂8 d后死亡率只有10%左右。不同转基因植株对玉米螟的抗性表现也不同,各转基因植株对玉米螟的相对抗性水平与实时荧光定量PCR检测到cry1Ab13基因相对表达量基本一致。
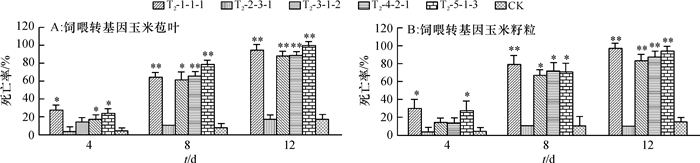
|
图 8 饲喂转基因玉米籽粒及苞叶对玉米螟死亡率的影响 Figure 8 Effects of feeding transgenic corn kernels or bracts of ears on the mortality rate of Ostrinia furnacalis 图中数据为x±SE,n=3;*和**分别代表相同处理时间的转基因植株与非转基因植株(CK)的玉米螟死亡率达到0.05和0.01的显著差异水平(t检验)。 |
1995年Armstrong等[19]的研究证明cry1Ab毒蛋白的结构赋予其对小菜蛾Plutella xylostella、烟草天蛾Manduca sexta等较强的杀虫活性。随后国内外许多研究人员将cry1Ab 基因导入玉米,并证明表达cry1Ab蛋白的转基因玉米对亚洲玉米螟O. furnacalis及欧洲玉米螟O. nubilalis都有很好的田间抗性,能高效控制心叶期及穗期玉米螟的危害。本研究在檀建新等[13]的研究基础上,利用同源重组的方法将抗虫基因cry1Ab13 连接到含有抗除草剂草胺膦的Bar基因的植物表达载体上,遗传转化玉米得到5株稳定遗传至T2代的转基因植株,cry1Ab13基因在玉米中的表达赋予转基因植株抗玉米螟的特性。外源基因稳定高效的表达是转基因工作的重要目标,王忠华等[20]的研究表明,cry1Ab 基因水稻转化植株经4~5次自交后,目的基因仍能稳定遗传且呈单位点显性方式遗传。本研究通过Southern杂交、实时荧光定量PCR技术对cry1Ab13基因在植株中的整合及表达情况进行分析。试验结果表明除转基因事件T2-2-3-1外其余各转基因植株中cry1Ab13均为单拷贝形式整合在基因组中,且成功转录表达,但各单株间相对表达水平存在一定的差异。而转基因事件T2-2-3-1中cry1Ab13基因以3拷贝形式存在,且表达受到抑制,转录水平与非转基因植株无显著差异,分析原因可能是由于cry1Ab13基因的多拷贝整合或位置效应引起的转录水平的基因沉默[21]。岳同卿等[22]的抗虫转基因玉米的研究结果显示,不同转化事件的抗虫效果存在一定的差异,本研究得出同样的结论。Day等[23]指出外源基因在基因组内的整合位置不同可以导致基因表达水平不同,为解释上述现象提供了理论参考。转基因植株田间及室内对玉米螟抗性评价结果表明,转入cry1Ab13基因能够显著提高植株对玉米螟的抗性,本试验中转cry1Ab13基因玉米的杀虫效果与cry1Ab13基因的表达水平基本一致,与王培等[24]研究结果相符,但也有研究表明转基因作物Bt蛋白表达量与杀虫效果并不一致[25-26]。
本研究构建了植物表达载体pCAMBIA3300-cry1Ab13-Bar,并通过农杆菌介导法将其导入玉米自交系H99,获得了4株抗玉米螟及抗除草剂的T2代转基因植株。下一步将通过优化植物重组表达载体中的表达调控元件来提高转基因植株的抗虫效果,并继续进行转基因株系的自交扩繁及严格的筛选鉴定,为抗虫玉米新品种的研发提供材料。
| [1] |
李少昆, 王崇桃. 玉米高产潜力途径[M]. 北京: 科学出版社, 2010.
(  0) 0) |
| [2] |
赵久然, 王荣焕. 中国玉米生产发展历程、存在问题及对策[J]. 中国农业科技导报, 2013, 15(3): 1-6. DOI:10.3969/j.issn.1008-0864.2013.03.01 (  0) 0) |
| [3] |
NICOLAS J A, TAMAYO N V, CAOILI B L, et al. Improving the yield of glutinous white corn by distance of planting and use of biocontrol agents for management of Asian corn borer, Ostrinia furnacalis Guenee[C]//Recent advances in biofertilizers and biofungicides (PGPR) for sustainable agriculture. Proceedings of 3rd Asian Conference on Plant Growth-Promoting Rhizobacteria (PGPR) and other Microbials, Manila, Philippines, 21-24 April, 2013. Manila, Philippines: Asian PGPR Society for Sustainable Agriculture, 2013: 50-74.
(  0) 0) |
| [4] |
HE K, WANG Z, ZHOU D, et al. Evaluation of transgenic Bt corn for resistance to the Asian corn borer (Lepidoptera: Pyralidae)[J]. J Econ Entomol, 2003, 96(3): 935-940. DOI:10.1093/jee/96.3.935 (  0) 0) |
| [5] |
王月琴, 何康来, 江帆, 等. BT799玉米对亚洲玉米螟抗性研究[J]. 应用昆虫学报, 2014, 51(3): 636-642. (  0) 0) |
| [6] |
FROMM M E, MORRISH F, ARMSTRONG C, et al. Inheritance and expression of chimeric genes in the progeny of transgenic maize plants[J]. Nat Biotechnol, 1990, 8(9): 833-839. DOI:10.1038/nbt0990-833 (  0) 0) |
| [7] |
GORDON-KAMM W J, SPENCER T M, MANGANO M L, et al. Transformation of maize cells and regeneration of fertile transgenic plants[J]. Plant Cell, 1990, 2(7): 603-618. DOI:10.1105/tpc.2.7.603 (  0) 0) |
| [8] |
郝曜山, 孙毅, 杜建中, 等. 转双价抗虫基因BmkIT-Chitinase玉米株系的获得[J]. 分子植物育种, 2012, 10(2): 147-154. DOI:10.3969/mpb.010.000147 (  0) 0) |
| [9] |
李桂玲, 李明泽, 刘宗华, 等. 转Bt基因抗虫玉米的研究[J]. 生物技术通报, 2009(5): 9-13. (  0) 0) |
| [10] |
SHIMADA N, MURATA H, MIKAMI O, et al. Effects of feeding calves genetically modified corn Bt11: A clinico-biochemical study[J]. J Vet Med Sci, 2006, 68(10): 1113-1115. DOI:10.1292/jvms.68.1113 (  0) 0) |
| [11] |
TRABALZA-MARINUCCI M, BRANDI G, RONDINI C, et al. A three-year longitudinal study on the effects of a diet containing genetically modified Bt176 maize on the health status and performance of sheep[J]. Livest Sci, 2008, 113(2): 178-190. (  0) 0) |
| [12] |
BUZOIANU S G, WALSH M C, REA M C, et al. Effect of feeding genetically modified Bt MON810 maize to 40-day-old pigs for 110 days on growth and health indicators[J]. Animal, 2012, 6(10): 1609-1619. DOI:10.1017/S1751731112000249 (  0) 0) |
| [13] |
檀建新, 张杰, 宋福平, 等. 苏云金芽孢杆菌cry1Ab13 基因的克隆及表达研究[J]. 微生物学报, 2002, 42(1): 40-44. DOI:10.3321/j.issn:0001-6209.2002.01.006 (  0) 0) |
| [14] |
关淑艳, 赵丽娜, 刘慧婧, 等. 农杆菌介导的sbe2a基因RNAi载体对玉米遗传转化的研究[J]. 作物杂志, 2011(2): 36-40. DOI:10.3969/j.issn.1001-7283.2011.02.010 (  0) 0) |
| [15] |
郭新梅, 张晓东, 韩立新, 等. 不同基因型玉米幼胚愈伤组织的培养特性[J]. 西北农林科技大学学报(自然科学版), 2007, 35(4): 68-72. DOI:10.3321/j.issn:1671-9387.2007.04.016 (  0) 0) |
| [16] |
刘强, 张丽媛, 马红丹, 等. 转phyA基因玉米新种质的创制[J]. 华南农业大学学报, 2014, 35(1): 43-48. (  0) 0) |
| [17] |
刘强. phyA基因植物表达载体的构建及转化玉米的研究[D]. 长春: 吉林农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10193-1013310346.htm
(  0) 0) |
| [18] |
何康来, 王振营, 周大荣, 等. 玉米抗螟性鉴定方法与评价标准[J]. 沈阳农业大学学报, 2000, 31(5): 439-443. DOI:10.3969/j.issn.1000-1700.2000.05.009 (  0) 0) |
| [19] |
ARMSTRONG C L, PARKER G B, PERSHING J C, et al. Field evaluation of European corn borer control in progeny of 173 transgenic corn events expressing an insecticidal protein from Bacillus thuringiensis[J]. Crop Sci, 1995, 35(2): 550-557. DOI:10.2135/cropsci1995.0011183X003500020045x (  0) 0) |
| [20] |
王忠华, 吴刚. Bt水稻中 cry1Ab 基因的遗传分析[J]. 遗传学报, 2001, 28(9): 846-851. (  0) 0) |
| [21] |
刘悦萍, 赵晓萌, 宫飞. 转基因植物中外源基因沉默机制的研究进展[J]. 中国农学通报, 2005, 21(4): 80-83. DOI:10.3969/j.issn.1000-6850.2005.04.024 (  0) 0) |
| [22] |
岳同卿, 郎志宏, 王延锋, 等. 转 Bt cry1Ah 基因抗虫玉米的获得及其遗传稳定性分析[J]. 农业生物技术学报, 2010, 18(4): 638-644. DOI:10.3969/j.issn.1674-7968.2010.04.003 (  0) 0) |
| [23] |
DAY C D, LEE E, KOBAYASHI J, et al. Transgene integration into the same chromosome location can produce alleles that express at a predictable level, or alleles that are differentially silenced[J]. Genes Dev, 2000, 14(22): 2869-2880. DOI:10.1101/gad.849600 (  0) 0) |
| [24] |
王培, 何康来, 王振营, 等. 转 cry1Ac 玉米对亚洲玉米螟的抗性评价[J]. 植物保护学报, 2012, 39(5): 395-400. (  0) 0) |
| [25] |
王冬妍, 王振营, 何康来, 等. Bt玉米杀虫蛋白含量的时空表达及对亚洲玉米螟的杀虫效果[J]. 中国农业科学, 2004, 37(8): 1155-1159. DOI:10.3321/j.issn:0578-1752.2004.08.012 (  0) 0) |
| [26] |
张永军, 吴孔明, 郭予元. 转Bt基因棉花杀虫蛋白含量的时空表达及对棉铃虫的毒杀效果[J]. 植物保护学报, 2001, 28(1): 1-6. DOI:10.3321/j.issn:0577-7518.2001.01.001 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37