2. 吉林农业大学 农学院,吉林 长春 130118
2. Faculty of Agronomy, Jilin Agricultural University, Changchun 130118, China
磷是植物和大部分农作物所需的大量营养元素之一,缺磷会明显抑制植物的生长[1]。不同物种对磷的需求量从10到100 kg·hm-2不等[2]。而土壤中磷易被转化为磷酸钙[Ca3(PO4)2]、磷酸铁(FePO4)和磷酸铝(AlPO4)等不溶性磷酸盐,造成土壤中可溶性磷的浓度通常仅为1 mg·L-1或更少[1-3]。因此,为了增加农作物产量与效益,过度施用磷肥已使我国大部分土壤处于富磷状态。
土壤中大多数溶磷菌(Phosphate solubilizing bacteria,PSB)能通过生成有机酸、嗜铁素、矿物酸、质子、腐殖质、CO2 和H2S等来释放可溶性磷[4],有效提高土壤中植物可利用磷的含量,同时也可以减少化肥的使用[5]。有研究表明,由于微生物对各种根系信号传导和分泌模式有不同的应答,尤其是当植物处于磷胁迫状态下,微生物群落受不同植物种类的影响较大[6]。Kobus等[7]发现溶磷微生物在土壤中的数量受土壤物理结构、有机质含量、土壤类型、土壤肥力、耕作方式和措施等因素的影响。目前共有89种溶磷微生物被鉴定,其中27种真菌,58种细菌和4种放线菌。相较于真菌和放线菌,溶磷菌是溶磷微生物的主要种类[8]。
中国东北黑土区是重要的粮食生产基地,过去的20年由于土壤腐蚀和大量施肥,黑土中磷的总量日趋增加[9],但磷的当季利用率仅有5.12%[10]。大豆Glycine max是该地区主要农作物之一,平均种植面积2010年已经增长到800万hm2[11]。因此,明确黑土区大豆根际溶磷菌的种类与溶磷特点,发现大豆专属生物菌肥的有效菌源,在降低农业生产成本及资源节约利用方面将有重要的意义。但关于东北黑土区溶磷菌的研究报道并不多见。本研究从吉林省地区大豆根际土壤中分离到4株优势PSB,命名为WJ1、WJ3、WJ5和WJ6,并对这4种菌株的溶磷和产酸特性进行分析比较。
1 材料与方法 1.1 土壤样品及培养基3种土壤样品均取自于中国东北吉林省地区(吉林农业大学大豆试验田,长春市农安县大豆试验地和吉林省公主岭大豆试验地)的大豆根际土壤。NBRIP液体生长培养基[12]配方为:10 g·L-1葡萄糖, 5 g·L-1MgCl2·6H2O,0.25 g·L-1MgSO4·7H2O,0.2 g·L-1KCl,0.1 g·L-1(NH4)2SO4和5.0 g·L-1Ca3(PO4)2作为磷源,pH 7。固体培养基需添加15 g·L-1琼脂。改良NBRIP培养基:pH 8,0.5 g·L-1蛋白胨代替0.1 g·L-1(NH4)2SO4。LB培养基配方为:10 g·L-1 NaCl,10 g·L-1胰蛋白胨,5 g·L-1酵母膏。
1.2 PSB菌株的分离和鉴定为了从土壤中分离得到PSB,每份土样与无菌水按质量比1: 100混合摇床震荡1 h。然后将逐级稀释的上清液涂布NBRIP固体培养基。28 ℃培养2 d,有明显溶磷圈的菌落为PSB[13]。在NBRIP琼脂平板上进行3~4次的纯化培养。纯化后的菌株-70 ℃条件保存备用。
利用Vitek2 (bioMerieus, France)细菌自动分析系统和16S rDNA分子生物学技术进行菌株鉴定。分别提取WJ1、WJ3、WJ5和WJ6的总DNA,进行16S rDNA序列扩增,PCR所用引物分别对应于大肠埃希菌(GenBank序列号为J01859)的7~26位和1 512~ 1 491位[14],上、下游引物序列分别为,5′-AGAGTTTGATCATGGCTCAG-3′和5′-TACGGTTACCTTGTTACGACTT-3′。PCR产物由上海生工生物工程股份有限公司进行测序。GenBank DNA数据库和BLAST程序查找同源序列。
1.3 96 h细菌溶磷量与生长量的测定菌株WJ1、WJ3、WJ5和WJ6分别接种在LB培养基中,当培养液细胞浓度为D600 nm =0.6时,按体积分数为0.5%接种于100 mL改良NBRIP培养基。连续培养96 h,每隔6 h取样,标准板计数法测定细胞数量,钼蓝比色法测定溶磷量。
1.4 细菌生长对培养基pH的影响利用甲基红显色反应检测细菌溶磷过程中改良NBRIP培养基pH的变化。溶磷菌的培养同“1.3”,每隔1 h取PSB菌液2 mL,与100 μL 0.5 g·L-1的甲基红指示剂混合以记录培养基的颜色。利用同样的方法将4个菌株的培养液分别接种到100 mL改良NBRIP培养基和LB培养基中,培养12 h,每隔2 h取菌液2 mL,利用pH计记录培养基的pH。
1.5 培养基初始pH对细菌生长的影响将LB液体培养基pH分别调至3、4、5、6、7、8、9,按上面所述方法向LB培养基中接入4株分离的菌株,每隔2 h取1次菌液,记录12 h内D600 nm的值。
1.6 PSB菌株有机酸的提取为了测定不同PSB菌株产有机酸种类,将WJ1、WJ3、WJ5和WJ6种子液(同“1.3”)接种到改良NBRIP培养基中培养24 h后,培养液6 000 r·min-1离心15 min。上清液用0.22 μm滤膜真空抽滤,通过转酯作用对样品进行甲酯化反应[15]。每个样品取5 mL滤液与9 mL甲醇-硫酸(体积比=10: 7)混合,60℃培养12 h,待培养液冷却后离心分离,将5 mL甲醇加入到离心后的上清液中,上清液合并转移到60 mL分液漏斗中,再加入1 mL饱和NaCl溶液、20 mL蒸馏水、5 mL二氯甲烷进行洗涤,剧烈振荡60 s后静置分层。将脱水后的二氯甲烷相在40 ℃水浴条件下利用氮气吹干,然后准确加入1 mL二氯甲烷。以未接种的培养基作对照。样品进行GC-MS分析。
1.7 PSB菌株有机酸的GC-MS分析Agilent 5975c ga系统装置购于美国Agilent公司, 采用3轴的HED-EM质谱检测系统。Agilent hp-35弹性石英毛细管柱为30 m×0.25 mm×0.25 μm,采用氦气为1.0 mL·min-1的恒速流动模式。柱箱程序升温,初始温度为80 ℃,保持2 min,然后以5 ℃·min-1的速率升温至280 ℃,保持15 min。通过与Wiley 7和NIST库匹配的质谱来鉴定成分。
1.8 统计分析采用Windows XP系统中DPS统计软件(12.01版)分析数据。
2 结果与分析 2.1 PSB菌株的分离与鉴定按照溶磷圈大小,从大豆根际土壤分离获得WJ1、WJ3、WJ5和WJ6共4株溶磷能力较强的菌株。各菌株16S rRNA基因序列利用GenBank DNA数据库进行BLAST同源性比较,结果表明:菌株WJ1(登录号KM975675)与Pseudomonas putida N-128 (登录号JN216880.1)的相似性为99%;菌株WJ3(登录号KM975676)与Enterobacter cloacae subsp. Cloacae ENHKU01 (登录号CP003737.1)的相似性为99%;菌株WJ5(登录号KM975677)与Ochrobacterum haematophilum ATCC49188 (登录号NR-074243.1)的相似性为98%;菌株WJ6(登录号KM975678)与Klebsiella pneumoniae 342 (登录号CP000964.1)的相似性为98%。结合Vitek 2自动分析系统结果,将菌株WJ1、WJ3、WJ5和WJ6分别鉴定为假单胞菌Pseudomonas sp.、肠杆菌Enterobacter sp.、苍白杆菌Ochrobacterum sp.和克雷伯菌Klebsiella sp.。
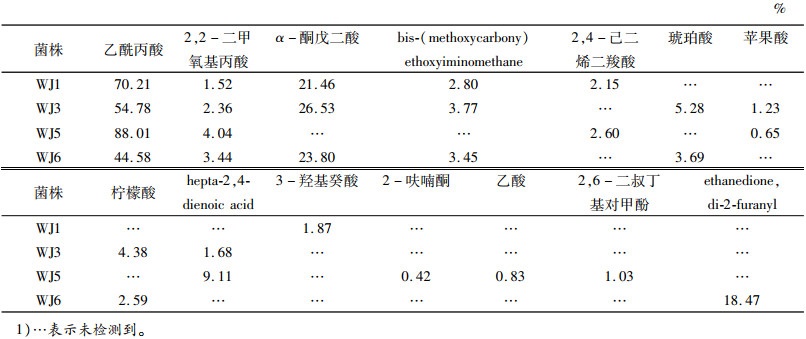
2.2 PSB菌株溶磷量与生长曲线的变化为了研究pH、生长量和溶磷量之间的关系,将4株溶磷菌接种到以Ca3(PO4)2为唯一磷源的改良NBRIP培养基中。由图 1可知,各菌株的溶磷量和细胞生长量有明显的关系,当菌株生长量达到最大值时,溶磷量也趋于最大。溶磷菌WJ1、WJ3、WJ5、WJ6经过6 h延滞期后,开始以对数形式增长,之后分别在42、36、30和30 h时达到稳定期,稳定期分别维持在42~60、36~48、30~54和30~54 h。液体培养基中释放的可溶性磷的量随时间的变化逐渐增长,4种PSB最大溶磷量分别为558、478、596和586 μg·mL-1。在最初的12 h时,WJ5的溶磷能力都低于其他菌株,24 h之后溶磷量明显高于WJ1和WJ3。
|
图 1 不同溶磷菌在接菌96 h内溶磷量与生长曲线的变化 Figure 1 The growth of different PSB and the amounts of P released by the PSB within 96 h of inoculation |
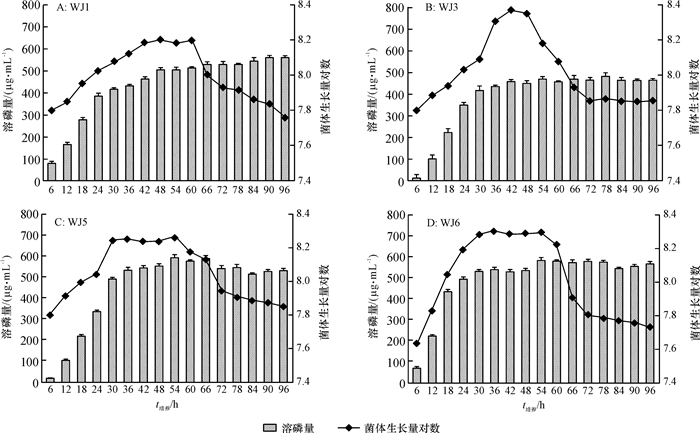
PSB在溶解磷酸盐过程中能够产酸[16-17]。虽然磷酸盐溶解的机理仍有许多不明之处,但已有报道称有机酸的释放导致的pH下降可能与溶磷作用相关[18]。甲基红试验表明:加入指示剂后,各菌株的培养物都观察到一致的颜色变化趋势(图 2):由黄色变为橙色,最后变为红色,但不同菌株菌液达到红色的时间明显不同。菌株WJ1、WJ3、WJ5、WJ6分别在4、3、8和2 h时开始变色,在6、17、13和4 h后保持红色不变。由图 3可知,在改良NBRIP培养基中,细菌的生长过程伴随明显的pH下降。在12 h内,菌株WJ1、WJ3、WJ6培养物的pH从开始的8降到3~5。12 h内相对应的LB液体培养基的pH略有下降,之后又恢复到最初的数值。菌株WJ5在LB培养基中培养,12 h内培养液pH略有下降,在改良NBRIP培养基中培养12 h后,与其他3株菌相比,培养液pH下降较小。

|
图 2 不同溶磷菌的培养基在接菌18 h内的甲基红显色结果 Figure 2 The methyl red tests of acidification levels of media within 18 h of inoculating different PSB |
|
图 3 不同溶磷菌在12 h内对改良NBRIP和LB培养基pH的影响 Figure 3 Changes in pH of modified NBRIP media and LB media within 12 h of incubating different PSB |
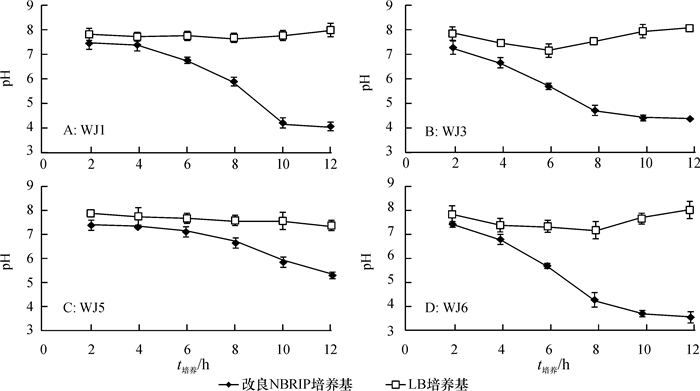
为了研究pH和细胞生长量之间的关系,在初始pH为3~9的LB培养基中对PSB的生长进行了观测。由图 4可知,各pH条件下,WJ1、WJ3、WJ5和WJ6的细胞生长趋势相似。培养基pH低于4时,各菌株生长量明显下降。pH为5的条件下,WJ1和WJ3的生长轻微减缓,而WJ5和WJ6仍正常生长。
|
图 4 不同溶磷菌在不同初始pH LB培养基中的生长曲线 Figure 4 The growth curves of different PSB in LB media with different initial pH |
对4菌株24 h培养物中的有机化合物进行GC-MS分析。表 1显示,WJ1、WJ3、WJ5、WJ6菌株的培养滤液中分别检测到6、8、8和7种有机化合物,这些有机化合物中包含了不同种类的有机酸。其中,乙酰丙酸的相对含量最高,但其是对照中检测到的仅有的有机酸成分,因而不能认定乙酰丙酸为PSB菌株溶磷过程中产生的。2,2-二甲氧基丙酸是4种菌株培养滤液中另一种共有的成分,相对于检测到的化合物总量所占百分比分别为:1.52%、2.36%、4.04%和3.44%。WJ1、WJ3、WJ6培养滤液中α-酮戊二酸的相对含量较高,分别达到21.46%、26.53%和23.80%。此外,WJ3与WJ6还检测到3种相同的物质,包括bis- (methoxycarbony) ethoxyiminomethane、琥珀酸、柠檬酸。
|
|
表 1 不同溶磷菌溶磷24 h培养物中的有机化合物相对含量1) Table 1 Relative contents of organic compounds secreted from different PSB during 24 h of culturation |
植物从土壤吸收磷的主要形式为磷酸根离子(H2PO4-和HPO42-),但土壤中的大多数磷酸盐不易溶解[19]。多种细菌及真菌具有将不溶磷酸盐转化成植物可利用的磷的能力[20]。本研究中我们报道了从大豆根际土壤中分离到4种优势PSB株,分别鉴定为假单胞菌属(WJ1)、肠杆菌属(WJ3)、苍白杆菌属(WJ5)、克雷伯菌属(WJ6)PSB菌株。菌株WJ1、WJ3、WJ5和WJ6在以Ca3(PO4)2为唯一磷源的液体培养基中培养96 h,最大溶磷量均高于赵小蓉等[21]报道的溶磷菌的溶磷量。细菌WJ1、WJ3和WJ6已经被确认为有高效溶磷能力的溶磷微生物[22-23],但苍白杆菌属的溶磷特性及机制报道较少。本试验研究结果表明WJ5是1株具有分泌有机酸、高耐酸性的溶磷菌株。
甲基红试验和pH测定结果表明:PSB溶磷过程中pH会不断下降,pH降低到一定值时溶磷量也不再增加,这与菌株Ps. fluorescens RAF15表现的规律基本一致[9]。GC-MS对培养基上清液中有机酸的测定结果证实,pH的下降是有机酸分泌的结果。PSB耐酸性的强弱决定了细胞数量,而当细胞数量较多、生长稳定期较长,则溶磷量较大。菌株WJ5和WJ6具有更好的耐酸性,且WJ5分泌酸比较晚,有利于菌体生长;菌株WJ6的生长表现出更长的稳定期。因此,WJ1、WJ3、WJ5和WJ6产酸对于溶磷是1个必要条件,但是不同PSB菌株的溶磷能力依赖于活细胞的数量和其耐酸性。
不同溶磷微生物有多种溶磷机制[19],通过分泌有机酸实现溶磷仍是大多数溶磷菌株的主要机制[24]。柠檬酸、乙酸、苹果酸和琥珀酸是溶磷过程中共有的有机酸,在许多不同的PSB培养滤液中都能检测到[1, 17],但溶磷真菌Penicillium sp.溶磷过程中没有发现有大量有机酸的产生[25]。一些研究者认为磷的分解不仅是由有机酸和质子的释放引起的,此过程还伴随着NH4+的同化作用[26]。本研究中GS-MS分析得出,4菌株在溶磷过程都伴随有机酸的产生,且种类不同。除去2, 2-二甲基氧丙酸为共有的有机酸外,WJ5中发现的2, 4-已二烯二羧酸,hepta-2, 4-dienoic acid和3-羟基葵酸鲜有报道。相对于其他菌株,WJ5中hepta-2, 4-dienoic acid的相对含量较高。WJ6的培养滤液中ethanedione, di-2-furanyl的相对含量较高,但比α-酮戊二酸的低。而且4个菌株产生有机酸的种类和比例差别较大,化合物的类型和相对含量表明由磷酸盐溶解诱导的代谢途径在4个菌株中不完全相同。
本试验从东北大豆根际土壤中分离获得4株溶磷菌株WJ1、WJ3、WJ5和WJ6,分别被鉴定为假单胞菌属、肠杆菌属、苍白杆菌属和克雷伯氏菌属。4株溶磷菌96 h内最大溶磷量分别为558、478、596和586 μg·mL-1。4个菌株均分泌有机酸,但有机酸种类不完全相同,有机酸的分泌造成培养基pH降低,pH低于4时,明显影响溶磷菌的数量,而菌体数量多,菌体在平台期维持的时间较长,溶磷量较大。
| [1] |
VYAS P, ARVIND G. Organic acid production in vitro and plant growth promotion in maize under controlled envi-ronment by phosphate-solubilizing Pseudomonas fluores-cent[J]. BMC Microbiol, 2009, 9(1): 174-188. DOI:10.1186/1471-2180-9-174 (  0) 0) |
| [2] |
YADAV B K, TARAFDAR J C. Ability of Emericella rugulosa to mobilize unavailable P compounds during Pearl millet[Pennisetum glaucum(L.) R. Br.] crop under arid condition[J]. Indian J Microbiol, 2007, 47(1): 57-63. DOI:10.1007/s12088-007-0011-0 (  0) 0) |
| [3] |
CHUNG H K, PARK M S, MUNUSAMY M H Y. Isolation and characterization of phosphate solubilizing bacteria from the rhizosphere of crop plants of Korea[J]. Soil Biol Biochem, 2005, 37(10): 1970-1974. DOI:10.1016/j.soilbio.2005.02.025 (  0) 0) |
| [4] |
孙振宁, 段兴武, 谢云. 东北典型黑土供肥量与大豆肥料利用率[J]. 中国农学通报, 2012, 28(15): 46-51. (  0) 0) |
| [5] |
YANG P X, MA L, CHEN M H, et al. Phosphate solubilizing ability and phylogenetic diversity of bacteria from P-rich soils around Dianchi Lake drainage area of China[J]. Pedosphere, 2012, 22(5): 707-716. DOI:10.1016/S1002-0160(12)60056-3 (  0) 0) |
| [6] |
RODRIGUEZ H, REYNALDO F. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnol Adv, 1999, 17(4/5): 319-339. (  0) 0) |
| [7] |
KOBUS J. The distribution of microorganisms mobilizing phosphorus in different soils[J]. Acta Microbiol Pol, 1962, 11: 255-264. (  0) 0) |
| [8] |
LIU H, WU X Q, REN J H, et al. Isolation and identification of phosphobacteria in poplar rhizosphere from different regions of China[J]. Pedosphere, 2011, 21(21): 90-97. (  0) 0) |
| [9] |
PARK K H, LEE C Y, SON H J. Mechanism of insoluble phosphate solubilization by Pseudomonas fluorescens RAF15 isolated from ginseng rhizosphere and its plant growth-promoting activities[J]. Lett Appl Microbiol, 2009, 49(49): 222-228. (  0) 0) |
| [10] |
段兴武, 赵振, 刘刚. 东北典型黑土区土壤理化性质的变化特征[J]. 土壤通报, 2012, 43(3): 529-534. (  0) 0) |
| [11] |
薛庆喜. 中国及东北三省30年大豆种植面积、总产、单产变化分析[J]. 中国农学通报, 2013, 29(35): 102-106. DOI:10.11924/j.issn.1000-6850.2012-4055 (  0) 0) |
| [12] |
PARK J H, NANTHI B, MALLAVARAPU M, et al. Concomitant rock phosphate dissolution and lead immobilization by phosphate solubilizing bacteria(Enterobacter sp)[J]. J Environ Manage, 2011, 92(4): 1115-1120. DOI:10.1016/j.jenvman.2010.11.031 (  0) 0) |
| [13] |
NAUTIYALA C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiol, 1999, 170(1): 265-270. DOI:10.1111/fml.1999.170.issue-1 (  0) 0) |
| [14] |
YANG M Y, LI W M, GUO X X, et al. Isolation and identification of a carbazole degradation gene cluster from Sphingomonas sp.JS1[J]. World J Microbiol Biotechnol, 2009, 25(9): 1625-1631. DOI:10.1007/s11274-009-0055-x (  0) 0) |
| [15] |
谢文明, KOK Y, LEEK S. 土壤和白菜中低分子量有机酸的气相色谱分析[J]. 岩矿测试, 2009, 28(2): 97-100. DOI:10.3969/j.issn.0254-5357.2009.02.002 (  0) 0) |
| [16] |
LIN T F, HUANG H I, SHEN F T, et al. The protons of gluconic acid are the major factor responsible for the dissolution of tricalcium phosphate by Burkholderia cepacia CC-Al74[J]. Bioresource Technol, 2006, 97(7): 957-960. DOI:10.1016/j.biortech.2005.02.017 (  0) 0) |
| [17] |
HOBERG E, MARSCHNER P, LIEBEREI R. Organic acid exudation and pH changes by Gordonia sp. and Pseudomonas fluorescens grown with P adsorbed to goethite[J]. Microbiol Res, 2005, 160(2): 177-187. DOI:10.1016/j.micres.2005.01.003 (  0) 0) |
| [18] |
FUENTES B, JORQUERA M, MORA M L. Dynamics of phosphorus and phytateutilizing bacteria during aerobic degradation of dairy cattle dung[J]. Chemosphere, 2009, 74(2): 325-331. DOI:10.1016/j.chemosphere.2008.08.045 (  0) 0) |
| [19] |
ANTOUN H. Beneficial microorganisms for the sustainable use of phosphates in agriculture[J]. Procedia Eng, 2012, 46(3): 62-67. (  0) 0) |
| [20] |
PATEL D K, MURAWALA P, ARCHANA G, et al. Repression of mineral phosphate solubilizing phenotype in the presence of weak organic acids in plant growth promoting fluorescent pseudomonads[J]. Bioresour Technol, 2011, 102(3): 3055-3061. DOI:10.1016/j.biortech.2010.10.041 (  0) 0) |
| [21] |
赵小蓉, 林启美. 微生物解磷的研究进展[J]. 土壤肥料, 2001, 56(3): 7-11. (  0) 0) |
| [22] |
PARK J H, NANTHI B, MALLAVARAPU M, et al. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. J Hazard Mater, 2011, 185(2/3): 829-836. (  0) 0) |
| [23] |
TOFAZZAL-ISLAMA M, DEORAA A, HASHIDOKOA Y, et al. Isolation and identification of potential phosphate solubilizing bacteria from the rhizoplane of Oryza sativa L. cv. BR29 of Bangladesh[J]. Z Naturforsch C, 2007, 62(1/2): 103-110. (  0) 0) |
| [24] |
KHAN M S, ZAIDI A, WANI P A. Role of phosphate-solubilizing microorganisms in sustainable agriculture: A review[J]. Agron Sustain Dév, 2007, 27(1): 29-43. DOI:10.1051/agro:2006011 (  0) 0) |
| [25] |
ILLMER P, SCHINNER F. Solubilization of inorganic phosphates by microorganisms isolated from forest soil[J]. Soil Biol Biochem, 1992, 24(4): 389-395. DOI:10.1016/0038-0717(92)90199-8 (  0) 0) |
| [26] |
ILLMER P, SCJOMMER F. Solubilization of inorganic calcium phosphates-solubilization mechanisms[J]. Soil Biol Biochem, 1995, 27(3): 257-263. DOI:10.1016/0038-0717(94)00190-C (  0) 0) |
 2016, Vol. 37
2016, Vol. 37