大叶相思Acacia auriculiformis是含羞草科Mimosaceae金合欢属Acacia植物,具有重要的生态价值和经济效益[1],速生、耐酸、耐旱、耐贫瘠,抗病虫害、适应性强,是改良土壤、造林绿化的主要树种之一;干型通直,材质优良,得浆率高,是优良的造纸、家具用材。我国于20世纪70年代,从澳大利亚等地引种以来[2],筛选出了一批具有较好表现的优良种源、家系、无性系[3-10],极大地促进了大叶相思的推广种植。然而,目前大叶相思生产中以种子繁殖为主,后代性状分化严重,阻碍着大叶相思优良苗木的推广利用,在生产中的表现受到影响。开展大叶相思成年优树选择,使优良性状在较早期更加稳定,对生产及育种具有更重要的意义。
无性繁殖能最大限度地保持其优良母株的优良性状,利于优树优良性状的固定。大叶相思优树无性繁殖幼化的研究主要集中在扦插繁殖方面[11-12],由于对土地资源有较多要求,其在实际应用中难度较大。组培技术对生产地要求较少,且从生产采穗母株方面看,组培更利于优树幼态性材料的获得,对大叶相思成年优树扩繁具有重要意义。但目前关于大叶相思组培快繁的报道较少[13],主要原因是以愈伤组织诱导途径进行组培,存在着变异大的问题。因此,开展大叶相思成年优树的组培技术体系研究,对促进大叶相思育种及生产推广具有重要意义。
本试验以16年生大叶相思优树为材料对外植体消毒方式进行研究,结合外植体的选择,芽诱导培养基选择,建立了大叶相思高效芽诱导体系;对增殖培养基进行筛选,并研究多次继代与增殖倍数的关系,获得较高且稳定的增殖倍数,提高扩繁效率,并能有效生根[14]。建立的组培快繁技术体系为大叶相思良种快速繁殖提供技术支撑和保障,对加速大叶相思良种的推广种植具有重要的现实意义。
1 材料与方法 1.1 试验材料通过比较树高、胸径、冠幅等因子,从中国林业科学研究院热带林业研究所大叶相思16年生试验林中选取优良单株,以当年新生的腋芽饱满的枝条为研究材料。芽诱导选用经φ为0.1%升汞和75%乙醇消毒后无污染的带腋芽茎段为材料。增殖培养选用外植体通过芽诱导萌发的健壮腋芽为材料。
1.2 消毒剂处理时间对大叶相思芽诱导的影响于8月剪取大叶相思优良单株的当年生腋芽饱满枝条,剪去叶片,洗衣粉水浸泡30 min,刷净后流水冲洗2 h,剪成长1.0~2.0 cm带腋芽的茎段,用φ为0.1%的升汞分别处理15、18、20 min,再分别用φ为75%的乙醇处理5、15、30 s,消毒后用无菌水冲洗4~6次。
1.3 材料部位对大叶相思芽诱导的影响将当年生腋芽饱满枝条的第1~2腋芽茎段(上段)、第3~5腋芽茎段(中段)、第7~8腋芽茎段(下段)剪成长1.0~2.0 cm带腋芽茎段,用“1.2”中筛选出的最佳方法消毒。
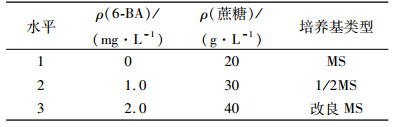
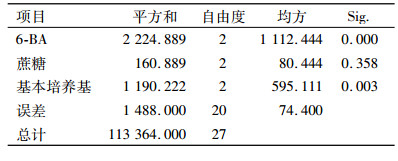
1.4 6-BA、蔗糖、基本培养基对大叶相思芽诱导的影响将消毒后的外植体接种至芽诱导培养基中,考虑6-BA、蔗糖、基本培养基对大叶相思芽诱导的影响,设置L9(33)的正交试验(表 1),每个处理接种50个茎段,重复3次,30 d后统计出芽率。
|
|
表 1 大叶相思芽诱导的L9(33)正交试验 Table 1 Bud inducing of Acacia auriculiformis orthogonal experiment L9(33) |
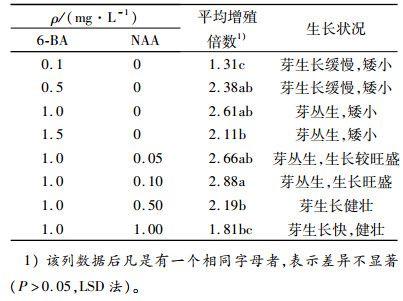
增殖培养基均以MS为基本培养基,选择不同质量浓度的细胞分裂素6-BA(0.1、0.5、1.0、1.5 mg·L-1),探讨细胞分裂素对大叶相思增殖的影响;添加固定质量浓度的细胞分裂素6-BA(1.0 mg·L-1),选择不同质量浓度的生长素NAA(0.05、0.10、0.50、1.00 mg·L-1),探讨生长素NAA对增殖的影响。每个处理接种20个茎段,重复3次。增殖培养35 d后,调查增殖苗的生长情况并统计其增殖倍数。
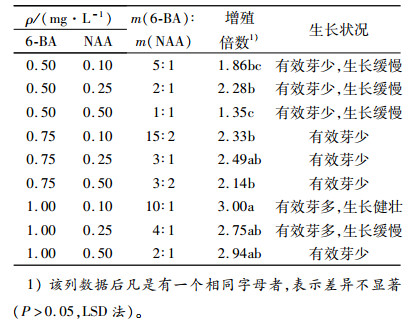
1.5.2 6-BA、NAA不同浓度组合对大叶相思增殖的影响以MS为基本培养基,分别添加质量浓度为0.50、0.75和1.00 mg·L-1的6-BA,质量浓度为0.10、0.25和0.50 mg·L-1的生长素NAA,设置3×3的交互试验,探讨6-BA与NAA不同浓度组合对增殖的影响,共9组处理,每个处理接种20个茎段,重复3次。增殖培养35 d后,调查增殖苗的生长情况并统计其增殖倍数。
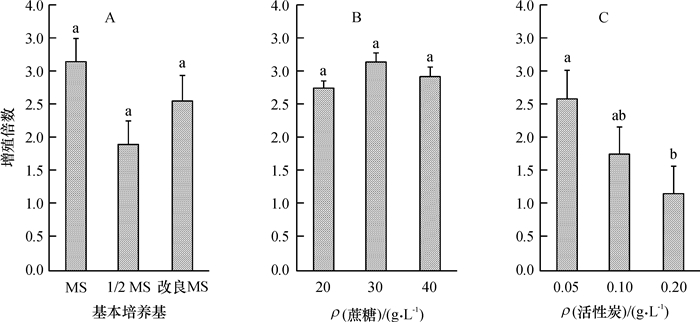
1.5.3 基本培养基、活性炭浓度、蔗糖浓度对大叶相思增殖的影响分别探讨不同基本培养基(MS、1/2MS、改良MS)、蔗糖质量浓度(20、30和40 g·L-1)、活性炭质量浓度(0.05、0.10、0.20 g·L-1)对增殖培养的影响,试验均添加“1.5.2”筛选出的最佳植物生长调节剂组合,每处理接种20个茎段,每组试验重复3次。增殖培养35 d后,调查增殖苗的生长情况并统计其增殖倍数。
1.5.4 多次继代培养对大叶相思增殖的影响在上述对大叶相思增殖培养基筛选试验得出2种最佳增殖培养基的基础上,进行7次继代培养,每35 d继代1次,每个处理接种20个茎段,重复3次,调查第1、3、5、7代增殖苗的生长情况并统计其增殖倍数。
1.6 培养条件以上试验除特殊说明外,消毒后的外植体均接种至MS上进行芽诱导培养,每个处理接种50瓶,每瓶接种1个茎段,重复3次,15 d后统计污染率、褐化率、存活率、出芽率。培养基中均添加琼脂7 g·L-1、蔗糖30 g·L-1,控制pH为6.0左右,在121 ℃条件下高压灭菌15 min,培养温度为(25±2) ℃,每日光照12 h,光照度2 500 lx。
1.7 数据处理使用Excel及SPSS18.0对数据进行处理和方差分析,以最小显著差数法(LSD)评价差异的显著性,使用Origin7.5进行作图。

|
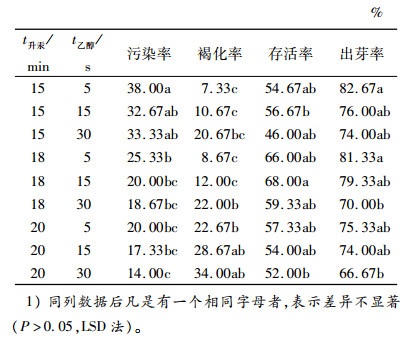
选择φ为0.1%升汞和75%乙醇对外植体进行消毒处理,结果见表 2。污染率随着升汞和乙醇的处理时间增加呈下降趋势,而褐化率则随消毒剂的处理时间增加而增加。出芽率受消毒剂的影响较大,消毒剂处理时间延长,外植体的出芽率有所下降。消毒时间对污染率、褐化率、存活率、出芽率的影响均达到显著水平(P < 0.05),大叶相思耐受消毒剂的刺激,以升汞、乙醇分别处理18 min、15 s或18 min、5 s效果为最佳,出芽率分别为79.33%、81.33%。后续研究只选择其中1个处理,即升汞和乙醇分别处理18 min、15 s。
|
|
表 2 不同升汞和乙醇消毒时间对大叶相思芽诱导的影响1) Table 2 Effects of sterilization time of mercuric chloride and ethyl alcohol on bud inducing of Acacia auriculiformis |
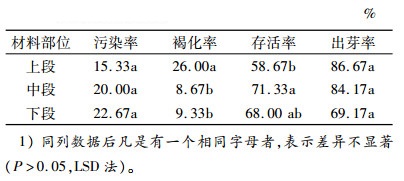
不同材料部位对大叶相思芽诱导的影响结果见表 3。以上段作为外植体时,大叶相思的存活率最低,为58.67%,褐化率显著最高,为26.00%。以下段为外植体时,污染率最高,出芽率则最低。以枝条中段为外植体时,存活率最高,且显著高于上段,为71.33%,而出芽率与上段无显著差异(P > 0.05),为84.17%。综上所述,最佳外植体应选择枝条的中段。
|
|
表 3 材料部位对大叶相思芽诱导的影响1) Table 3 Effects of material position on bud inducing of Acacia auriculiformis |
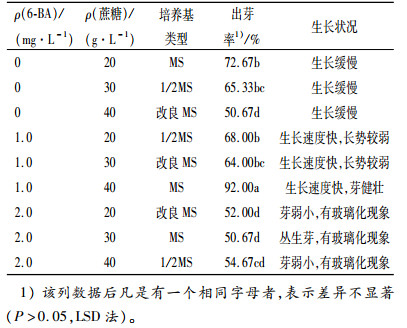
将无菌茎段接入培养基中,10 d后腋芽开始萌发,30 d左右生长至2~3 cm。由表 4可知,培养基中不添加6-BA时,大叶相思的腋芽表现出生长缓慢的现象,在培养基中添加1.0 mg·L-1的6-BA时,大叶相思的腋芽生长迅速,但添加的6-BA质量浓度过高时(2.0 mg·L-1),腋芽的生长出现玻璃化现象;基本培养基选择改良MS和1/2MS时,腋芽均表现出生长弱小的现象,而以MS为基本培养基,诱导的芽较为健壮。方差分析结果(表 5)表明:6-BA和基本培养基类型对大叶相思出芽率的影响都达到了极显著水平(P < 0.01),而蔗糖质量浓度对出芽率的影响差异不显著。6-BA为1.0 mg·L-1时,平均出芽率最高,为74.67%,显著高于其他处理;基本培养基选择MS时,出芽率极显著高于1/2MS和改良MS。
|
|
表 4 6-BA、蔗糖、基本培养基对大叶相思芽诱导的影响 Table 4 Effects of 6-BA, sucrose and basic medium on Acacia auriculiformis bud induction |
|
|
表 5 大叶相思初代培养方差分析 Table 5 Variance analysis of primary culture of Acacia auriculiformis |
综上所述,大叶相思最佳芽诱导培养基为MS+6-BA 1.0 mg·L-1+蔗糖40 g·L-1,出芽率最高。
2.4 增殖培养 2.4.1 6-BA、NAA单因子对大叶相思增殖的影响不同质量浓度的6-BA和生长素NAA对大叶相思增殖倍数的影响达到了显著水平(表 6)。在不添加NAA的增殖培养基中,增殖倍数随着6-BA质量浓度的增加出现先上升后下降的趋势,当6-BA为1.0 mg·L-1,平均增殖倍数达到2.61,含低6-BA(0.5~1.0 mg·L-1)的增殖培养基诱导的增殖芽矮小,且生长缓慢,导致丛生芽中的有效芽减少;当6-BA为1.0 mg·L-1时,平均增殖倍数也随着NAA质量浓度的升高呈现先上升后下降的趋势,增殖芽的长势随着NAA质量浓度的升高而逐渐变好,在NAA为0.10 mg·L-1时,平均增殖倍数最高,为2.88,当NAA达到1.00 mg·L-1时,芽的生长达到最佳状态。故而NAA、6-BA的加入更利于增殖培养,6-BA在0.5~1.0 mg·L-1范围较适宜,NAA适宜的质量浓度范围为0.05~0.50 mg·L-1。
|
|
表 6 6-BA、NAA单因子对大叶相思增殖的影响 Table 6 Effects of 6-BA and NAA on the proliferation of Acacia auriculiformis |
表 7表明,大叶相思增殖倍数随着6-BA与NAA比值的增加基本表现出上升趋势。综合增殖倍数和增殖芽生长状态看,当6-BA为1.00 mg·L-1,NAA为0.10 mg·L-1时(即m(6-BA):m(NAA)=10:1),增殖倍数最高,为3.0,此时的增殖芽生长速度快,有效芽多(图 1A)。6-BA为1.00 mg·L-1,NAA为0.25 mg·L-1时(即m(6-BA):m(NAA)=4:1),增殖倍数为2.75,与前者最高增殖倍数处理无显著差异。而当m(6-BA):m(NAA)<10:1时,多数增殖芽的生长速度缓慢,在同样的增殖时间内达不到较高的增殖倍数(图 1B)。故而增殖培养基中二者的最适加入量分别为:6-BA 1.00 mg·L-1,NAA 0.10 mg·L-1。
|
|
表 7 6-BA、NAA不同质量浓度组合对大叶相思增殖的影响 Table 7 Effects of the combinations of 6-BA and NAA on proliferation of Acacia auriculiformis |

|
图 1 大叶相思增殖芽的生长情况 Figure 1 Growth of proliferation bud of Acacia auriculiformis A:6-BA为1.00 mg·L-1、NAA为0.10 mg·L-1,增殖芽健壮且有效芽多;B:m(6-BA):m(NAA)<10:1,增殖芽生长缓慢,有效芽少。 |
基本培养基类型对大叶相思增殖倍数的影响没有达到显著水平(图 2),但观察发现以1/2MS、改良MS为基本培养基时,增殖芽生长缓慢,芽丛矮小,不适宜选作基本培养基。蔗糖浓度对增殖倍数的影响也未达到显著水平,含低浓度蔗糖的培养基诱导的增殖芽长势较弱,高浓度的蔗糖诱导的增殖芽生长缓慢。活性炭浓度越大,增殖倍数越低,增殖芽的长势越好。
|
图 2 基本培养基类型、蔗糖、活性炭浓度对大叶相思增殖的影响1) Figure 2 Effects of basic medium, sucrose concentration and active carbon concentration on proliferation of Acacia auriculiformis 各图中,柱子上方凡是有一个相同字母者,表示处理间差异不显著(P > 0.05,LSD法)。 |
经过增殖培养研究,获得了2种类型的增殖培养基:Ⅰ型(MS+ 6-BA 1.0 mg·L-1 + NAA 0.1 mg·L-1+蔗糖30 g·L-1)和Ⅱ型(MS+ 6-BA 1.0 mg·L-1 + NAA 0.1 mg·L-1+ Ac 0.05 g·L-1+蔗糖30 g·L-1),Ⅰ型为较高增殖倍数的增殖培养基,Ⅱ型为增殖芽长势较好的增殖培养基。
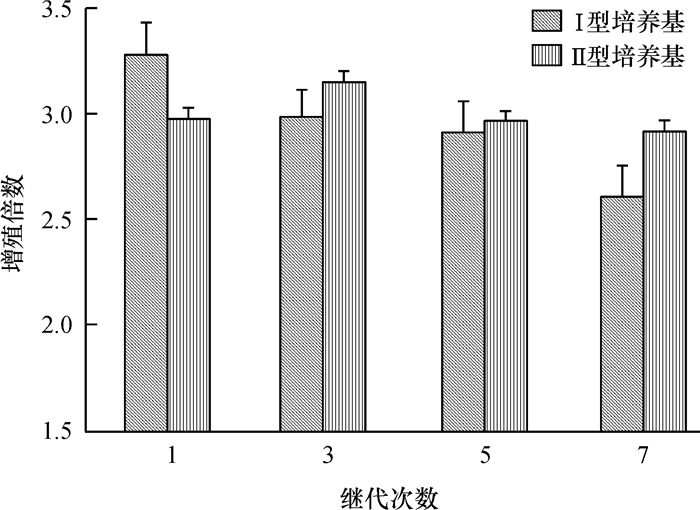
7次继代培养结果表明:Ⅰ型培养基的增殖倍数随着继代次数的增加而呈现下降趋势,Ⅱ型培养基的增殖倍数则较为稳定(图 3)。大叶相思在Ⅰ型培养基上诱导的平均增殖倍数由第1代的3.14下降至第7代的1.96,呈线性下降,平均两代的下降率为14.28%。观察发现,该培养基诱导的增殖芽的长势逐次变差,玻璃化趋势增加,有效芽数目减少(图 4C为Ⅰ型培养基、第1次继代,长势好,增殖倍数较高,为3.14;图 4D为Ⅰ型培养基第7次继代,生长差,增殖倍数低,为1.96)。而Ⅱ型培养基诱导的平均增殖倍数变化趋势不大,7次继代的平均增殖倍数为2.63,增殖芽的质量较好,芽健壮高大,叶片舒展(图 4A为Ⅱ型培养基,第1次继代;图 4B为Ⅱ型培养基,第7次继代)。
|
图 3 大叶相思在Ⅰ型和Ⅱ型培养基上7次继代培养的增殖倍数变化 Figure 3 The proliferation rates of seven subcultures of Acacia auriculiformis on type Ⅰ and Ⅱ media |

|
图 4 大叶相思在Ⅰ型和Ⅱ型增殖培养基上不同继代次数增殖芽的生长情况 Figure 4 Growth status of Acacia auriculiformis subcultured on type Ⅰ and Ⅱ media A:Ⅱ型培养基第1代;B:Ⅱ型培养基第7代;C:Ⅰ型培养基第1代;D:Ⅰ型培养基第7代。 |
林木早期选择虽然可以加速育种进程,选择出的优树也易于无性扩繁推广利用;但是由于树龄较低,通常在后期的选择中被淘汰的概率较高(30%~40%)。因此,早期选择的优树,其可靠性远不及成年优树选择[15]。优树无性系化可提供大量优质苗木,满足生产及良种推广、选育工作对优质苗木的需求。本研究的材料取自16年生优树,保证了材料的优越性和可靠性,将对大叶相思良种的选育及推广利用具有重要作用。对大叶相思成年优树组培扩繁体系的研究,有利于加速其良种选育研究及生产推广利用,进而将优树的经济效益和生态效益最大化。
对植物材料进行组培快繁时需克服其成熟效应,早期选择的材料,其年龄尚幼,进行组培较为容易;随着树龄的增加,组培难度增大;树种不同,无性系不同,进行组培时差异大,且多数成年材料进行组培时芽诱导率低,增殖倍数不稳定。根据对不同树龄的不同植物材料进行的组培快繁技术研究的报道,树龄较低的植物材料较为容易组培成功。黄骐[16]成功建立了卷荚相思A. cincinnata 4年生优树快繁体系,获得了较高的增殖倍数(5.33左右)及生根率(86.0%),但此技术体系是否适于后期选优出来的成年优树尚不可知。黄烈健等[17]对3~5年生马占相思A. mangium 优树不同无性系进行组培快繁研究的结果表明:树龄对休眠芽的萌发影响较大,不同无性系休眠芽启动时间、芽质量、对激素浓度的响应均存在差异;裘珍飞等[18]对马占相思成年优树组培早期增殖速率的研究结果表明:30个无性系增殖启动时间以及增殖率有较大差异,启动时间最短需3个月,最长需7个月以上;增殖率随着继代次数的增加表现出不同幅度的增加,继代到一定次数后趋于稳定。中国林业科学研究院热带林业研究所相思课题组成功建立了16年生厚荚相思A. crassicarpa[19]、马大杂种相思A. mangium×A. auriculiformis[20]优树的组培体系,但厚荚相思的诱导率(80.56%)比马大杂种相思(95.68%)低了15.12%,表明树种间有较大差异。
对大叶相思组培快繁研究的国内报道显示,通过愈伤组织诱导植株的方法存在着变异较大的问题[21]。本研究以16年生大叶相思成年优树为材料,通过芽诱导途径成功建立组培快繁技术体系,获得的组培苗性状稳定,能较好地保持优树的优良性状,对加速大叶相思的良种选育及为生产提供大量优质苗木具有重要意义。
外植体的休眠芽诱导除受到树龄的影响外[17],还受到多方面的综合影响:1)外植体的成功消毒是进行芽诱导的关键,在把握消毒剂种类及消毒时间的同时,要注意观察外植体的形态结构,不同木质化程度的外植体对消毒剂的耐受程度不同,不同物种形态结构需区别对待。马占相思的新生茎段粗大,木质疏松,受消毒剂的影响最为敏感,容易被长时间的消毒剂处理而杀死[17]。本研究则发现,大叶相思木质紧实,比较耐受消毒剂的刺激,有2个处理表现最优:以升汞和乙醇分别处理18 min和5 s或18 min和15 s。受材料部位和消毒时间的影响,马占相思选幼嫩顶芽部分茎段,以短时间的消毒处理能获得较高的芽萌发率[18]。本研究结果表明:外植体茎段来源不同,木质化程度不同,大叶相思选取3~5腋芽茎段为最佳外植体,与本课题组对马大杂种相思[20]、马占相思[17]的研究结果一致。2)6-BA和基本培养基类型对芽诱导具有一定的影响。胡峰等[19]对厚荚相思的研究表明:适宜的培养基为MS,6-BA对诱导具有正效应。本研究中,大叶相思在不同类型的培养基上,腋芽生长表现出显著差异,MS培养基的芽健壮。6-BA同样对芽诱导有正效应,培养基中无6-BA时,腋芽生长缓慢,但6-BA浓度过高会出现玻璃化现象。总之,对不同树龄的材料,结合外植体的选择和消毒方式的筛选,同时对培养基及植物生长调节剂做筛选,方可建立高效的芽诱导体系。
成年优树增殖培养时,单次继代培养均能获得较高的增殖倍数,但随着继代次数的增加,增殖倍数的变化明显。施琼等[22]对马大杂种相思16年生优树组培研究表明,多次继代培养后增殖倍数大幅下降。本试验中,大叶相思在Ⅰ型培养基上多次继代也出现了同样的问题,这可能是多次继代的增殖芽长期受高浓度激素的刺激,组织细胞发生遗传性的改变,在培养过程中逐渐消耗了原有母体组织中存在的与器官形成相关的特殊物质,从而使细胞分化能力下降,多次继代的增殖倍数下降、增殖芽长势变弱[23]。但在培养基中加入一定量的活性炭(Ⅱ型培养基:MS+ 6-BA 1.0 mg·L-1 + NAA 0.1 mg·L-1+Ac 0.05 g·L-1+蔗糖30 g·L-1)后, 7次继代增殖倍数趋于稳定,增殖倍数均值为2.63。这可能是活性炭作为一种添加剂,可以吸收培养基内的有害物质[24],进而促进生长的缘故[25]。另外,有关研究表明,在培养基中添加生物素[26]、赤霉素[27]等也能有效地提高增殖倍数、改善组培苗的质量。
根据中国林业科学研究院热带林业研究所相思课题组对3~5年生马占相思[17]、16年生厚荚相思[19]、16年生马大杂种相思[20, 22]组培体系研究结果表明:组培苗生根几乎不受树龄影响。本研究的最佳生根体系为1/2 MS+IBA 0.5 mg·L-1+NAA 0.5 mg·L-1+蔗糖30 g·L-1,生根率为94.36%,具体研究结果见该课题组的相关报道[14]。
致谢:感谢广东省江门市新会区国家重点相思良种基地提供试验条件!感谢广东省江门市新会区林业科学研究所黄宏健同志以及广东省江门市新会区农林局卢国桓同志等提供的帮助!
| [1] |
陆道调, 吴保国, 王希群, 等. 相思树种研究发展综述[J]. 福建林学院学报, 2004, 24(1): 92-96. DOI:10.3969/j.issn.1001-389X.2004.01.023 (  0) 0) |
| [2] |
SKOLMEN R G. Acacia (Acacia koa Gray)[M]// BAJAJ Y P S. Biotechnology in agriculture and forestry: Volume 1. Berlin: Springer, 1986: 375-383.
(  0) 0) |
| [3] |
谢国干. 大叶相思引种试验初报[J]. 海南林业科技简讯, 1981(2): 39-41. (  0) 0) |
| [4] |
韦增健. 相思类树种引种初报[J]. 广西林业科学, 1984(4): 16-21. (  0) 0) |
| [5] |
弓明钦, 郑瑞昌. 大叶相思白粉病的药剂防治[J]. 林业科技通讯, 1985(8): 30-32. (  0) 0) |
| [6] |
黄永芳, 徐英宝. 大叶相思立地类型的研究[J]. 华南农业大学学报, 1990, 11(1): 94-99. (  0) 0) |
| [7] |
邹国明. 大力发展相思树工业原料林[J]. 林业经济, 2002(3): 61-62. (  0) 0) |
| [8] |
李杏芬. 滨海沙地引种相思类树种生长与生态效应分析[J]. 防护林科技, 2007(5): 18-20. DOI:10.3969/j.issn.1005-5215.2007.05.007 (  0) 0) |
| [9] |
侯远瑞, 龚建英, 陈金艳, 等. 直干型大叶相思在南宁的引种与生长研究[J]. 广西林业科学, 2007, 36(4): 209-211. DOI:10.3969/j.issn.1006-1126.2007.04.009 (  0) 0) |
| [10] |
邓锡胜, 冯光钦, 陈仪飞. 9种阔叶树种生长初步评价[J]. 广东林业科技, 2008, 24(3): 46-50. DOI:10.3969/j.issn.1006-4427.2008.03.009 (  0) 0) |
| [11] |
刘德朝. 直杆大叶相思网袋轻型育苗基质扦插繁殖研究[J]. 桉树科技, 2005(2): 8-11. DOI:10.3969/j.issn.1674-3172.2005.02.002 (  0) 0) |
| [12] |
易敏, 黄烈健, 陈祖旭, 等. 大叶相思扦插繁殖技术研究[J]. 江西农业大学学报, 2011, 23(1): 84-89. DOI:10.3969/j.issn.1000-2286.2011.01.016 (  0) 0) |
| [13] |
杨尚庞. 大叶相思的生物学特性及其繁殖技术[J]. 福建热作科技, 2011, 36(4): 38-39. DOI:10.3969/j.issn.1006-2327.2011.04.014 (  0) 0) |
| [14] |
胡峰, 施琼, 黄烈健. 马占相思和大叶相思优树组培不定根诱导研究[J]. 南京林业大学学报(自然科学版), 2015, 39(2): 57-62. (  0) 0) |
| [15] |
王明庥. 林木遗传育种学[M]. 北京: 中国林业出版社, 2001, 165-166.
(  0) 0) |
| [16] |
黄骐. 卷荚相思优树无性系快速繁殖技术[J]. 林业科技开发, 2007, 21(5): 66-68. DOI:10.3969/j.issn.1000-8101.2007.05.023 (  0) 0) |
| [17] |
黄烈健, 陈祖旭, 张赛群, 等. 马占相思优树组培快繁技术研究[J]. 林业科学研究, 2012, 25(2): 227-230. DOI:10.3969/j.issn.1001-1498.2012.02.020 (  0) 0) |
| [18] |
裘珍飞, 曾炳山, 刘英. 马占相思优树组培早期增殖速率研究[J]. 林业科学研究, 2002, 15(1): 61-65. DOI:10.3321/j.issn:1001-1498.2002.01.010 (  0) 0) |
| [19] |
胡峰, 施琼, 黄烈健. 厚荚相思(Acacia crassicarpa)腋芽组培快繁技术体系研究[J]. 植物研究, 2015, 35(2): 179-184. (  0) 0) |
| [20] |
施琼, 胡峰, 黄烈健, 等. 马大杂种相思组培快繁技术[J]. 华南农业大学学报, 2015, 36(2): 79-84. (  0) 0) |
| [21] |
林木组织培养课题组. 用组织培养法快速繁殖大叶相思[J]. 热带林业, 1982(2): 45-48. (  0) 0) |
| [22] |
施琼, 胡峰, 黄烈健, 等. 马大杂种相思腋芽高效组培增殖体系[J]. 林业科学, 2014, 50(6): 55-60. (  0) 0) |
| [23] |
杨增海. 园艺植物组织培养[M]. 北京: 农业出版社, 1987, 64.
(  0) 0) |
| [24] |
FRIDBORG G, ERIKSSON T. Effects of active charcoal on growth and morphogenesis in cells cultures[J]. Physiol Plant, 1978, 34(4): 306-308. (  0) 0) |
| [25] |
KIM J Y, LEE J S. Effect of cultural conditions on rhizome growth and organogenesis of Cimbidium lancifolium native Korea in vitro[J]. J Korean Soc Hortic Sci, 1992, 33(6): 471-476. (  0) 0) |
| [26] |
石大兴, 王米力, 石轶松, 等. 巨桉芽器官离体培养与快繁体系建立的研究[J]. 林业科学, 2003, 39(1): 69-74. (  0) 0) |
| [27] |
顾地周, 罗微, 曹逊, 等. 松毛翠的离体快繁体系建立及种质试管保存[J]. 林业科学, 2009, 45(7): 140-144. DOI:10.3321/j.issn:1001-7488.2009.07.024 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37