2. 广东科贸职业学院,广东 广州 510640
2. Guangdong Polytechnic of Science and Trade Guangzhou, Guangzhou 510640, China
原始生殖细胞(Primordial germ cells,PGCs)形成成熟配子过程中,生殖细胞特异性转录因子调控及表观遗传修饰是必需的[1-2]。Sohlh1是一种生殖器官特异表达基因,编码了1种bHLH转录调控因子,调控精子和卵子的发生。在雄性老鼠中SOHLH1蛋白集中于A型精原细胞分化的所有过程中,而在精母细胞和新生的小鼠中未检测到[3]。对新生小鼠卵巢进行组织切片原位杂交或抗体染色观察发现SOHLH1主要分布在卵原细胞簇、原始卵泡和初级卵泡的卵细胞中,而在次级卵泡中不表达[4]。
研究表明,Sohlh1基因调控生殖细胞分化是通过与Sohlh2基因一起调节Kit信号通路来实现,同时SOHLH1与SOHLH2共同或单独作用于其他基因的启动子上,主要是E-box位点实现基因的转录激活或抑制[5-9]。Sohlh1基因的自我调控是通过Sohlh2/Sohlh1/Sp1复合物作用Sohlh1基因的启动子的E-box位点实现的[3-4, 6, 8, 10]。Suzuki等[7]研究表明,小鼠Sohlh1基因敲除后精原细胞能够继续增殖但不能进行正常分化,从而导致雄性小鼠不育,Pangas等[4]研究表明在Sohlh1基因敲除雌性鼠卵巢中主要是通过下调2个与卵泡形成相关的基因Nobox和Figla的表达来阻碍卵泡的形成,最终造成不育。
Sohlh1基因调控生殖细胞生成过程在小鼠上已被深入研究,随着各种动物基因组公布,很多物种Sohlh1基因被验证或预测,目前国内外主要集中在Sohlh1基因的调控等方面的研究,但对该基因的启动子的功能和调控方面的研究还太少。通过分析已报道的小鼠Sohlh1基因的启动子和预测的猪Sohlh1基因的启动子,发现猪Sohlh1基因的启动子GC含量远高于小鼠,同时发现小鼠Sohlh1基因的启动子与猪Sohlh1基因的启动子有很大的差异性。因此,本研究首先通过RT-PCR方法检测猪生殖细胞特异性基因Sohlh1在仔猪及成年猪各组织表达情况,进而扩增猪Sohlh1基因并对其进行分子遗传进化分析,最后探究猪Sohlh1基因的启动子的核心区域和特异性调控区间,为后续利用猪Sohlh1基因的启动子制备生殖细胞特异性表达目的基因克隆猪奠定基础。
1 材料与方法 1.1 材料 1.1.1 试验动物1日龄长白仔猪,购于广东省广三保原种猪场,成年猪各组织采自广州附近屠宰场。
1.1.2 质粒和细胞株pGL3-basic启动子验证载体为Promega公司产品,小鼠精原干细胞株GC-1为ATCC公司产品。
1.2 方法 1.2.1 猪组织样品采集1日龄仔猪组织样品采集:仔猪全身用φ为70%乙醇棉球擦拭,确保全身消毒,将仔猪固定于清洁手术盘中,割破仔猪颈动脉处死仔猪,依次采取皮肤、肌肉、心、肝、脾、肺、肾、脑、睾丸(公猪)及卵巢(母猪)分装2份,一份置于2 mL RNase-free离心管中立即置于液氮中保存,另一份放于RNA样品保存液中于-20 ℃条件保存。
成年猪组织样品采集:在屠宰场依次采取皮肤、肌肉、心、肝、脾、肺、肾、脑及卵巢,睾丸采自广三保淘汰种公猪,分2份,保存方法同仔猪组织样品。
1.2.2 猪各组织样品RNA抽提及反转录根据OMEGA公司的动物组织总RNA抽提试剂盒说明书抽提猪各组织RNA,RNA抽提出来后,一部分立即进行反转录,另一部分分装后立即保存于-80 ℃冰箱中,以防RNA降解。以抽提的RNA为模板,按Transgene反转录试剂盒说明书合成cDNA,反应在PCR仪进行,反转录程序为25 ℃,10 min,50 ℃,30 min,85 ℃,5 min。
1.2.3 RT-PCR检测以上述合成cDNA为模板,用Sohlh1基因检测引物和启动子扩增引物序列(表 1),RT-PCR检测猪Sohlh1基因在各组织中表达情况。1 g·mL-1琼脂糖凝胶电泳检测RT-PCR产物。
|
|
表 1 Sohlh1基因检测和启动子扩增引物 Table 1 Primers for Sohlh1 gene detection and promoter amplification |
从NCBI数据库下载已报道的动物Sohlh1基因,包括猩猩、猴子、猪、小鼠、大鼠、牛、大象等27个品种或亚种,将这些动物Sohlh1基因序列的编码区翻译为对应的SOHLH1蛋白,应用Lasergene和MEGA4等生物软件,采用自动填缺口的clustalW方法比对,使用临近比较法作图(1 000个bootstrap重复)[11-12]。
1.2.5 猪Sohlh1基因启动子扩增及验证载体构建根据扩增出的猪Sohlh1基因,在NCBI中GENE数据库选取Sohlh1基因起始密码子前10 000 bp,进行生物信息学分析(同源比对:http://blast.ncbi.nlm.nih.gov/Blast.cgi,启动子预测:http://www.fruitfly.org/seq_tools/promoter.html, http://gpminer.mbc.nctu.edu.tw/index.php;CpG岛预测:http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi),结合几个启动子预测软件,设计1对引物FW PS和FW2943R(表 1)扩增出起始密码子前5 102 bp核酸序列,克隆到pGL3-basic载体,标记为pGL3-Sohlh1-5102。通过在线转录因子预测软件,以pGL3-Sohlh1-5102为模板,再次设计8对不同长度引物(表 1)扩增出不同长度启动子,并克隆到pGL3-basic载体,送生工测序部测序。
1.2.6 双荧光素酶测定将测序正确的重组质粒转染GC-1细胞,48 h后去除细胞培养基,PBS小心洗涤2次,加上适量细胞裂解液1×Cell Lysis Buffer室温裂解细胞10 min,细胞刷刮取至1.5 mL离心管中,4 ℃ 10 000 r·min-1离心10 min,取上清液备用。将100 μL平衡至室温的Luciferase Reaction Reagent加入试管中,再小心吸取20 μL细胞裂解物至试管中,混匀,于化学发光仪中检测萤火虫荧光素酶报告基因的活性。检测完后,吸取100 μL平衡至室温的Luciferase Reaction ReagentⅡ加入上述反应试管中,涡旋混匀,于化学发光仪中检测海肾荧光素酶报告基因的活性。
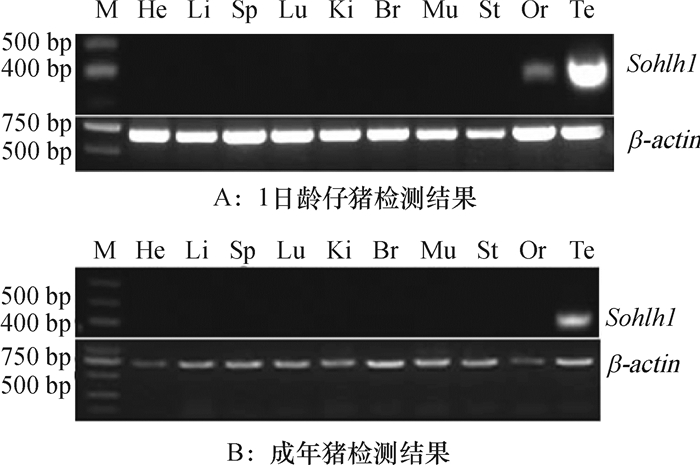
2 结果与分析 2.1 生殖细胞特异性基因Sohlh1在成年猪及仔猪各组织表达情况1 d仔猪和成年猪心、肾、肝、脾、肺、脑、胃、肌肉、睾丸及卵巢等组织通过RT-PCR检测Sohlh1基因表达。结果显示,在仔猪与成年猪睾丸里Sohlh1基因都有表达,在仔猪卵巢中可以检测到Sohlh1基因的表达,而在成年猪卵巢里及仔猪、成年猪其他组织未检测到Sohlh1基因的表达(图 1A、图 1B)。
|
图 1 猪各组织Sohlh1基因mRNA表达情况 Figure 1 Expression of Sohlh1 gene mRNA in different pig tissues M:DNA Marker DL1000(上),DNA Marker DL2000(下),He:心,Li:肝,Sp:脾,Lu:肺,Ki:肾,Br:脑,Mu:肌肉,St:胃,Or:卵巢,Te:睾丸;β-actin大小为658 bp。 |
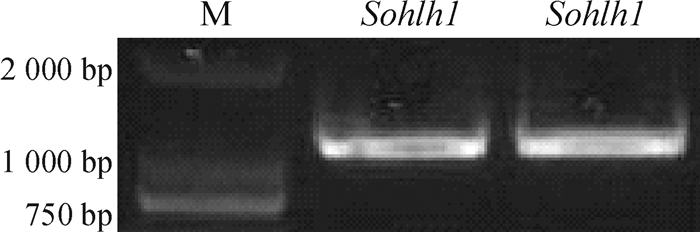
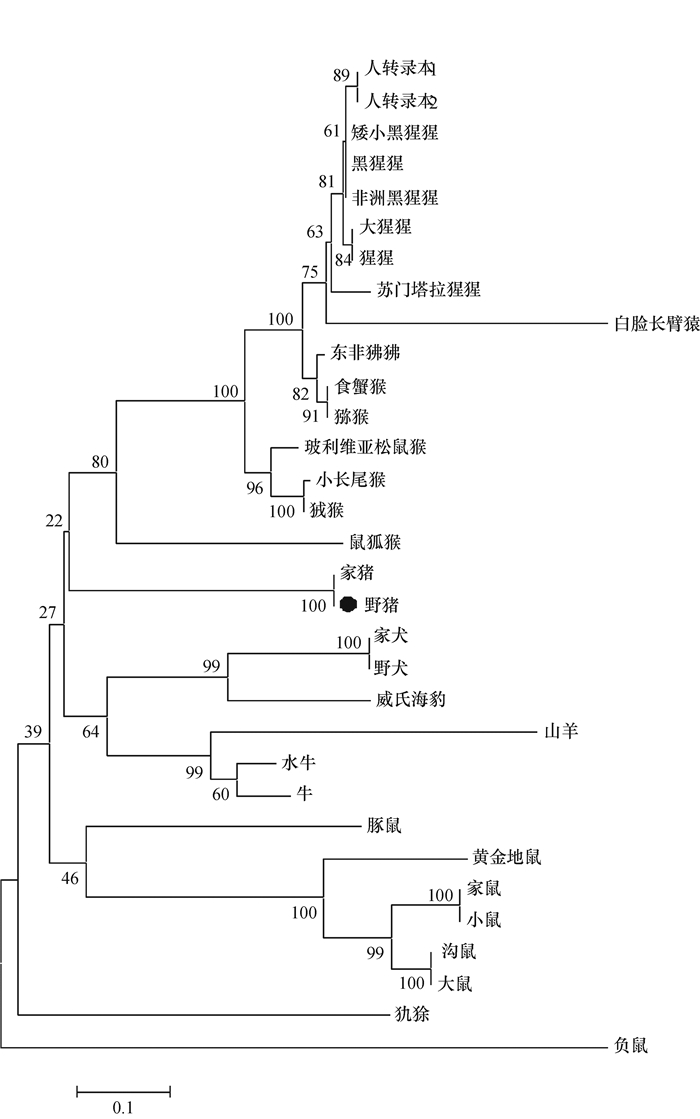
首先,用高保真DNA聚合酶,以仔猪睾丸中获得的cDNA为模板,扩增出猪Sohlh1基因(图 2),并将其克隆到平末端载体,经测序及比对,所获得的猪Sohlh1基因序列与NCBI数据库报道的基本一致。将猪Sohlh1基因编码的蛋白与已报道的脊椎动物SOHLH1蛋白进行氨基酸序列比对发现,SOHLH1蛋白在脊椎动物上相对不保守;进一步将Sohlh1基因所编码蛋白进行分子遗传进化分析(图 3),图 3显示,Sohlh1基因在脊椎动物上具有从低等到高等进化特性,猪处在灵长类动物与啮齿动物之间。结果表明猪作为动物试验模型,比如人类疾病模型,可能更优于啮齿类动物。
|
图 2 RT-PCR扩增猪Sohlh1基因 Figure 2 RT-PCR amplification of pig Sohlh1 gene M:DNA Marker DL 2000,Sohlh1:PCR扩增的Sohlh1基因。 |
|
图 3 Sohlh1基因编码蛋白在脊椎动物的遗传进化 Figure 3 Genetic evolution of protein coded by Sohlh1 gene |
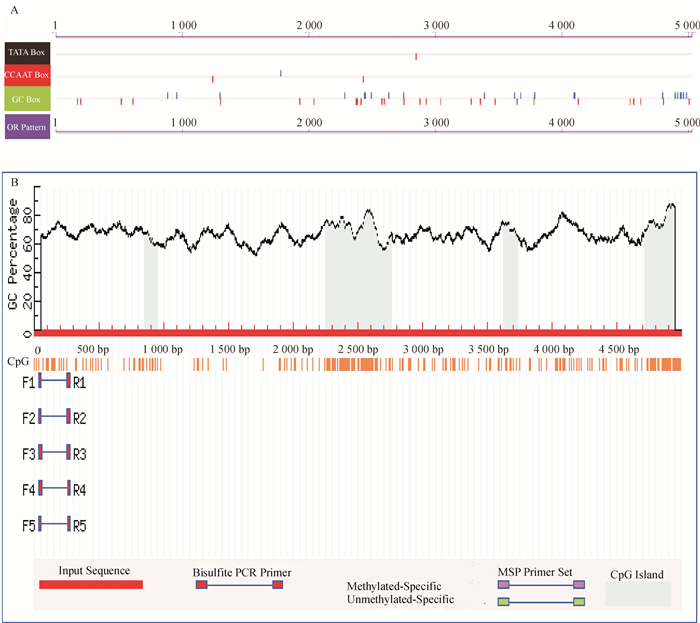
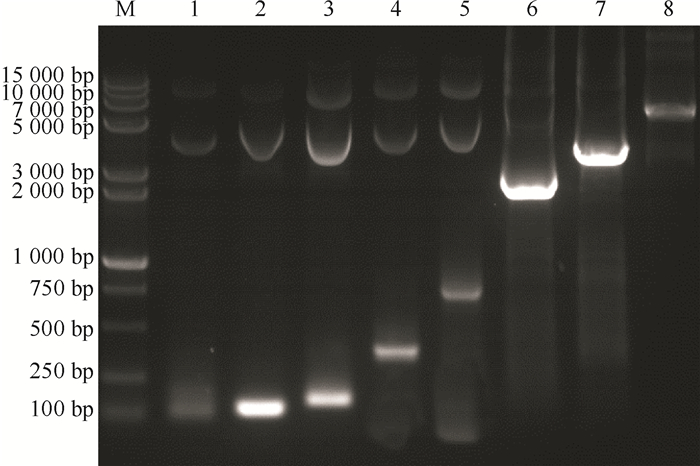
为了探讨猪Sohlh1启动子活性及特异性,结合对其的生物信息学分析(图 4),构建了不同长度猪Sohlh1启动子,克隆到pGL3-basic的启动子验证载体上,PCR鉴定(图 5)测序结果表明不同长度猪Sohlh1基因的启动子构建成功。
|
图 4 猪Sohlh1基因结构预测 Figure 4 The structural prediction of pig Sohlh1 gene A:猪Sohlh1基因启动子的预测;B:猪Sohlh1基因CpG的预测。 |
|
图 5 pGL3-Sohlh1启动子PCR鉴定 Figure 5 PCR identification of pGL3-Sohlh1 promoter M:15 000+2 000 DNA Marker,1~8分别代表pGL3-Sohlh1-78、pGL3-Sohlh1-88、pGL3-Sohlh1-138、pGL3-Sohlh1-360、pGL3-Sohlh1-771、pGL3-Sohlh1-1978、pGL3-Sohlh1-2981及pGL3-Sohlh1-5102。 |
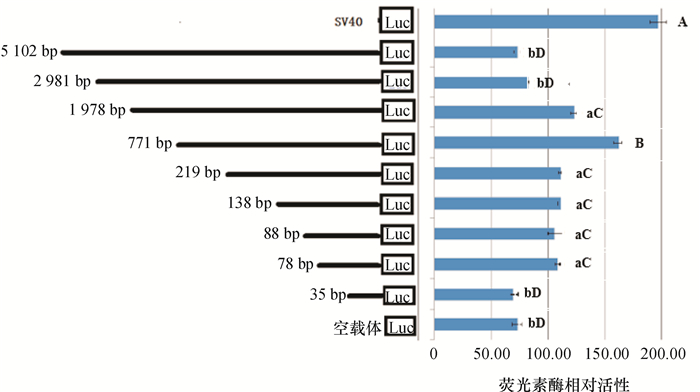
将上述构建好的不同长度启动子,转染293 FT细胞,48 h后收集细胞,进行双荧光素酶活性检测,进一步统计出猪Sohlh1基因的启动子不同长度的活性。结果显示,起始密码子上游78 bp长度的Sohlh1基因的启动子便能够启动荧光素酶的表达,在771 bp时,Sohlh1启动子的活性达到最大。随着启动子的长度增加,其活性开始下降,在2 981 bp长度时表现较低活性,并且与阴性对照组相比差异不显著(图 6)。启动子长度在219 bp以下时,不同长度Sohlh1基因的启动子活性差异不显著,35 bp长度启动子与78 bp长度的启动子相比活性极显著下降,与空白对照组差异不显著(图 6)。
|
图 6 双荧光素酶检测不同长度Sohlh1基因的启动子活性结果 Figure 6 The activities of Sohlh1 promoters of different lengths detected by dual luciferase assay 图中荧光素酶相对活性柱旁凡是有一个相同小写字母者,表示在0.05水平差异不显著;凡是有一个相同大写字母者,表示在0.001水平差异不显著(Tukey HSD多重比较)。 |
SOHLH1是一种生殖特异性bHLH转录调节因子,基因敲除试验证明Sohlh1基因在生殖细胞成熟过程中起着重要的作用[3-4]。本研究通过RT-PCR方法验证了Sohlh1基因只在猪生殖器官中特异性表达,且在成年猪卵巢中不表达;获得了猪Sohlh1基因mRNA,与NCBI数据库预测序列基本一致,通过对比多物种之间Sohlh1基因分子遗传进化特点,发现Sohlh1基因在脊椎动物上相对不保守,猪Sohlh1基因与灵长类动物遗传关系较近,侧面印证了猪是人类较好的动物试验模型,比如人类疾病模型。
生殖细胞特异性基因能够在生殖细胞中特异性表达,是通过转录调控因子及其他多种因素共同调节的结果,生殖细胞特异性基因由于只在生殖细胞中表达,对于遗传学分析的研究显得十分重要。目前,Hammond等[13]根据已有的生殖细胞特异性基因对生殖细胞进行遗传学分析来研究老鼠的生殖细胞。本研究通过克隆生殖细胞特异性转录因子Sohlh1基因的启动子,并构建了不同长度的猪Sohlh1基因的启动子,对其功能进行初步分析,验证了猪Sohlh1基因的启动子的核心区域在78 bp附近,特异性调控区间在771~2 981 bp之间。对于bHLH转录调节因子研究表明,E-box这一位点主要是由碱性螺旋-环-螺旋蛋白家族成员识别[14-17],bHLH转录调控因子主要是通过形成同源或异源二聚体结合到DNA的E-box位点来调节基因的表达[5, 8-9, 16]。Toyoda等[10]的研究表明SOHLH1和SOHLH2可以形成异源二聚体,绑定到Sohlh1启动子上游3个E-box位点,上调Sohlh1基因的表达。本研究对猪Sohlh1启动子进行生物信息学分析发现,其起始密码子上游219~771 bp之间也含有3个E-box位点,而双荧光素酶试验结果表明猪Sohlh1启动子在长度为219与771 bp的启动子活性差异显著,因此推测其活性与这些E-box位点相关。对771~2 981 bp这段启动子序列分析发现,其含有第1个CpG岛,因此推测这段区间内启动子活性显著下降可能与CpG岛甲基化有关。GC-box是重要的转录因子SP1的结合位点[18],对本研究中的起始密码子前78 bp启动子长度进行生物信息学分析发现,仅有一个确定的SP1转录因子结合位点,敲除这个位点后,启动子相比活性极显著下降,因此推测Sohlh1基因的核心启动子活性可能与SP1转录因子有关。
目前,关于Sohlh1基因的研究不多,最新的研究表明,Sohlh1基因可能被视为原发性卵巢功能不全(POI)的候选基因[19],非梗阻性无精子症也与Sohlh1基因的突变有关[20]。在人体上的研究也表明,Sohlh1基因的突变会导致非综合性促性腺激素分泌过多性腺机能衰退[21]。同时还有许多生殖基因、miRNAs与Sohlh1基因之间的关系[19]、Sohlh1基因在生殖调控中的具体作用,以及启动子之间的作用等都还不清楚,有待于我们进一步的研究。通过猪Sohlh1基因及其启动子的初步研究,为后续课题研究奠定理论基础。
| [1] |
BETTEGOWDA A, WILKINSON M F. Transcription and post-transcriptional regulation of spermatogenesis[J]. Philos Trans R Soc Lond B Biol Sci, 2010, 365(1546): 1637-1651. DOI:10.1098/rstb.2009.0196 (  0) 0) |
| [2] |
EUN S H, GAN Q, CHEN X. Epigenetic regulation of germ cell differentiation[J]. Curr Opin Cell Biol, 2010, 22(6): 737-743. DOI:10.1016/j.ceb.2010.09.004 (  0) 0) |
| [3] |
BALLOW D, MEISTRICH M L, MATZUK M, et al. Sohlh1 is essential for spermatogonial differentiation[J]. Dev Biol, 2006, 294(1): 161-167. DOI:10.1016/j.ydbio.2006.02.027 (  0) 0) |
| [4] |
PANGAS S A, CHOI Y, BALLOW D J, et al. Oogenesis requires germ cell-specific transcriptional regulators Sohlh1 and Lhx8[J]. Proc Natl Acad Sci U S A, 2006, 103(21): 8090-8095. DOI:10.1073/pnas.0601083103 (  0) 0) |
| [5] |
CHOI Y, YUAN D, RAJKOVIC A. Germ cell-specific transcriptional regulator Sohlh2 is essential for early mouse folliculogenesis and oocyte-specific gene expression[J]. Biol Reprod, 2008, 79(6): 1176-1182. DOI:10.1095/biolreprod.108.071217 (  0) 0) |
| [6] |
BARRIOS F, FILIPPONI D, CAMPOLO F, et al. SOHLH1 and SOHLH2 control Kit expression during postnatal male germ cell development[J]. J Cell Sci, 2012, 125(Pt 6): 1455-1464. (  0) 0) |
| [7] |
SUZUKI H, AHN H W, CHU T, et al. SOHLH1 and SOHLH2 coordinate spermatogonial differentiation[J]. Dev Biol, 2012, 361(2): 301-312. DOI:10.1016/j.ydbio.2011.10.027 (  0) 0) |
| [8] |
DESIMIO M G, CAMPOLO F, DOLCI S, et al. SOHLH1 and SOHLH2 directly down-regulate STIMULATED BY RETINOIC ACID 8 (STRA8) expression[J]. Cell Cycle, 2015, 14(7): 1036-1045. DOI:10.1080/15384101.2015.1007721 (  0) 0) |
| [9] |
SWANSON H I, YANG J H. Specificity of DNA binding of the c-Myc/Max and ARNT/ARNT dimers at the CACGTG recognition site[J]. Nucleic Acids Res, 1999, 27(15): 3205-3212. DOI:10.1093/nar/27.15.3205 (  0) 0) |
| [10] |
TOYODA S, YOSHIMURA T, MIZUTA J, et al. Auto-regulation of the Sohlh1 gene by the SOHLH2/SOHLH1/SP1 complex: Implications for early spermatogenesis and oogenesis[J]. PLoS One, 2014, 9(7): e101681. DOI:10.1371/journal.pone.0101681 (  0) 0) |
| [11] |
SAITOU N, NEI M. The neighbor-joining method: A new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(4): 406-425. (  0) 0) |
| [12] |
ZHANG W, SUN Z. Random local neighbor joining: A new method for reconstructing phylogenetic trees[J]. Mol Phylogenet Evol, 2008, 47(1): 117-128. DOI:10.1016/j.ympev.2008.01.019 (  0) 0) |
| [13] |
HAMMOND S S, MATIN A. Tools for the genetic analysis of germ cells[J]. Genesis, 2009, 47(9): 617-627. DOI:10.1002/dvg.v47:9 (  0) 0) |
| [14] |
LUO Y, LIN L, BOLUND L, et al. Genetically modified pigs for biomedical research[J]. J Inherit Metab Dis, 2012, 35(4): 695-713. DOI:10.1007/s10545-012-9475-0 (  0) 0) |
| [15] |
APONE S, HAUSCHKA S D. Muscle gene E-box control elements: Evidence for quantitatively different transcriptional activities and the binding of distinct regulatory factors[J]. J Biol Chem, 1995, 270(36): 21420-21427. DOI:10.1074/jbc.270.36.21420 (  0) 0) |
| [16] |
CATALA F, WANNER R, BARTON P, et al. A skeletal muscle-specific enhancer regulated by factors binding to E and CArG boxes is present in the promoter of the mouse myosin light-chain 1A gene[J]. Mol Cell Biol, 1995, 15(8): 4585-4596. DOI:10.1128/MCB.15.8.4585 (  0) 0) |
| [17] |
CECCARELLI E, MCGREW M J, NGUYEN T, et al. An E box comprises a positional sensor for regional differences in skeletal muscle gene expression and methylation[J]. Dev Biol, 1999, 213(1): 217-229. DOI:10.1006/dbio.1999.9345 (  0) 0) |
| [18] |
SAFFER J D, JACKSON S P, ANNARELLA M B. Developmental expression of Sp1 in the mouse[J]. Mol Cell Biol, 1991, 11(4): 2189-2199. DOI:10.1128/MCB.11.4.2189 (  0) 0) |
| [19] |
ZHAO S, LI G, DALGLEISH R, et al. Transcription factor SOHLH1 potentially associated with primary ovarian insufficiency[J]. Fertil Steril, 2015, 103(2): 548-553. DOI:10.1016/j.fertnstert.2014.11.011 (  0) 0) |
| [20] |
CHOI Y, JEON S, CHOI M, et al. Mutations in Sohlh1 gene associate with nonobstructive azoospermia[J]. Hum Mutat, 2010, 31(7): 788-793. DOI:10.1002/humu.21264 (  0) 0) |
| [21] |
BAYRAM Y, GULSUNER S, GURAN T, et al. Homozygous loss-of-function mutations in SOHLH1 in patients with nonsyndromic hypergonadotropic hypogonadism[J]. J Clin Endocrinol Metab, 2015, 100(5): E808-E814. DOI:10.1210/jc.2015-1150 (  0) 0) |
 2016, Vol. 37
2016, Vol. 37



