2. 西北民族大学 生命科学与工程学院,甘肃 兰州 730030
2. College of Life Science and Engineering, Northwest University for Nationalities, Lanzhou 730030, China
家畜的寄生线虫病是全世界普遍发生且严重影响着家畜生产性能的疫病之一。长期以来,线虫病的防治主要依赖于化学驱虫药,如阿维菌素(Abamectin)、苯并咪唑(Benzimidazole)、左旋咪唑(Levamisole)等,但随着化学药物的长期使用,它们的副作用如寄生虫抗药性增强、畜体内药物残留等问题都不可小觑。目前人们在寻找其他的替代防治方法来减少化学驱虫剂的使用,如划区轮牧、清除牧场粪便以及开发疫苗等[1-2],而利用食线虫真菌对家畜寄生线虫的自由生活阶段的幼虫进行生物防治是人们所期望的最有应用前景的方法之一。捕食线虫真菌可以通过菌丝特化形成具有特殊结构的捕食器官,如黏性球、黏性分枝、非收缩性环、收缩性环、黏性网及冠囊体捕捉线虫,不同捕食器官有它自身所特有的捕食机制,其中能形成三维黏性网的菌占了捕食线虫真菌的绝大部分[3]。鞭式达丁屯菌Duddingtonia flagrans是典型的能够产生三维黏性网的菌之一,该菌由于能够产生大量的厚垣孢子,厚壁的厚垣孢子对酸碱和消化酶有强耐受性,在通过动物的胃肠道时能够存活,并且随粪便中的虫卵一起排出体外;当温度适宜时虫卵发育孵化成幼虫,厚垣孢子也随之萌发成菌丝产生三维黏性网来捕捉线虫。
国外已将鞭式达丁屯菌作为家畜线虫生物防治制剂的候选菌种,分别在绵羊、山羊、牛、马等家畜上进行试验,在实验室阶段对减少弯孢节丛孢对捻转血矛线虫Haemonchus contortus 3期幼虫有良好的效果[4-6]。然而,除鞭式达丁屯菌外,从当地分离捕食线虫性真菌对进一步筛选有生物防治潜力的菌种是十分必要的,因为只有当地的真菌才能更好适应当地的气候和环境且无生态学风险。关于弯孢节丛孢菌Arthrobotrys musiformis, 国内从茶园、橘子园的土壤[7]以及从牛、羊、马、驴、猪粪便中曾得到分离[8]。本研究从与牛羊生活相关的基质中分离该菌,重点通过扫描电子显微镜观察该菌与动物胃肠道的捻转血矛线虫3期幼虫、自由生活线虫秀丽隐杆线虫Caenorhabditis elegans的相互作用及捕食的动态过程。为进一步研究捕食线虫性真菌的杀虫机理提供科学依据。
1 材料与方法 1.1 样品采集于2012年10月—2014年8月,从全国20个省(直辖市、自治区)的48个县、87个采样点采集了1 502份样品,包括粪便1 141份(其中羊粪793份、牛粪348份)、牛羊放牧草地土壤118份、粪堆147份、厩舍土壤96份。其中粪便样品采集于直肠中或排出后0.5 h内未被土壤粘污的粪便,土壤样品从地表下5~10 cm处采取,粪堆样品从堆积粪便表面下5~10 cm处分点采取;样品每份15~20 g,装在经消毒后洁净的塑料袋中密封置于4 ℃冰箱中保存直至接种。
1.2 真菌分离、纯化和电镜中所用的诱饵线虫用先前实验室分离保存的绵羊捻转血矛线虫3期幼虫接种3月龄已驱虫的羔羊,人工感染3周后,经粪便检查排出大量虫卵以确定感染,将粪便搓碎并置于搪瓷盒中,并加入适量灭菌锯末和蒸馏水于26 ℃培养7 d,用蒸馏水将爬到搪瓷盒盖上的捻转血矛线虫3期幼虫洗下,加无菌蒸馏水1 000 r·min-1离心洗涤3次,每次5 min。培养秀丽隐杆线虫时将其接种于有OP50大肠埃希菌的NGM培养基上,置于20 ℃培养7 d,用存放于4 ℃冰箱的M 9缓冲液冲洗虫体,离心洗涤方法同捻转血矛线虫3期幼虫。电镜中使用的幼虫如果离心过程中不够洁净,在倒置显微镜下用一特制的吸管挑出幼虫后再用无菌蒸馏水离心1次备用。
1.3 真菌分离土壤样品压碎以“Y”字形撒在水琼脂培养基(WA)上[9],粪便样品采用三点接样法接种于WA上[10],样品接种量每个平皿2~5 g,每份样品3个平行。接种后当天至第2天,每个培养皿加入约2 000条捻转血矛线虫3期幼虫作为诱饵。为了防止培养基失水,培养皿用封口胶密封,然后置于25 ℃培养6周。在加入捻转血矛线虫3期幼虫1周内,在倒置显微镜(Olympus, IX2-SLP, Japan)下用4倍和10倍的物镜每天检查或隔天检查1次,以后每隔1周检查1次。在此过程中一旦发现线虫被捕捉,就用接种针或解剖针将捕食的线虫、捕食结构或分生孢子转移到0.4 g·L-1的玉米粉琼脂(CMA)培养基上,25 ℃培养2~3 d,然后加入约4 000条秀丽隐杆线虫直至获得纯培养物。培养过程中,对该菌菌落特征,分生孢子形态及大小、产孢方式、分生孢子梗大小、捕食结构等进行观察,并按照李飞天等[11]、Zhang等[12]所列检索表和描述进行鉴定。
1.4 扫描电镜样品的制备和观察参照Nordbring-Hertz[13]介绍的方法并加改进。首先将透析膜(相对质量分数为8 000~14 000)剪裁成直径6 cm的小圆块,置于250 mL烧杯中,加入100 mL蒸馏水,121 ℃高压灭菌15 min;灭菌后取出透析膜置于9个WA培养基上,边缘用少量20 g·L-1的灭菌琼脂密封。然后,用直径5 mm的打孔器取事先培养在0.4 g·L-1 CMA上的分离株(NPS045)菌块接入透析膜中央,26 ℃培养4 d,移去透析膜中央的接种块,并在透析膜中央加入20 μL(约10 000条)秀丽隐杆线虫或捻转血矛线虫3期幼虫虫体悬液。同时,设不加线虫的对照组为3个平皿。加线虫后,每隔1 h在倒置显微镜下观察,当观察到虫体被菌丝捕捉时记为0 h,并在培养皿底部做出标记,以后在捕捉后6、14、19、24、32 h观察秀丽隐杆线虫的变化过程及6、12、22、32、48、56、68 h观察捻转血矛线虫3期幼虫的变化过程并做出标记。每一监测时间点下用手术刀和镊子取1块约1 cm2的透析膜,放入25 g·L-1的戊二醛中,4 ℃固定5 d,其后用0.1 mol·L-1 PBS(pH 7.2)冲洗3次;用系列体积分数梯度(30%、50%、60%、70%、85%、95%和100%)乙醇溶液依次脱水,每次10 min,最后用体积分数为100%的乙醇溶液重复脱水1次。为防止残留乙醇对冷冻效果的影响,先将样品置于3 mL叔丁醇中2 min, 取出后再放入1 mL叔丁醇中4 ℃作用10 min,立即放入真空干燥箱(DZF型,上海森信公司生产)在真空度0.08 MPa下干燥40 min。样品干燥后用双面胶带粘贴在样品台上,离子溅射仪(日立E-1010型)喷金后,用扫描电镜(S-3400N型)观察拍照。
2 结果与分析 2.1 弯孢节丛孢菌的分离从1 502份样品中,共分离出17株弯孢节丛孢菌,在总样本中的检出率为1.13%(17/1 502),其中新鲜粪便中3株,分离率0.26%(3/1 141);粪堆中2株,分离率1.36%(2/147);草场土壤中8株,分离率6.78%(8/118);厩舍土壤中4株,分离率4.17%(4/96)。在地理分布上,以云南、贵州检出最多,其次为四川、内蒙古,其他采样点未检出。该菌形态学特点:菌丝无色,分枝,分隔,排布密集;分生孢子梗无色,直立,不分枝,顶端有小齿梗较离散似烛台状分枝(图 1A),在短而小的齿梗上产生3~12个分生孢子,稀疏,呈头状排列;分生孢子无色,呈椭圆形,直或稍弯,顶端阔圆,向基部逐渐收缩,1个分隔(图 1A和1B)。所分离菌的上述特点与记载的弯孢节丛孢菌相一致[11-12]。
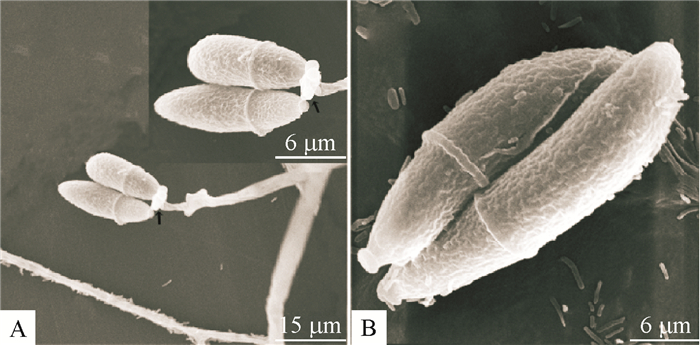
|
图 1 弯孢节丛孢分离株(NPS045)分生孢子及孢子梗的扫描电镜照片 Figure 1 Scanning electron micrographs of conidia and conidiophore of Arthrobotrys musiformis(isolate NPS045) A:分生孢子着生在分生孢子梗顶端(黑色箭头所指);B:2个成熟的分生孢子。 |
弯孢节丛孢菌分离株NPS045在透析膜上呈放射性生长,培养4 d达平皿的2/3,此时加入秀丽隐杆线虫和捻转血矛线虫3期幼虫作用5 h后,营养菌丝上分化出较原菌丝粗的三维黏性网(图 2A)。起初,菌丝上的捕食结构是单环,单环形成时菌丝上会出现一段侧生分支,该分支弯曲向下与原菌丝融合,如此反复构成复杂的三维黏性网(图 2B),这时部分虫体被捕捉。秀丽隐杆线虫被捕捉后的第14 h菌丝刺入整个表皮层出现不规则的褶皱(图 2B),19 h后已经严重皱缩,表明虫体内部器官大多被菌丝消化(图 2C),24 h已经消化完全(图 2D)。捻转血矛线虫3期幼虫被捕捉后的第22小时未有明显皱缩,菌丝刺入虫体,同时虫体与捕食结构接触位点处呈现局部内陷(图 3A),56 h后虫体与捕食结构接触部分的角质层凹陷破裂有侵入性菌丝从体内长出,表明此时虫体内部器官大部分被消化(图 3B);68 h后整个虫体留下表皮层,虫体消化完全(图 3C)。此外,扫描电子显微镜下,大约在捻转血矛线虫3期幼虫捕捉后20 h在捕食部位可发现大量的杆状细菌(助食线虫真菌细菌,图 3D)。
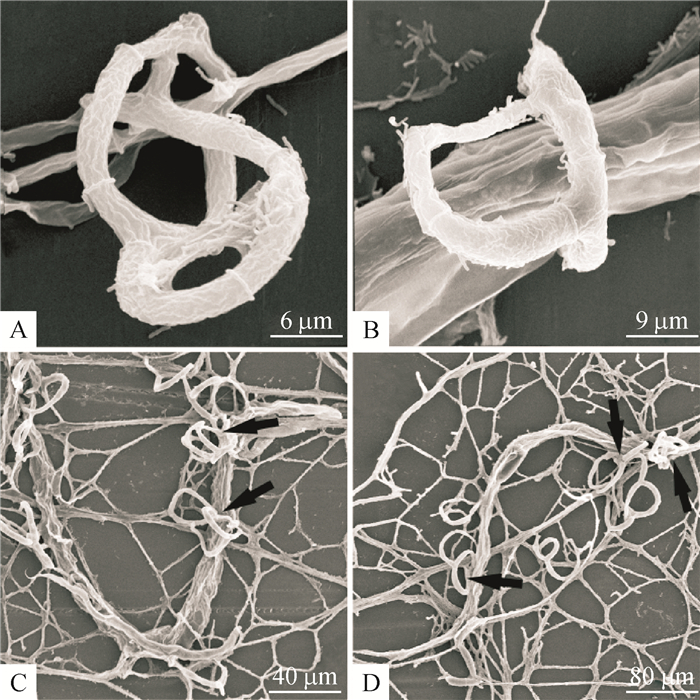
|
图 2 弯孢节丛孢分离株(NPS045)与秀丽隐杆线虫相互作用过程的扫描电镜照片 Figure 2 Scanning electron micrographs of the interaction process between Arthrobotrys musiformis (isolate NPS045) and Caenorhabditis elegans A:捕食结构(三维黏性网);B:捕捉后14 h虫体明显皱缩并被菌丝穿透;C:虫体严重皱缩并且内部器官大多被真菌消化(黑色箭头所指虫体被捕捉的位点);D:菌丝在纤维素膜上的分布以及捕捉24 h后虫体被完全消化(黑色箭头所指虫体被捕捉的位点)。 |
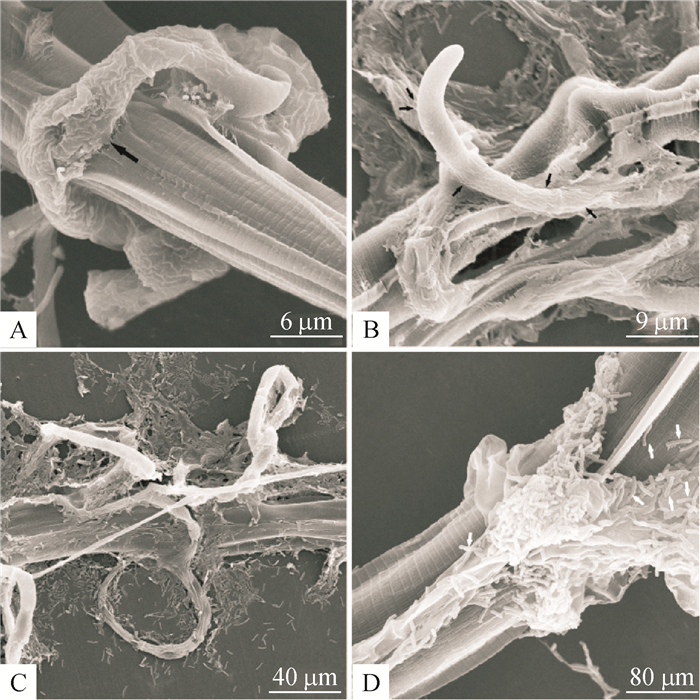
|
图 3 弯孢节丛孢分离株(NPS045)与捻转血矛线虫感染性幼虫(3期幼虫)相互作用的扫描电镜照片 Figure 3 Scanning electron micrographs of the interaction process between Arthrobotrys musiformis (isolate NPS045) and infective larvae (third-stage larvae) of Haemonchus contortus A:捕捉后22 h菌丝刺入虫体(黑色箭头所指穿透位点);B:捕捉后56 h虫体内部器官大多被消化并有侵入性菌丝从体内长出(黑色箭头所指);C:捕捉后68 h虫体被完全消化;D:捕捉后20 h,在捕食位点存在大量助食线虫真菌细菌(白色箭头)。 |
本研究结果表明,弯孢节丛孢菌在新鲜粪便中的检出率为0.26%,粪堆中的检出率为1.36%,厩舍土壤中的检出率为4.17%,草场土壤中的检出率为6.78%。其中新鲜粪便中检出率最低,这与Saumell等[14]的报道基本一致,他们在粪便(采集于牛直肠)中对捕食线虫性真菌总体检出率为3.8%,粪便中检出低的原因可能是捕食线虫性真菌主要分布在自然界中,即使动物吃进,但通过动物消化道后很大一部分被灭活。本研究中粪堆中的检出率高于新鲜粪便中的检出率,这与Hay等[15]报道相一致,粪便排出后几天,植被上的真菌以及携带真菌的土壤线虫就会进入粪便,因此粪堆中的检出率明显升高。本试验中在厩舍、草场土壤中该菌检出率相对较高,这也与在果园、树下、花园等[16]土壤中捕食线虫性真菌的检出率相一致,因为这些栖息地的土壤潮湿、腐殖质含量多利于捕食线虫性真菌生长、繁殖,因而更易分离到。此外,据刘杏忠等[17]报道,捕食线虫性真菌具有一定的地域性,本试验结果表明弯孢节丛孢菌在云南、贵州检出最多,四川、内蒙古次之,其他采样点未检出,这可能与该菌所适应的环境如气候、温度、海拔有关。然而,由于我们采的样品非常有限,此结果并不能证明其他地区不存在该菌。
电镜观察结果表明,加入秀丽隐杆线虫和捻转血矛线虫3期幼虫作用5 h后,弯孢节丛孢菌产生捕食器并开始捕食,此结果与国外学者在其他真菌上的报道结果有所差异。Dacruz等[18]用扫描电镜观察了鞭式达丁屯菌与自然感染的绵羊毛圆科(主要是血矛属)线虫3期幼虫和自由生活线虫——复活线虫Panagrellus sp.的相互作用,30 min后产生捕食器,70 min开始捕食。Campos等[19]报道,用捻转血矛线虫3期幼虫诱导9 h后鞭式达丁屯菌产生捕食结构,11 h后开始捕食。Maciel等[20]用犬的钩口线虫试验,经诱导6 h后鞭式达丁屯菌产生捕食结构,8 h后开始捕食。由于不同试验所用真菌的种类不同,故在捕食时间上有差异。本试验与Campos等[19]的试验所用线虫的种类相同,弯孢节丛孢菌在形成捕食器和捕食虫体所需时间上比Campos等[19]观察的时间分别少4、6 h,说明该菌能更快地捕食捻转血矛线虫3期幼虫。
菌丝刺入虫体的时间因线虫的种类不同而异。本试验中,秀丽隐杆线虫被弯孢节丛孢菌捕捉后,14 h即可刺入虫体,而捻转血矛线虫3期幼虫大约32 h后刺入虫体。Campos等[19]指出,鞭式达丁屯菌菌丝穿透捻转血矛线虫3期幼虫虫体的时间为捕捉后的24~36 h。Falbo等[21]报道,少孢节丛孢菌Arthrobotrys oligospora穿透血矛线虫属3期幼虫虫体的时间为捕捉后的36 h之内。上述捻转血矛线虫3期幼虫被菌丝穿透的时间大致相同。寄生线虫的3期幼虫体壁具有双层的角质保护,主要由尾鞘和坚韧的角质组成,相比之下秀丽隐杆线虫的体壁因只有一层表皮层而更易被刺透。这就解释了为何秀丽隐杆线虫在短时间内更易被弯孢节丛孢菌穿透和消化,也验证了血矛线虫3期幼虫是依靠其双层角质层的保护而更难被该菌穿透消化。此外,在本试验中发现菌丝与虫体相互作用部位的表面皱缩内陷,并且捕食结构会不断增多,这就为穿透时机械性压力理论提供了依据[20]。Murray等[22]认为,菌丝在相互作用的部位穿透虫体是一个复杂的过程,在这个过程中需要大量的侵入性结构为穿透过程提供压力,因为穿透虫体时不仅需要穿透角质层还要克服虫体内部组织器官的压力。
本研究中观察到菌丝刺入虫体后会继续生长和消化虫体内部器官并破坏角质层,同时在黏着部位还发现大量的杆状细菌。Duponnois等[23]研究鞭式达丁屯菌与线虫相互作用时也发现了同一现象,他推测由于杆状细菌的存在使得具有捕食能力的真菌菌丝数量增加,并且这些杆状细菌产生的物质可以作为真菌与线虫间信号传递的纽带,增强真菌与线虫之间的特异性联系,因而把这种杆状细菌叫做助食线虫真菌细菌(Nematophagous fungus helper bacteria, NHB)。然而这些杆状细菌的发生、种类及确切的功能有待进一步研究。
| [1] |
BARGER I A. The role of epidemiological knowledge and grazing management for helminth control in small ruminants[J]. Int J Parasitol, 1999, 29(1): 41-47. DOI:10.1016/S0020-7519(98)00176-3 (  0) 0) |
| [2] |
CRAIG T M. Anthelmintic resistance and alternative control methods[J]. Vet Clin N Am-Food A, 2006, 22(3): 567-581. DOI:10.1016/j.cvfa.2006.07.003 (  0) 0) |
| [3] |
SWE A, JEEWON R, POINTING S B, et al. Diversity and abundance of nematode-trapping fungi from decaying litter in terrestrial, freshwater and mangrove habitats[J]. Biodivers Conserv, 2009, 18(6): 1695-1714. DOI:10.1007/s10531-008-9553-7 (  0) 0) |
| [4] |
SILVA B F, CARRIJO-MAUAD J R, BRAGA F R, et al. Efficacy of Duddingtonia flagrans and Arthrobotrys robusta in controlling sheep parasitic gastroenteritis[J]. Parasitol Res, 2010, 106(6): 1343-1350. DOI:10.1007/s00436-010-1805-2 (  0) 0) |
| [5] |
SAGVÉS M F, FUSÉ L A, FERNÁNDEZ A S, et al. Efficacy of an energy block containing Duddingtonia flagrans in the control of gastrointestinal nematodes of sheep[J]. Parasitol Res, 2011, 109(3): 707-713. DOI:10.1007/s00436-011-2302-y (  0) 0) |
| [6] |
BRAGA F R, ARAÚJO J V. Nematophagous fungi for biological control of gastrointestinal nematodes in domestic animals[J]. Appl Microbiol Biot, 2014, 98(1): 71-82. DOI:10.1007/s00253-013-5366-z (  0) 0) |
| [7] |
毕延菊. 捕食线虫真菌的分布[J]. 思茅师范高等专科学校学报, 2000, 16(3): 47-49. (  0) 0) |
| [8] |
苏鸿雁, 李延清. 几种家畜新鲜粪便中捕食线虫真菌分布情况的研究[J]. 延安大学学报, 2006, 25(2): 69-71. (  0) 0) |
| [9] |
DUDDINGTON C L. Notes on the technique of handling predacious fungi[J]. Trans Brit Mycol Soc, 1955, 38(2): 97-103. DOI:10.1016/S0007-1536(55)80021-6 (  0) 0) |
| [10] |
SANTOS M, FERRAZ S, MUCHOVEJ J. Detection and ecology of nematophagous fungi from Brazilian soils[J]. Nematol Bras, 1991, 15(2): 121-134. (  0) 0) |
| [11] |
李飞天, 张克勤, 刘杏忠. 食线虫菌物分类学[M]. 北京: 中国科学技术出版社, 2000, 79-80.
(  0) 0) |
| [12] |
ZHANG K Q, HYDE K D. Nematode-trapping Fungi[M]. Netherlands: Springer Science & Business, 2014, 92-94.
(  0) 0) |
| [13] |
NORDBRING-HERTZ B. Dialysis membrane technique for studying microbial interaction[J]. Appl Environ Microbiol, 1983, 45(1): 399-407. (  0) 0) |
| [14] |
SAUMELL C A, PADILHA T, SANTOS C, et al. Nematophagous fungi in fresh faeces of cattle in the Mata region of Minas Gerais state, Brazil[J]. Vet Parasitol, 1999, 82(3): 217-220. DOI:10.1016/S0304-4017(99)00022-9 (  0) 0) |
| [15] |
HAY F S, NIEZEN J H, MILLER C, et al. Infestation of sheep dung by nematodephagous fungi and implications for the control of free - living stages of gastro - intestinal nematodes[J]. Vet Parasitol, 1997, 70(4): 247-254. DOI:10.1016/S0304-4017(96)01149-1 (  0) 0) |
| [16] |
杨晓野, 杨连茹, 刘珍莲, 等. 捕食线虫性真菌的分离培养及分布规律[J]. 中国兽医学报, 2003, 23(4): 344-347. (  0) 0) |
| [17] |
刘忠杏, 裘维蕃, 缪作清, 等. 捕食线虫真菌在我国的分布[J]. 真菌学报, 1993, 12(3): 253-256. (  0) 0) |
| [18] |
DACRUZ D G, ARAUJO F B, MOLENTO M B, et al. Kinetics of capture and infection of infective larvae of trichostrongylides and free-living nematodes Panagrellus sp. by Duddingtonia flagrans[J]. Parasitol Res, 2001, 109(4): 1085-1091. (  0) 0) |
| [19] |
CAMPOS A K, ARAUJO J V, GUIMARAES M P. Interaction between the nematophagous fungus Duddingtoniu flagrans and infective larvae of Haemonchus contortus (Nematoda:Trichostrongyloidea)[J]. J Helminthol, 2008, 82(4): 337-341. DOI:10.1017/S0022149X08032203 (  0) 0) |
| [20] |
MACIEL A S, ARAÚJO J V, CAMPOS A K. Scanning electron microscopy of Ancylostoma spp. dog infective larvae captured and destroyed by the nematophagous fungus Duddingtonia flagrans[J]. Micron, 2009, 40(4): 463-470. DOI:10.1016/j.micron.2008.12.007 (  0) 0) |
| [21] |
FALBO M K, SOCCOL V T, SANDINI I E, et al. Isolation and characterization of the nematophagous fungus Arthrobotrys conoides[J]. Parasitol Res, 2013, 112(1): 177-185. DOI:10.1007/s00436-012-3123-3 (  0) 0) |
| [22] |
MURRAY D S, WHARTON D A. Capture and penetration processes of the free-living juveniles of Trichostrongylus colubriformis (Nematoda) by the nematophagous fungus, Arthrobotrys oligospora[J]. Parasitology, 1990, 101(1): 93-100. DOI:10.1017/S0031182000079798 (  0) 0) |
| [23] |
DUPONNOIS R, BA A M, Mateille T. Effects of some rhizosphere bacteria for the biocontrol of nematodes of the genus Meloidogyne with Arthrobotrys oligospora[J]. Fundan Appl Nematol, 1998, 21(2): 157-163. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37


