木耳菜Basella alba,又称落葵、软浆叶、豆腐菜等,为落葵科Basellaceae落葵属Basella,以嫩叶、嫩茎供食用的1年生缠绕性草本植物[1]。因叶子近似圆形,肉质肥厚滑嫩,好像木耳的感觉,所以俗称木耳菜。木耳菜富含胡萝卜素、维生素C、皂素、胶质及铁、钙等营养元素,长期食用具有降血压、滋补肺脏、养血生津等功效[2]。染色体核型分析是细胞遗传学的一项基本技术,对预测、鉴定种间杂交和多倍体育种的结果、了解性别遗传机理以及基因组数、物种起源、进化和种族关系的鉴定具有重要参考价值[3-9]。现有研究多集中在木耳菜栽培技术等方面[1, 10],关于木耳菜的核型研究鲜见报道。本试验以木耳菜典型品种‘大叶木耳菜’为材料,对其染色体制片关键步骤进行条件优化,并进行核型分析,从细胞遗传学角度揭示木耳菜的核型特征,以期为其系统进化研究与遗传育种提供理论基础和技术参考。
1 材料与方法 1.1 材料供试木耳菜品种为‘大叶木耳菜’,由重庆奇研种子经营部提供。
1.2 染色体制片试验于2015年夏季在四川农业大学园艺学院遗传育种实验室进行,将木耳菜种子播于穴盘中,基质成分为草炭:蛭石:珍珠岩(体积比)=3:1:1,放入光照培养箱中25 ℃恒温培养10 d后,采集木耳菜的子叶、下胚轴和主根根尖,培养15 d后采集芽尖和须根根尖。取材时间均为上午9:00,之后进行预处理,以确定最优取材部位;4 ℃条件下以0.002 mol·L-1 8-羟基喹啉溶液分别预处理1、3、6、9、12 h,以确定最优预处理时间。将预处理好的材料置于卡诺固定液[V(冰醋酸): V(乙醇)=1:3], 4 ℃固定24 h,用乙醇溶液梯度(φ为95%、85%和75%)洗脱,保存在φ为75%的乙醇溶液中。解离采用酸解法,将保存好的材料用1 mol·L-1 HCl在60 ℃下分别解离1、4、8、12和16 min,以确定最优解离时间。用蒸馏水清洗3次,切取分生区组织于载玻片上,卡宝品红染液染色5~10 min,常规压片后镜检,将装片中染色体形态及分散良好的中期分裂相细胞在Olympus CX21显微镜100倍油镜下观察并拍照,并用Image Pro 6.0软件进行染色体计数与测量等分析, 采用LSD法对数据进行多重比较。
1.3 核型分析选取30个染色体数目清晰的中期分裂相细胞进行染色体计数,核型分析参照李懋学等[11]提出的标准进行,确定着丝粒位置,根据染色体的大小和形态特征对染色体核型进行配对分析,染色体的相对长度、臂比值及类型按照Levan等[12]的命名法则计算,染色体相对长度系数和着丝粒指数参照李懋学等[11]的标准计算,核型不对称系数采用Arano[13]的方法计算,核型类型按照Stebbins[14]的标准划分。
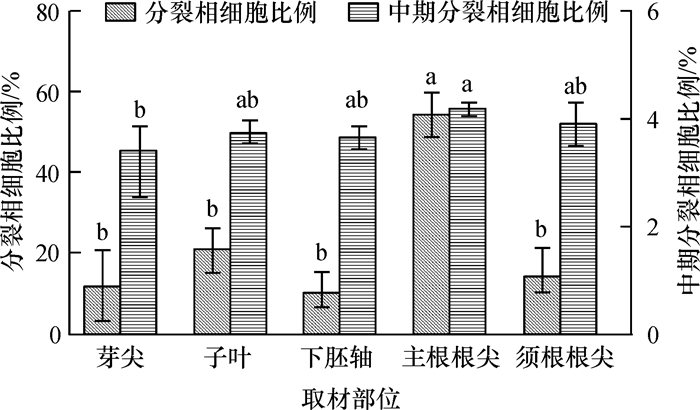
2 结果与分析 2.1 染色体制片的优化 2.1.1 取材部位对分裂相细胞数的影响对不同取材部位木耳菜分裂相细胞数和中期分裂相细胞数进行计数与统计。结果(图 1)表明,不同取材部位分裂相和中期分裂相细胞比例均存在显著差异。其中,分裂相细胞比例最高的是主根根尖,其次是须根根尖、子叶和下胚轴,最低为芽尖。中期分裂相细胞比例最高的也是主根根尖,达到4.09%,显著高于其他部位,最低为下胚轴,仅为0.79%。因此,主根根尖是观察木耳菜染色体的最佳取材部位,后续的核型分析采用主根根尖作为取材部位。
|
图 1 木耳菜不同取材部位的分裂相细胞和中期分裂相细胞比例 Figure 1 The percentage of cells at the mitotic and metaphase stages in different sampling parts of malabar spinach 相同柱子上,凡是有一个相同小写字母者,表示不同取材部位的差异不显著(P > 0.05,LSD法)。 |
预处理时间对木耳菜染色体制片效果存在明显影响。预处理1 h,染色体固缩程度明显不足,且拖尾现象严重,染色体聚为一团,分散性差(图 2A);预处理3 h,染色体分散程度有所改善,但形态不佳且不清晰,着丝粒不明显(图 2B);预处理6 h,染色体收缩性最好,形态最佳,均呈现“X”型,着丝粒清晰可见,分散性好(图 2C);预处理9 h,染色体分散性好,但部分染色体收缩过度,染色体长度差异明显减少,不适合用于核型分析(图 2D);预处理12 h,染色体分散,但大多染色体都收缩过度呈圆点状,着丝粒不明显,只适合染色体计数(图 2E)。因此,预处理6 h的染色体最适合用于木耳菜染色体的核型分析。

|
图 2 木耳菜染色体的显微观察 Figure 2 Chromosomes of malabar spinach under microscope A~E为不同预处理时间的染色体,其中, A:1 h,B:3 h,C:6 h,D:9 h,E:12 h;F~J为不同解离时间的染色体,其中,F:1 min,G:4 min,H:8 min,I:12 min,J:16 min;K为根尖染色体中期分裂相;L为根尖染色体核型图,数字1~22代表染色体编号。 |
解离时间对木耳菜染色体制片效果也存在明显影响。在60 ℃下1 mol·L-1 HCl解离1~4 min,解离不充分,细胞壁软化不够,组织外部直接接触染液的细胞染色体和细胞质均着色很深,对比度低,内部细胞由于接触不到染液无法着色,导致染色体不易观察和分析(图 2F、2G);解离8 min,细胞间较分散,染色体着色良好且细胞质趋于透明,对比度高,解离效果最佳(图 2H);解离12 ~16 min,解离程度逐渐过度,虽然细胞质不易被染色,但细胞中的染色体也不易着色,从而导致染色体颜色太浅,不利于后续的观察和分析(图 2I、2J)。因此,选择8 min作为后续试验的解离时间。
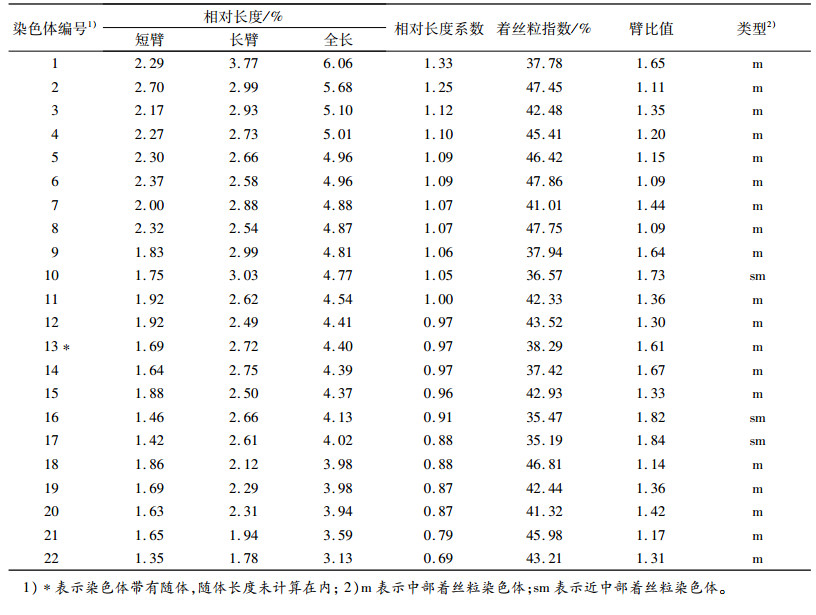
2.2 核型分析选择30个染色体分散良好的细胞观察计数,结果表明所有细胞的染色体均为44条,占计数细胞的100%,确定木耳菜的染色体数目为2n=2x=44。图 2K显示木耳菜各染色体清晰可见,均呈“X”型,着丝粒明显,2条染色体具有随体。核型分析的结果见表 1,染色体相对长度变化范围为3.13%~6.06%,染色体相对长度组成为20 M2+22 M1+2 S,着丝粒指数变化范围为35.19%~47.86%,臂比值变化范围为1.09~1.84,第10、16、17对染色体为近中部着丝粒染色体(sm),其余19对为中部着丝粒染色体(m),第13对染色体具有随体。核型公式为2n=2x=44=38 m(2SAT)+6 sm,染色体长度比为1.93,没有发现臂比值大于2的染色体,根据Stebbins的核型分类标准,木耳菜的核型属1A型,核型不对称系数为57.89%。核型模式图见图 2L。

|
图 3 染色体核型模式图 Figure 3 Karyotype of malabar spinach |
|
|
表 1 木耳菜染色体核型参数 Table 1 Karyotype parameters of chromosomes of malabar spinach |
良好的染色体制片是从事核型分析的基础,染色体制片质量受到诸多因素的影响,其中较为关键的影响因素包括取材、预处理和解离等条件[15]。不同取材部位分裂相和中期分裂相细胞比例均可能有所差异。顾蔚等[16]分析了华中五味子芽、茎尖、小叶、大叶侧边和大叶顶端等部位的中期分裂相细胞数,结果表明茎尖中期细胞比例最高,达30.0%,其次是小叶(24.5%)、大叶侧边(18.0%)和大叶顶端(15.8%),芽的比例最低,仅为5.0%。王小利[17]的研究表明葡萄幼芽和根尖在有丝分裂中期的细胞数最多,最适合用于染色体制片,其次是卷须、茎尖和幼叶组织。本试验结果表明,不同取材部位中期分裂相细胞数比例差异显著,这与前人研究结果类似[16-17],其中主根根尖最适合作为木耳菜染色体制片的材料。
预处理主要通过处理试剂和处理时间2个方面影响制片效果[15]。研究表明常见的预处理试剂中,8-羟基喹啉能使染色体及缢痕和次缢痕清晰,显示效果良好[18];对二氯苯处理染色体分散较好[18];秋水仙素能高效地积累中期分裂相[19]。园艺作物中,白菜、甘蓝、青花菜、芥蓝等蔬菜[20-22]以及悬钩子、树莓等果树[3]作物均采用0.002 mol·L-1 8-羟基喹啉进行预处理,因此本试验中也选取0.002 mol·L-1 8-羟基喹啉为预处理溶液。不同物种最佳预处理时间也有明显差异。如结球甘蓝、芥蓝等甘蓝类蔬菜最优预处理时间为2.0~2.5 h[20-22],悬钩子为24 h[3],而本试验结果表明木耳菜预处理6 h效果最佳。
解离的主要目的是软化和分解部分细胞壁,同时清除部分细胞质,使细胞质背景透明化,便于染色体观察[15]。常用解离方法包括酸解法和酶解法。酸解法步骤简便、容易掌握[15],因此本试验采用盐酸酸解法。杨宁等[19]研究表明,百里香最佳酸解时间为15 min;酸解5 min,时间过短,染色体成团状,且模糊不易分辨;酸解25 min,染色体过于分散且模糊无法辨认。这与我们的研究结果基本一致,本研究中木耳菜最佳解离时间为8 min。
本试验现有结果尚存在不足,如第13号染色体的随体位置还需要进一步确认,这主要受到现有仪器设备精度、技术方法和染色体操作水平等因素限制。随着试验仪器与方法快速发展,将在今后的研究中验证其核型结果。
| [1] |
王亚静, 徐小洲, 秦一统, 等. 不同施肥处理对木耳菜产量及产值的影响[J]. 长江蔬菜, 2015(14): 65-66. DOI:10.3865/j.issn.1001-3547.2015.14.009 (  0) 0) |
| [2] |
李建芳, 豆成林, 王荣荣. 不同干燥方式对木耳菜品质特性的影响研究[J]. 食品研究与开发, 2012, 33(9): 61-63. (  0) 0) |
| [3] |
王小蓉, 汤浩茹, 段娟, 等. 中国悬钩子属空心莓组与木莓组28种和变种的核型比较研究[J]. 植物分类学报, 2008, 46(4): 505-510. (  0) 0) |
| [4] |
CHEN Q, WANG Y, NAN H, et al. Meiotic configuration and rDNA distribution patterns in six Rubus taxa[J]. Indian J Genet Pl Br, 2015, 75(2): 242-249. (  0) 0) |
| [5] |
高天鹏, 王转莉, 郭怀清, 等. 青藏高原东缘3种风毛菊属植物的核型研究[J]. 草业学报, 2009, 18(2): 169-174. DOI:10.11686/cyxb20090225 (  0) 0) |
| [6] |
郑加兴, 张月雄, 覃宝祥, 等. 普通野生稻苗期耐冷性QTLs的互作和聚合效应分析[J]. 华南农业大学学报, 2014, 35(1): 29-36. DOI:10.7671/j.issn.1001-411X.2014.01.006 (  0) 0) |
| [7] |
汪国平, 牛玉, 汪文毅, 等. 番茄SSR标记在茄子及其他茄科作物上的通用性分析[J]. 华南农业大学学报, 2014, 35(4): 56-60. DOI:10.7671/j.issn.1001-411X.2014.04.011 (  0) 0) |
| [8] |
崔喜艳, 胡广宇, 孙小杰, 等. 1个新的玉米半透明皱缩胚乳突变体的遗传及基因定位[J]. 华南农业大学学报, 2014, 35(5): 31-35. DOI:10.7671/j.issn.1001-411X.2014.05.006 (  0) 0) |
| [9] |
慈佳宾, 杨巍, 任雪娇, 等. 玉米单倍体诱导及化学加倍方法的研究[J]. 华南农业大学学报, 2015, 36(3): 49-53. DOI:10.7671/j.issn.1001-411X.2015.03.009 (  0) 0) |
| [10] |
严志萱, 杜利鑫. 木耳菜设施栽培技术[J]. 现代农业科技, 2015(17): 94-96. DOI:10.3969/j.issn.1007-5739.2015.17.052 (  0) 0) |
| [11] |
李懋学, 陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究, 1985, 3(4): 297-302. (  0) 0) |
| [12] |
LEVAN A, FRADGA K, SANDBERG A A. Nomenclature for centromeric position on chromosomes[J]. Hereditas, 1964, 52(2): 201-220. (  0) 0) |
| [13] |
ARANO H. The karyotypes and the speciations in subfamily Carduoideae (Compositae) of Japan[J]. Jap J Bot, 1965, 19(3): 31-67. (  0) 0) |
| [14] |
STEBBINS G L. Chromosomal evolution in higher plants[M]. London: Edward Arnold Ltd, 1971, 87-89.
(  0) 0) |
| [15] |
刘丹, 夏雪, 吴益梅, 等. 植物染色体制片效果影响因素的解析[J]. 浙江农业科学, 2015, 56(10): 1654-1657. (  0) 0) |
| [16] |
顾蔚, 卜海东, 张成艳, 等. 华中五味子染色体制片优化及核型分析[J]. 西北植物学报, 2008, 28(2): 262-266. (  0) 0) |
| [17] |
王小利. 葡萄染色体制片技术优化[J]. 实验室研究与探索, 2012, 31(10): 7-9. DOI:10.3969/j.issn.1006-7167.2012.10.003 (  0) 0) |
| [18] |
陈是宇, 方程, 孙彦, 等. 燕麦属牧草根尖组织染色体观察方法的优化研究[J]. 草原与草坪, 2008(2): 23-26. (  0) 0) |
| [19] |
杨宁, 谈永霞, 李巧峡, 等. 百里香染色体制片优化及核型分析[J]. 草业学报, 2012, 21(1): 184-189. DOI:10.11686/cyxb20120124 (  0) 0) |
| [20] |
袁文焕, 王新娥, 刘建敏, 等. 几种芸薹属蔬菜的核型分析与比较[J]. 河北农业大学学报, 2008, 31(2): 27-30. (  0) 0) |
| [21] |
张蜀宁, 张红梅, 郑金双, 等. 甘蓝类作物的核型分析与比较[J]. 中国蔬菜, 2011(2): 30-35. (  0) 0) |
| [22] |
张红梅, 张蜀宁, 孔艳娥, 等. 青花菜染色体制片技术及核型分析[J]. 南京农业大学学报, 2009, 32(4): 33-36. (  0) 0) |
 2016, Vol. 37
2016, Vol. 37