马波沙星(Marbofloxacin)是第3代喹诺酮类抗菌药物,最早由瑞士罗氏公司创制,Vetoquinol公司进一步开发并于1995年在英国上市[1],随后相继在法国、美国和欧洲上市并被列为动物专用药,其化学结构与氧氟沙星相似,对革兰阳性菌具有较强的抗菌活性,对革兰阴性菌也比较敏感,甚至对某些霉形体、厌氧菌也有效。在水产领域,马波沙星对嗜水气单孢菌Aeromonas hydrophila、温和气单胞菌A. sobria、海洋致病性弧菌Vibrio[2-3]都显示出了较强的抗菌活性。马波沙星在多种动物体内的药物代谢动力学(简称药动学)研究表明,该药具有吸收迅速、组织渗透力强、消除半衰期长、生物利用度高等优良的药动学特性[4],然而马波沙星在水产动物体内的药动学研究却较少,仅在鲫鱼、中华鳖和对虾体内有相关方面的报道。本试验研究了其在罗非鱼Oreochromis niloticus体内的药动学特征,以期为马波沙星在水产动物疾病防治方面的应用提供参考数据。
1 材料与方法 1.1 材料 1.1.1 药品与试剂马波沙星对照品(质量分数为99.0%)为德国Dr. Ehenstorfer GmbH公司产品;氧氟沙星对照品(质量分数为98.2%)为中国兽医药品监察所产品;马波沙星原料药(质量分数为98.0%)为浙江国邦药业有限公司产品;氢氧化钠、四丁基溴化铵、磷酸氢二铵、磷酸、三氯甲烷均为分析纯,广州化学试剂厂产品;甲醇为色谱纯,德国Merck公司产品。
1.1.2 试验动物罗非鱼由珠江水产研究所水产养殖基地提供,体质量230~250 g,抽样检查无马波沙星和氧氟沙星残留,试验前暂养在珠江水产研究所水生试验动物房的水池内,每天投喂未加药物的空白饲料,10 d后用于试验,试验期间用增氧泵充氧,水温维持在(30±0.5)℃,每2天换水1/2体积。选择健康个体进行试验,给药前24 h停饲,试验期间不投喂饲料。
1.1.3 溶液的配制马波沙星标准储备液:精密称取马波沙星对照品50.50 mg于100 mL棕色容量瓶,用少量0.1 mol·L-1的氢氧化钠溶液助溶,以超纯水定容至刻度,即得到500 μg·mL-1的标准储备液,分装后置-20 ℃冰箱保存(有效期1个月)。
内标(氧氟沙星)溶液:精密称取氧氟沙星对照品10.18 mg于100 mL棕色容量瓶中,以超纯水溶解并定容至刻度,摇匀即成100 μg·mL-1的标准液,分装后置-20 ℃冰箱保存(有效期1个月)。
马波沙星水溶液:称取一定量的马波沙星原料药,用少量0.1 mol·L-1氢氧化钠溶解后,用无菌生理盐水定容于100 mL棕色容量瓶内,使药物质量浓度为10 mg·mL-1,现配现用。
磷酸氢二铵-四丁基溴化铵缓冲液:准确称取4 g四丁基溴化铵、4 g磷酸氢二铵,用800 mL超纯水溶解,用磷酸调pH为2.7,然后用超纯水定容至1 L,经0.22 μm滤膜过滤后,超声脱气30 min,备用。
1.1.4 仪器高效液相色谱仪(Waters-e2695,Separations module)、2475多波长荧光检测器、氮吹仪(N-EVAP112)、高速冷冻离心机(AllegraTM 64R)、涡旋仪(IKA®MS 3 basic)、高速离心机(Sigma,1-15)、纯水机(Synergy UV)。
1.2 方法 1.2.1 给药与采样肌内注射给药:在背鳍与侧线的中部鱼体最厚部位注射马波沙星,剂量按体质量10 mg·kg-1。分别于肌内注射后5、15、30、45 min和1、2、4、6、8、12、16、24、36、48、72、96、120 h从尾静脉无菌采血,同一时间取10尾鱼,每尾鱼仅采1个样品,分别置于预先涂有质量分数为1%肝素钠的离心管中,4 500 r·min-1离心10 min,血浆置-20 ℃条件下冷冻保存,待进行血药质量浓度的测定。
口服给药:纱布绑定鱼体,用1 mL无菌注射器吸取马波沙星水溶液后,弃去针头,连接加长型大鼠灌胃针缓慢地插入罗非鱼前肠并灌入药物,灌药后将鱼体头朝上直立片刻, 无回吐者保留试验,保证给药剂量的准确。给药剂量及取样方法同肌内注射给药。
1.2.2 血浆中马波沙星质量浓度的测定参照Aliabadi等[5]方法略作改动。血浆样品自然解冻后,准确量取500 μL至15 mL塑料离心管中,加入5 μg·mL-1氧氟沙星内标溶液20 μL,旋涡振荡混匀,加入6 mL三氯甲烷,置振荡器上水平振荡30 min,5 000 r·min-1离心10 min后,吸取下层全部有机相于玻璃离心管中,在40 ℃水浴中氮气吹干,残渣用1 mL流动相溶解,12 000 r·min-1离心10 min后,经0.22 μm的一次性针式滤器过滤,取50 μL供HPLC测定。色谱条件:色谱柱为Atlantis C18 (5 μm, 4.6 mm×250 mm);流动相为甲醇与磷酸氢二铵-四丁基溴化铵缓冲液(体积比25:75);激发光波长295 nm,发射光波长500 nm;流速为0.8 mL·min-1;柱温30 ℃,进样量为50 μL。在上述色谱条件下能将马波沙星、氧氟沙星与血浆中的其他成分分开。马波沙星的最低检测限(LOD)为0.003 μg·mL-1,最低定量限(LOQ)为0.01 μg·mL-1。
1.2.3 数据分析药动学数据采用WinNonlin 6.1药动学软件(Pharsight Corporation, Mountain view, CA, USA)提供的非房室模型进行分析。采用SPSS 13.0统计分析软件对试验结果进行方差分析。
2 结果与分析 2.1 血浆中马波沙星质量浓度的测定经本方法测定,马波沙星的绝对回收率为85.73%~91.23%,批内、批间变异系数均小于8%;氧氟沙星的绝对回收率为83.26%~87.42%,批内、批间变异系数均小于4%。标准曲线在0.01~10.00 μg·mL-1范围内,马波沙星与内标的色谱峰面积之比(S)与相对应的药物质量浓度(ρ)有良好的线性关系,线性回归方程为ρ=0.560 4S+0.005,相关系数R2=0.999 8。
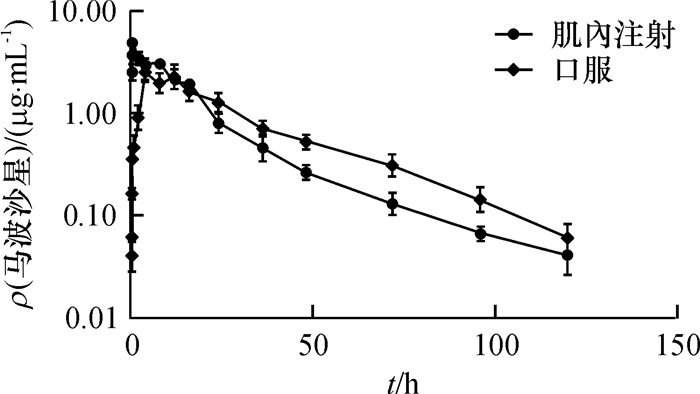
2.2 马波沙星在罗非鱼体内的药动学马波沙星以10 mg·kg-1剂量口服和肌内注射给药后,马波沙星在罗非鱼血浆中的药-时曲线见图 1。马波沙星在罗非鱼血浆中的药动学参数见表 1。肌内注射给药后,马波沙星吸收迅速,达峰时间(tmax)为0.25 h,峰质量浓度(ρmax)为4.31 μg·mL-1。口服给药后,马波沙星吸收比较缓慢,tmax为4.00 h,ρmax为2.45 μg·mL-1。肌内注射和口服给药后,马波沙星在罗非鱼体内分布广泛、清除缓慢,表观分布容积分别为3.94和4.27 L·kg-1,体清除率分别为0.14和0.13 L·h-1·kg-1,较大的表观分布容积和较低的体清除率,使得肌内注射和口服给药后马波沙星在罗非鱼体内的消除半衰期分别长达19.21和22.67 h。
|
图 1 罗非鱼肌内注射和口服10 mg·kg-1马波沙星后血浆中的药-时曲线 Figure 1 The plasma drug concentration-time curve in tilapia following a single intramuscular or oral administration of 10 mg·kg-1 marbofloxacin |
|
|
表 1 罗非鱼单剂量肌内注射和口服10 mg·kg-1马波沙星的药代动力学参数1) Table 1 Pharmacokinetic parameters of marbofloxacin in tilapia following a single intramuscular or oral administration of 10 mg·kg-1 marbofloxacin |
马波沙星以10 mg·kg-1单剂量肌内注射或口服给药后,罗非鱼耐受性良好,试验期间没有出现鱼体死亡和其他明显的不良反应。罗非鱼肌内注射给药后,马波沙星吸收迅速,达峰时间为0.25 h,快于报道中的中华鳖的0.50 h[6]。口服给药后,马波沙星吸收相对缓慢,达峰时间为4.00 h,显著慢于氧氟沙星(0.41 h)[7]和诺氟沙星(0.75 h)[8],也显著慢于鲫鱼的0.78 h[9],然而,据报道马波沙星在中华鳖血清中达峰时间长达8.00 h[6]。
肌内注射和口服给药后,马波沙星在罗非鱼血浆中的消除半衰期分别为19.21和22.67 h,相比其他水产动物及其他药物,其消除半衰期明显长于中华鳖(13.38 h)[6],也明显长于恩诺沙星(17.19 h)[10]、氧氟沙星(7.74 h)[7]和诺氟沙星(16.42 h)[8],但明显短于鲫鱼(25.05 h)[9]。药物在不同种类水产动物体内消除半衰期的差异,可能是由于水产动物解剖学上的体积差异、药物与血浆蛋白和组织结合的差异[11-12]以及生存环境温度的差异所致[13-14]。药物在水产动物体内代谢与消除规律十分复杂,针对特定药物开展其在不同养殖动物体内的药动学研究非常必要。
肌内注射和口服给药后,马波沙星在罗非鱼体内的表观分布容积高达3.94和4.27 L·kg-1, 表明马波沙星组织渗透能力很强,能够在罗非鱼体内广泛分布。这与之前在中华鳖体内的报道比较一致,肌内注射和口服给药后马波沙星在中华鳖体内的表观分布容积分别为2.43和4.66 L·kg-1[6]。
3.2 马波沙星临床给药方案的制定合理给药方案的制定,需将药动学和药效学数据结合起来。本试验中马波沙星以10 mg·kg-1剂量肌内注射和口服给药后,罗非鱼血浆中马波沙星的平均质量浓度在24 h内均超过了0.5 μg·mL-1,该浓度超过或接近大多数致病菌的MIC90(MIC90为抑制90%细菌所需要的最低药物浓度)。据报道,马波沙星对气单孢菌的MIC90为0.2 μg·mL-1[3];马波沙星对金黄色葡萄球菌Staphylococcus aureus的MIC90为0.21 μg·mL-1,马波沙星对肠杆菌科(Enterobacteriaceae)细菌的最小抑菌浓度(MIC)为0.008~0.030 μg·mL-1[15];马波沙星对临床分离的鸡、猪大肠埃希菌Escherichia coli, 鸭李氏杆菌Listeriose, 猪链球菌Streptococcus suis和金黄色葡萄球菌很敏感, MIC均小于0. 5 μg·mL-1[16]。和其他氟喹诺酮类药物一样,马波沙星是浓度依赖性药物,与马波沙星药效相关性最强的PK/PD参数为AUC/MIC[17]。为了达到治疗效果和避免耐药性的产生,氟喹诺酮类药物的AUC/MIC比值需在125~250[18]。本试验中,当MIC=0.5 μg·mL-1,肌内注射和口服给药后血浆中马波沙星AUC/MIC分别为143.30和154.72。数据表明10 mg·kg-1马波沙星能够有效治疗大多数敏感菌引起的罗非鱼感染。
| [1] |
邱银生, 吴佳. 动物专用氟喹诺酮类药物研究进展简介[J]. 中国兽药杂志, 1998, 32(3): 46-48. (  0) 0) |
| [2] |
李晖, 李健, 张喆, 等. 麻保沙星对主要海洋致病性弧菌的体外抗菌活性及抗菌后效应[J]. 中国水产科学, 2010, 17(1): 97-102. (  0) 0) |
| [3] |
王志强, 朱琳. 动物专用氟喹诺酮类药物对嗜水气单胞菌与温和气单胞菌的抗菌活性[J]. 中兽医医药杂志, 2005, 24(2): 34-36. (  0) 0) |
| [4] |
FITTON A. The quinolones :An overview of their pharmacology[J]. Clin Pharmacokinet, 1992, 22(S1): 1-11. (  0) 0) |
| [5] |
ALIABADI F S, LEES P. Pharmacokinetics and pharmacokinetic/pharmacodynamic integration of marbofloxacin in calf serum, exudate and transudate[J]. J Vet Pharmacol Thers, 2002, 25(3): 161-174. DOI:10.1046/j.1365-2885.2002.00399.x (  0) 0) |
| [6] |
SHAN Q, ZHENG G, LIU S, et al. Pharmacokinetic/pharmacodynamic relationship of marbofloxacin against Aeromonas hydrophila in Chinese soft-shelled turtles (Trionyx sinensis)[J]. J Vet Pharmacol Ther, 2015, 38(6): 537-542. DOI:10.1111/jvp.2015.38.issue-6 (  0) 0) |
| [7] |
王贤玉, 宋洁, 王伟利, 等. 氧氟沙星在吉富罗非鱼体内的药代动力学及残留的研究[J]. 大连海洋大学学报, 2011, 26(2): 144-148. (  0) 0) |
| [8] |
朱泽尧, 张其中, 于相满, 等. 盐酸诺氟沙星在奥尼罗非鱼体内的药动学研究[J]. 淡水渔业, 2008, 38(1): 30-34. (  0) 0) |
| [9] |
ZHU Y L, TAN Y P, WANG C M, et al. Pharmacokinetics and tissue residues of marbofloxacin in crucian carp (Carassius auratus) after oral administration[J]. Aquac Res, 2009, 40(6): 696-709. DOI:10.1111/are.2009.40.issue-6 (  0) 0) |
| [10] |
徐维海, 林黎明, 朱校斌, 等. 恩诺沙星及其代谢产物在吉富罗非鱼、中国对虾体内的残留规律研究[J]. 水产科学, 2004, 23(7): 5-8. (  0) 0) |
| [11] |
BARRON M G, GEDUTIS C, JAMES M O. Pharmacokinetics of sulphadimethoxine in the lobster, Homarus americanus, following intrapericardial administration[J]. Xenobiotica, 1988, 18(3): 269-276. DOI:10.3109/00498258809041663 (  0) 0) |
| [12] |
OIE S, TOZER T N. Effect of altered plasma protein binding on apparent volume of distribution[J]. J Pharm Sci, 1979, 68(9): 1203-1205. DOI:10.1002/jps.2600680948 (  0) 0) |
| [13] |
GEORGE R, ALEXIS M, ANDRIOPOULOU A, et al. Temperature-dependent pharmacokinetics and tissue distribution of oxolinic acid in sea bass, Dicentrarchus labrax L[J]. Aquac Res, 2002, 33(14): 1175-1181. DOI:10.1046/j.1365-2109.2002.00783.x (  0) 0) |
| [14] |
肖贺, 王伟利, 姜兰, 等. 不同温度下复方磺胺嘧啶在罗非鱼体内的药代动力学[J]. 华南农业大学学报, 2014, 35(6): 13-18. DOI:10.7671/j.issn.1001-411X.2014.06.003 (  0) 0) |
| [15] |
BOUSQUET-MELOU A, BERNARD S, SCHNEIDER M, et al. Pharmacokinetics of marbofloxacin in horses[J]. Equine Vet J, 2002, 34(4): 366-372. (  0) 0) |
| [16] |
张玲玲, 潘安, 郭宽, 等. 国产麻保沙星的毒性及体外抗菌活性研究[J]. 西北农林科技大学学报(自然科学版), 2009, 37(7): 16-22. (  0) 0) |
| [17] |
CAO C, QU Y, SUN M, et al. In vivo antimicrobial activity of marbofloxacin against Pasteurella multocida in a tissue cage model in calves[J]. Front Microbiol, 2015, 6: 759. (  0) 0) |
| [18] |
MARTINEZ M, MCDERMOTT P, WALKER R. Pharmacology of the fluoroquinolones: A perspective for the use in domestic animals[J]. Vet J, 2006, 172(1): 10-28. DOI:10.1016/j.tvjl.2005.07.010 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


