2. 吉林农业大学 生命科学学院,吉林 长春 130118
2. College of Life Science, Jilin Agricultural University, Changchun 130118, China
磷是作物所必需的大量营养元素,在光合作用、能量转移、信号转导及大分子物质的生物合成几大代谢中都起着关键作用[1]。我国有74%的耕地土壤缺磷[2],可溶性磷肥施入农田后,由于土壤的固定等作用,大部分迅速转变为作物难以吸收的无效磷,导致作物对施入磷肥的当季利用率不超过30%[3-4]。土壤中溶磷微生物能依靠自身的代谢产物或与其他生物协同作用[5],将难溶性磷转变成植物可吸收利用的磷形式,能显著提高土壤中有效磷的含量,减少土壤对磷酸盐的吸附固定,被公认为能够安全、高效地活化土壤难溶磷。Hariprasad等[6]研究发现,接种溶磷菌剂,可增加作物的鲜质量、干质量、株高、根长以及吸收磷量和根际土壤有效磷含量。冯瑞章等[7]研究表明,接种溶磷菌能显著提高燕麦地上部分和地下部分生物量,可促进植株氮、磷的吸收。但研究发现分离筛选获得的溶磷微生物在实验室条件下都具有较好的溶磷效果,但将它们接入土壤后则溶磷作用减弱甚至消失[8]。因此,筛选具有高效、稳定溶磷能力的溶磷菌具有重要的意义。
溶磷菌在不同土壤类型、不同作物根际及不同土壤环境条件下的分布有所不同,其群落结构较为复杂[9]。小麦根际溶磷菌主要为洋葱假单胞菌属Pseudomonas cepacia和埃希氏菌属Escherichia[10];玉米根际溶磷微生物主要是欧文氏菌属Erwinia[11-12];大豆根际主要为假单胞菌属Pseudomonas、不动杆菌Acinetobacter pittiistrain和克雷伯氏菌属Klebsiella[13-14]。水稻由于长期处于水环境下,其根际溶磷菌与其他作物根际表现不同,有研究表明主要为芽孢杆菌属Bacillus和土壤单胞菌属Agromonas[15]。本试验从吉林省水稻种植区采样,分离筛选获得2株具有明显溶磷酸盐能力的菌株,对2株菌株溶磷能力及其对水稻植株和根际土壤磷含量的影响进行了研究,旨在为明确吉林省生态条件下水稻根际优势溶磷菌的分布提供数据支持,为生物菌肥的研制提供优良菌株。
1 材料与方法 1.1 供试土壤、培养基及营养液 1.1.1 供试土壤从吉林农业大学水稻试验田(43°53′N, 125°10′E)采集水稻根际土壤,用塑料袋装好密封带回,放置4 ℃冰箱保存。盆栽试验供试土壤采自吉林农业大学水稻试验田,土壤基本农化性质为:有机质质量分数为2.21 %,有效氮147 mg·kg-1,速效磷19 mg·kg-1,速效钾75 mg·kg-1。将细沙过2 mm筛子,用清水将细沙上的土洗净,之后用质量分数为1 %的盐酸浸泡24 h,再用清水洗细沙直到呈中性,放在干燥箱中烘干,并在烘箱中160 ℃灭菌4 h备用。
1.1.2 培养基基础培养基(LB):蛋白胨10 g,酵母浸提液5 g,NaCl 10 g,去离子水1 000 mL,pH 7.2~7.4,121 ℃灭菌20 min。无机磷基础培养基:采用国际植物研究所磷酸盐生长培养基(NBRIP),其成分为:葡萄糖10 g,Ca3(PO4)2 5 g,MgCl2 5 g,MgSO4 0.25 g,KCl 0.2 g,(NH4)2 SO4 0.1 g,蒸馏水1 000 mL,pH 7.0,115 ℃灭菌30 min。
1.1.3 营养液营养液参照国际水稻研究所(IRRI)水稻营养液配方配制[16]: K2SO4、CaCl2、NaH2PO4·2H2O、NH4NO3、MgSO4·7H2O、Fe-EDTA和NaSiO3分别为0.32、0.5、0.16、0.715、0.83、0.036和0.1 mmol·L-1,MnCl2、ZnSO4·7H2O、CuSO4、H3BO3和H2MoO4分别为4.55、0.077、0.078、25和0.263 μmol·L-1。
1.2 溶磷菌菌株的分离和鉴定 1.2.1 溶磷菌的分离纯化用灭菌小刀将附着在水稻根表面的土壤刮下。取1 g土置于装有50 mL无菌水的三角瓶中振荡1 h,之后静置10 min。然后取1 mL上清液经梯度稀释后涂布于固体NBRIP培养基上置于30 ℃条件下培养3 d后计数,然后挑取不同形态的、具有溶磷圈的单菌落,于NBRIP培养基上划线纯化;纯化3次,直至无杂菌长出。纯化后的菌株接入液体NBRIP培养基、于30 ℃下振荡培养,至对数期后进行菌种保存及后续试验。
1.2.2 溶磷菌的溶磷圈鉴定对筛选得到的2株细菌分别用接种环挑取单菌落均匀涂到NBRIP固体培养基平板中间,在30 ℃下培养7 d,观察每个菌株的溶磷圈的情况,测量并拍照。
1.2.3 溶磷菌总DNA提取及16S rDNA序列分析利用LB液体培养基培养细菌,离心后收集菌体,细菌DNA的提取参照文献[17]进行。利用16S rDNA的PCR反应通用引物[18](上游引物为27F: 5′-AGAGTTTGATCATGGCTCAG-3′; 下游引物为1492R: 5′-TACGGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR扩增反应体系(50 μL):EasyTaq buffer 5 μL, 2.5 mmol·L-1 dNTPs 4 μL,20 μmol·L-1引物各2 μL,DNA模板1μL,EasyTaq酶0.3 μL,用无菌水补足至50 μL体积。PCR反应条件为:98 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸120 s,进行30个循环; 72 ℃延伸8 min。PCR产物送至上海生工生物公司测序。利用Blast软件在GenBank中与其他的16S rDNA序列进行同源性比较,选择相似性较高的序列利用MEGA 5.0软件构建菌株的16S rDNA系统树。
1.3 溶磷菌的溶磷条件优化 1.3.1 单因素试验以NBRIP培养基为基础,对不同碳源(葡萄糖、α-乳糖、甘露糖、麦芽糖、蔗糖)、氮源(硫酸铵、硝酸铵、牛肉膏、蛋白胨、尿素)及初始pH(5、6、7、8、9)进行单因子试验。液体培养基100 mL分装在250 mL三角瓶中备用。挑取溶磷菌单菌落接种于5 mL LB培养基中,D600 nm=0.5时以φ为0.5%接种至液体培养基中,以接种无菌水的培养基作对照,30 ℃,150 r·min-1摇床培养4 d,每隔12 h取样1次, 测定培养基上清液中可溶性磷含量,3次重复,确定较优的碳源、氮源及初始pH。
1.3.2 正交试验选择菌株生长及溶磷量增加最显著的时间(24 h)进行碳源、氮源及初始pH的正交试验,重复3次。
1.3.3 溶磷量测定吸取2 mL菌液,10 000 r·min-1、4 ℃离心10 min,钼蓝比色法测定其含磷量,计算供试菌株的溶磷量。
1.4 菌株产IAA的鉴定及植物促生试验 1.4.1 菌株产IAA的鉴定参照文献[19]的方法。
1.4.2 水稻种子处理及溶磷菌菌液的制备水稻种子吉农大809由吉林农业大学水稻研究所提供,选择籽粒饱满均匀的种子浸种2 d,然后用φ为75%的乙醇溶液处理2 min,再用30 g·L-1的次氯酸钠表面灭菌10 min,用无菌水反复冲洗后,将种子放于装有湿润滤纸的无菌平板上37 ℃倒置催芽12 h,待露白后30 ℃催芽12 h备用。
溶磷菌菌液的制备:挑取溶磷菌单菌落接种于5 mL液体LB培养基中过夜培养,以φ为0.5%接种于100 mL液体LB培养基中,置于摇床,30 ℃, 150 r·min-1条件下进行培养,待菌液D600 nm为0.6~0.8时,将菌液稀释成108 cfu·mL-1菌悬液备用。
1.4.3 盆栽试验盆栽试验分沙培和土培,参照文献[20]的方法进行。沙培设置2个对照:CK1[不加Ca3(PO4)2;加全磷营养液],CK2[加Ca3(PO4)2和无磷营养液]。2个处理:加Ca3(PO4)2和无磷营养液、接种菌株NDW1;加Ca3(PO4)2和无磷营养液、接种菌株NDW3。土培设置2个对照:CK1[不加Ca3(PO4)2],CK2[加Ca3(PO4)2]。2个处理:加Ca3(PO4)2、接种菌株NDW1;加Ca3(PO4)2、接种菌株NDW3。Ca3(PO4)2与灭菌河沙(或稻田土壤)以φ为0.12%的比例充分混合后装盆备用。每个塑料盆钵(12 cm×12 cm)装灭菌河沙1 000 g、稻田土壤600 g,每盆种植水稻苗10株,每粒发芽水稻种子下加入108 cfu溶磷菌,重复5次。置培养箱培养,光照16 h, 28 ℃,黑暗8 h, 25 ℃,沙培水稻苗用不含可溶性磷的水稻营养液进行浇灌,土培水稻苗用自来水浇灌。在水稻生长20 d后测定水稻生物量及各指标含量。
1.4.4 指标测定株高、叶长、根长采用直接测量法。植株生物量测定方法为:将鲜样在105 ℃下杀青30 min,75 ℃烘干至恒质量后称其干质量。
1.5 土壤速效磷和植物全磷测定称取风干后的土样和沙样5 g,放入50 mL三角瓶中,用Olsen法[21]测定土壤速效磷。植株全磷测定方法为H2SO4-H2O2消煮-钒钼黄比色法[22]。
1.6 数据分析与处理数据采用DPS 7.5及Microsoft Office Excel 2003, 利用Duncan’s新复极差法进行多重比较,取数据平均值和标准差用于结果分析。
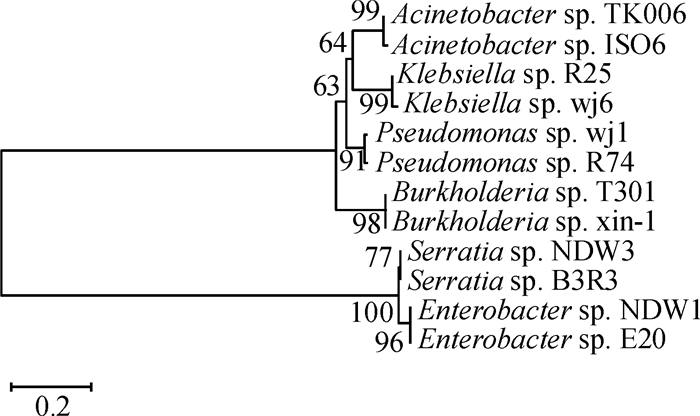
2 结果与分析 2.1 溶磷菌的分离与鉴定从水稻根际土壤中, 经多次分离纯化获得具有较强溶解Ca3(PO4)2能力的2株细菌,命名为NDW1、NDW3。2株溶磷菌在NBRIP培养基上产生明显的溶磷圈,如图 1所示。为了进一步明确溶磷菌株的特性,分别提取了2株菌株的基因组DNA,进行16S rDNA鉴定。选取Acinetobacter sp.、Burkholderia sp.、Enterobacter sp.、Klebsiella sp.、Pseudomonas sp.和Serratia sp.等菌属的16S rDNA序列,利用Bioedit软件进行核酸序列比对,利用MEGA 5.0的Neighbour-joining (NJ)以Maxium Composite Likelihood模型构建进化树,Bootstrap值为1 000,结果见图 2。从图 2可以看出菌株NDW1与Enterobacter sp.E20(基因登录号为:CP012999.1)形成一个分支且支持率为96%,初步鉴定菌株NDW1为Enterobacter sp.。菌株NDW3与Serratia marcescens strain B3R3(基因登录号为:CP013046.1)聚在一个分支且支持率为77%,初步鉴定菌株NDW3为Serratia sp.。

|
图 1 菌株NDW1和NDW3溶磷效果 Figure 1 Phosphate solubilizing effects of bacteria NDW1 and NDW3 |
|
图 2 基于菌株NDW1、NDW3和其他溶磷菌16S rDNA序列构建的系统发育树 Figure 2 Phylogeny tree of 16S rDNA sequences from NDW1, NDW3 and other phosphoate solubilizing strains |
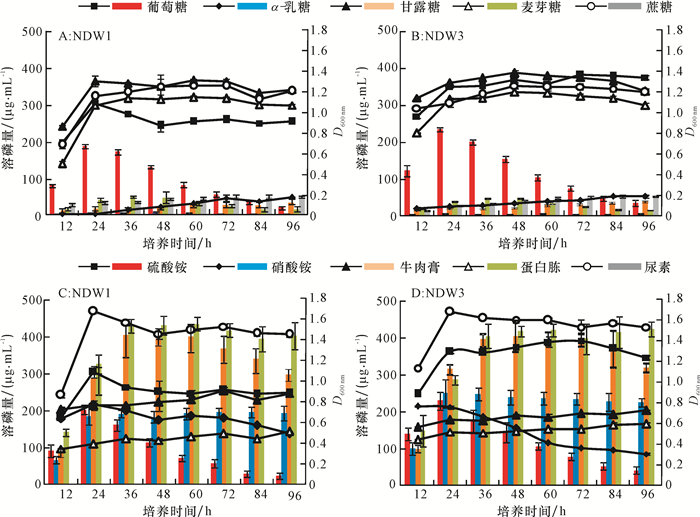
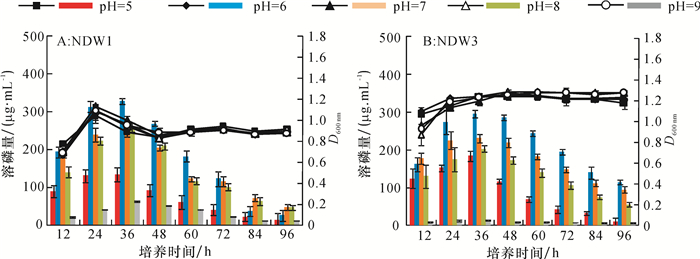
为了明确不同的碳源、氮源及初始pH对两菌株溶磷的影响,每个因素设置5个水平,测定了96 h内不同单因素水平下各菌株的溶磷量。各种碳源条件下,菌株NDW1和NDW3的溶磷特点如图 3A和3B所示,2个菌株在以葡萄糖为碳源时,24 h溶磷量均达到最高,且72 h内溶磷效果要明显优于其他4种碳源,2个菌株在24 h后的生长变得缓慢。菌株NDW1和NDW3在以尿素为氮源时溶磷量为0。在以牛肉膏和蛋白胨为氮源时溶磷量明显高于硫酸铵和硝酸铵,蛋白胨优于牛肉膏,且36 h后都能维持较高的溶磷量(图 3C,3D)。氮源对菌株生长量的影响较明显,尿素和硫酸氨条件下生长都要好于其他氮源。在初始pH 5~9的培养基中,菌株NDW1都具有一定的溶磷量,NDW3在初始pH 9时溶磷量接近0,2株菌株在初始pH 6时溶磷量均较高,且36 h时达到最大值。5个初始pH对2株菌株生长影响不明显。
|
图 3 不同碳源、氮源对菌株溶磷量和生长的影响 Figure 3 Effect of different carbon sources and nitrogen sources on phosphorus contents dissolved by bacteria strains and bacterial growth 柱状图为菌株溶磷量,折线图为菌液光密度。 |
|
图 4 不同pH对菌株溶磷量和生长的影响 Figure 4 Effect of different pH values on phosporus contents dissolved by bacteria strains and bacterial growth 柱状图为菌株溶磷量,折线图为菌液光密度。 |
根据单因素水平试验结果,分别选择3个碳源(葡萄糖、麦芽糖、蔗糖)、氮源(牛肉膏、蛋白胨、硝酸铵)及初始pH(5、6、7)进行正交试验。结果(表 1)表明,在各因素之间,按照对溶磷水平的影响表现为碳源>初始pH >氮源。正交试验方差分析结果表明,碳源对NDW1菌株溶磷的影响达到显著水平(F=39.56,P=0.025),碳源对NDW3菌株溶磷的影响达到极显著水平(F=105.88,P=0.01),氮源和初始pH影响不显著。菌株NDW1和NDW3溶磷的最佳组合均为葡萄糖、蛋白胨及初始pH 6,两菌株24 h内最高溶磷量分别为294.95和312.93 μg·mL-1。
|
|
表 1 菌株溶磷的正交试验结果1) Table 1 Results of the orthogonal test of phosphate solubilizing by bacteria strains |
菌株NDW1和NDW3产IAA能力测定结果如表 2所示:菌株NDW1和NDW3都有显色反应,不含色氨酸King培养液与加入100 mg·L-1色氨酸的King培养液相比较,后者比色液较前者颜色明显,说明含有色氨酸的King培养液能明显增加2株溶磷菌IAA的合成量;在培养10天后,NDW1和NDW3在不含有色氨酸的King培养液中的IAA浓度分别为不含有色氨酸King培养液中IAA浓度的2.21和2.80倍。菌株NDW3的IAA分泌量较高于菌株NDW1。
|
|
表 2 溶磷菌产IAA的测定 Table 2 Measurements of IAA production of two phosphorus solubilizing strains |
为了进一步确定溶磷菌NDW1和NDW3在土壤中的溶磷能力及其对水稻的促生作用,利用沙培和土培的方法研究了菌株对苗期水稻的促生作用。从表 3可以看出,添加溶磷菌NDW3后,2种种植条件下对水稻株高和最大叶长有显著的促进作用,土培条件下根长、地上干质量差异显著,沙培条件无明显的促进作用,地下干质量及叶绿素含量与CK1表现出显著差异。菌株NDW1在沙培与土培条件下尽管对水稻具有一定的促生能力,但与CK间差异不显著,其促生作用弱于NDW3。
|
|
表 3 不同处理对水稻幼苗性状的影响1) Table 3 Effects of different treatments on traits of rice seedlings |
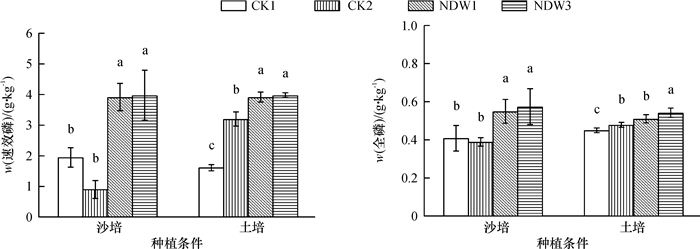
添加2种溶磷菌后对水稻根际土壤速效磷含量及苗期植株全磷含量的测定结果如图 5所示。沙培和土培条件下,添加溶磷菌可明显促进根际土壤速效磷含量的增加,处理与CK间差异显著。沙培条件下,添加溶磷菌可显著促进水稻植株全磷含量的增加。土培条件下,添加溶磷菌NDW3,可显著促进水稻植株全磷含量的增加;添加NDW1植株全磷含量增加效果不明显。
|
图 5 不同处理对水稻根际土壤速效磷含量及幼苗全磷含量的影响 Figure 5 Effects of different treatments on soil available phosphorus contents and total phosphorus contents of rice seedlings 沙培条件下,CK1:加全磷营养液,CK2:加Ca3(PO4)2和无磷营养液;土培条件下,CK1:不加Ca3(PO4)2,CK2:加Ca3(PO4)2; 2种种植条件下,NDW1和NDW3处理分别在CK2处理的基础上接种相应菌株。相同种植条件不同柱子上相同小写字母表示不同处理间差异不显著(P>0.05, Duncan’s法)。 |
溶磷微生物自1903年被发现和报道以来,这类微生物的研究及其在农业方面的应用越来越广泛。碳源对溶磷细菌的生存能力以及溶磷能力有不同的影响[23],而土地利用方式可显著影响土壤有机碳与无机碳储量[24]。本研究从吉林农业大学水稻试验田采集的水稻根际土壤中分离到2株溶磷能力较好的细菌菌株NDW1和NDW3,经16S rDNA鉴定,分别为肠杆菌Enterobacter sp.和沙雷氏菌Serratia sp.。正交试验表明:菌株NDW1和NDW3在葡萄糖、蛋白胨及初始pH 6的NBRIP培养基中溶磷量能力最佳,24 h内溶磷量可分别达到294.95和312.93 μg·mL-1,明显高于戴沈艳等[25]报道的溶磷菌的溶磷量, 略低于菌株C5-A对磷矿粉的溶磷量[26]。
溶磷菌大多具有促进作物生长、提高作物产量、抗病的能力[27]。将2株溶磷微生物施入冬小麦土壤中,植物磷含量、光合速率、穗粒数及产量增加,增产幅度分别为14.2%和8.7%[28]。胡晓峰等[29]报道菌株P1不仅对Ca3(PO4)2、磷矿粉和卵磷脂有较好的溶解效果,对一些土传病害病原菌也有抑制作用。多数研究者认为溶磷菌对植物的促生作用是由于其释放土壤中难溶性或不溶性磷,有效提高土壤供磷水平及磷肥利用率的原因,也有人认为有的溶磷微生物可分泌生长调节物质,促进根系生长[30]。本研究发现溶磷菌NDW1和NDW3不仅具有分泌IAA的能力,在沙培和土培条件下对水稻都有一定的促生作用,尤其NDW3对水稻株高、根长、最大叶长及地上干质量的增加有相对明显的促进作用,且添加至土壤中有利于土壤速效磷含量及苗期水稻全磷含量的增加。郑文波等[31]和谯天敏等[32]的研究均表明同时接种不同的溶磷菌菌株均可促进植株生长,与对照相比植株株高、干质量和干鲜比均有较大幅度增加,叶绿素和植株全磷也有显著增加,这与本文的研究结果大体一致。沙培条件下,添加溶磷菌NDW1和NDW3均可明显促进水稻植株全磷含量的增加;而土培条件下只有溶磷菌NDW3对水稻植株全磷含量具有增加效应。这可能是因为沙培条件下只有溶磷菌NDW1或NDW3一种菌落,环境条件对它们的溶磷能力影响较小。而土培时,土壤的理化性质及微生物群落对两菌株的影响不同,菌株NDW3受影响较小,溶磷能力仍表现出一定优势。
| [1] |
KHAN M S, ZAIDI A, AHEMAD M, et al. Plant growth promotion by phosphate solubilizing fungi-current perspective[J]. Arch Agron Soil Sci, 2010, 56(1): 73-98. DOI:10.1080/03650340902806469 (  0) 0) |
| [2] |
胡莹莹, 张民, 宋付朋. 控释复肥中磷素在马铃薯上的效应研究[J]. 植物营养与肥料学报, 2003, 9(2): 174-177. DOI:10.11674/zwyf.2003.0208 (  0) 0) |
| [3] |
SHARMA S B, SAYYED R Z, TRIVEDI M H, et al. Phosphate solubilizing microbes: Sustainable approach for managing phosphorus deficiency in agricultural soils[J]. Springer Plus, 2013, 2(1): 587-601. DOI:10.1186/2193-1801-2-587 (  0) 0) |
| [4] |
谢亚萍, 李爱荣, 闫志利, 等. 不同供磷水平对胡麻磷素养分转运分配及其磷肥效率的影响[J]. 草业学报, 2014, 23(1): 158-166. DOI:10.11686/cyxb20140119 (  0) 0) |
| [5] |
刘聪, 林维, 孙珑, 等. 黑土区林地土壤高效解磷细菌的分离、筛选及其解磷效果[J]. 东北林业大学学报, 2013, 41(11): 83-86. DOI:10.3969/j.issn.1000-5382.2013.11.020 (  0) 0) |
| [6] |
HARIPRASED P, NIRANJANA S R. Isolation and characterization of phosphate solubilizing rhisobacteria to improve plant health of tomato[J]. Plant Soil, 2009, 316(1/2): 13-24. (  0) 0) |
| [7] |
冯瑞章, 姚拓, 周万海, 等. 溶磷菌对燕麦生物量及植株氮、磷含量的影响[J]. 水土保持学报, 2009, 23(2): 188-192. (  0) 0) |
| [8] |
AHMAD F, AHMAD I, KHAN M S. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J]. Microbiol Res, 2008, 163(2): 173-181. DOI:10.1016/j.micres.2006.04.001 (  0) 0) |
| [9] |
臧威, 孙剑秋, 王鹏, 等. 东北地区四种农作物根际磷细菌的分布[J]. 中国生态农业学报, 2009, 17(6): 1206-1210. (  0) 0) |
| [10] |
MADER P, KAISER F, ADHOLEY A, et al. Inoculation of root microorganisms for sustainable wheat rice and wheat black gram rotations in India[J]. Soil Biol Biochem, 2011, 43(3): 609-619. DOI:10.1016/j.soilbio.2010.11.031 (  0) 0) |
| [11] |
赵小蓉, 林启美. 小麦根际与非根际解磷细菌的分布[J]. 华北农学报, 2001, 16(1): 111-115. (  0) 0) |
| [12] |
赵小蓉, 林启美. 玉米根际与非根际解磷细菌的分布[J]. 生态学杂志, 2001, 20(6): 62-64. (  0) 0) |
| [13] |
LIU Z, LI Y, ZHANG S, et al. Characterization of phosphate-solubilizing bacteria isolated from calcareous soils[J]. Appl Soil Ecol, 2015, 96: 217-224. DOI:10.1016/j.apsoil.2015.08.003 (  0) 0) |
| [14] |
刘江, 谷洁, 高华, 等. 秦岭山区无机磷细菌筛选及其Biolog和分子生物学鉴定[J]. 干旱地区农业研究, 2012, 30(1): 184-189. (  0) 0) |
| [15] |
陶涛, 叶明, 刘冬, 等. 无机解磷细菌的筛选、鉴定及其溶磷能力研究[J]. 合肥工业大学学报, 2011, 34(2): 304-308. (  0) 0) |
| [16] |
杨春武. 虎尾草和水稻抗碱机制研究[D]. 长春: 东北师范大学, 2010.
(  0) 0) |
| [17] |
AUSUBEL F, BRENT R, KINGSTON R E, et al. Short protocols in molecular biology[M]. 3 ed. Hoboken: John Wiley & Sons Inc, 1995.
(  0) 0) |
| [18] |
BAKERMANS C, MADSEN E. Diversity of 16S rDNA and naphthalene dioxygenase genes from coal-tar-waste-contaminated aquifer waters[J]. Microb Ecol, 2002, 44(2): 95-106. (  0) 0) |
| [19] |
MEHNAZ S, LAZAROVITS G. Inoculation effects of Pseudomonas putida, Gluconacetobacter azotocaptans, and Azospirillum lipoferum on corn plant growth under greenhouse conditions[J]. Microb Ecol, 2006, 51(3): 326-335. DOI:10.1007/s00248-006-9039-7 (  0) 0) |
| [20] |
冯月红, 姚拓, 龙瑞军. 土壤解磷菌研究进展[J]. 草原与草坪, 2003(1): 3-7. (  0) 0) |
| [21] |
鲍士旦. 土壤农化分析[M]. 2000, 83-86.
(  0) 0) |
| [22] |
赵月华. 植株全磷测定方法[J]. 科技与管理, 2012, 391(2): 64. (  0) 0) |
| [23] |
KUNDU B S, GAUR A C. Inoculant carriers for phosphate-solubilizing micro-organisms[J]. Indian J Agr Sci, 1981, 51(4): 252-255. (  0) 0) |
| [24] |
祖元刚, 李冉, 王文杰, 等. 我国东北土壤有机碳、无机碳含量与土壤理化性质的相关性[J]. 生态学报, 2011, 31(18): 5207-5216. (  0) 0) |
| [25] |
戴沈艳, 贺云举, 申卫收, 等. 1株高效解磷细菌的紫外诱变选育及其在红壤稻田施用效果[J]. 生态环境学报, 2010, 19(7): 1646-1652. (  0) 0) |
| [26] |
刘文干, 何园球, 张坤, 等. 1株红壤溶磷菌的分离、鉴定及溶磷特性[J]. 微生物学报, 2012, 52(3): 326-333. (  0) 0) |
| [27] |
HAMEEDA B, REDDY Y, HARISH K R. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna[J]. Curr Microbiol, 2006, 53(4): 298-302. DOI:10.1007/s00284-006-0004-y (  0) 0) |
| [28] |
周毅, 汪建飞, 邢素芝, 等. 解磷微生物有机肥对冬小麦产量形成的影响[J]. 麦类作物学报, 2013, 33(3): 526-529. DOI:10.7606/j.issn.1009-1041.2013.03.021 (  0) 0) |
| [29] |
胡晓峰, 郭晋云, 张楠, 等. 1株溶磷抑病细菌的筛选及其溶磷特性[J]. 中国农业科学, 2010, 43(11): 2253-2260. DOI:10.3864/j.issn.0578-1752.2010.11.008 (  0) 0) |
| [30] |
XIE H, PASTERNAK J J, GLICK B R. Isolation and characterization of mutants of the plant growth-promoting rhizobacterium Pseudomonas putida GR12-2 that over produce indoleacetic acid[J]. Curr Microbiol, 1996, 32(2): 67-71. DOI:10.1007/s002849900012 (  0) 0) |
| [31] |
郑文波, 申飞, 闫小梅, 等. 红壤中产吲哚乙酸并具解磷作用的促生菌筛选鉴定及促生效果研究[J]. 土壤, 2015, 47(2): 361-368. (  0) 0) |
| [32] |
谯天敏, 李姝江, 韩珊, 等. 温哥华假单胞菌菌株PAN4解磷能力及对核桃的促生作用[J]. 华南农业大学学报, 2015, 36(5): 117-124. DOI:10.7671/j.issn.1001-411X.2015.05.020 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


