盐酸氯苯胍(Robenidine hydrochloride)是一种人工合成抗球虫药[1],分子式为C15H13Cl2N5·HCl,相对分子质量为370.66,在结构上属于胍基衍生物[2]。该药于20世纪70年代初在美国上市并作为饲料添加剂被广泛使用,主要用于预防和治疗鸡的急球虫感染,对柔嫩艾美耳球虫、毒害艾美耳球虫、堆型艾美耳球虫、布氏艾美耳球虫、变位艾美耳球虫等均有效果[3],具有毒性低、疗效高[4]、抗虫谱广、成本低等优点。同时,该药物被证明具有轻微的促进营养吸收作用[5]。我国批准用于禽、危球虫病的预防和治疗[1]。目前该药物的研究集中于药物残留检测方法[6-7]和提取方法[8-9],靶动物的药动学及生物利用度鲜见报道。本文对健康兔内服与静脉注射盐酸氯苯胍的药动学进行研究,以期丰富相关研究数据,并为盐酸氯苯胍残留的相关标准制定提供依据。
1 材料与方法 1.1 材料 1.1.1 试验动物16只健康新西兰大白兔,公母各半,购自南方医科大学实验动物中心,体质量为(2.00±0.20) kg。试验前于代谢笼中饲养观察7 d,自由饮水采食。将16只兔随机分为2组,每组8只,第1组于左耳静脉注射给药,剂量为2 mg·kg-1;第2组单次内服给药,剂量为100 mg·kg-1(兽药使用指南内服推荐剂量为10~15 mg·kg-1)。给药前12 h及给药后3 h禁食,仅可饮水。
1.1.2 药品与试剂盐酸氯苯胍标准品(w为99.8%,批号H0041110,对照),购自中国兽医药品监察所;盐酸氯苯胍原料药(经测定w为90.30%),由广州绿州生物技术有限公司提供;乙酸、乙酸乙酯、三氯甲烷、三乙胺和磷酸二氢铵,均为分析纯(天津市大茂化学试剂厂);甲醇、乙腈和甲酸,均为色谱纯(Sigma公司)。
1.1.3 试验仪器高效液相色谱仪:含二联泵、脱气泵、色谱工作站、紫外检测器、自动进样器,LC-20A型,日本岛津公司;电子分析天平:岛津AUW120D型,精度0.001 mg,日本岛津公司,超纯水系统:Milli-Q型,美国Millipore公司;高速冷冻离心机:Avanti® J-26 XP型,美国Beckman-Coulter公司;台式冷冻离心机:LEGEND Mach1.6R型,ThermoFisher德国Sorvall公司;pH计:pHs-25型,上海精科雷磁仪器厂;旋涡振荡器:HS250 Basic型,马来西亚IKA公司。
1.2 方法 1.2.1 溶液的配制1) 储备液:精密称取11.11 mg的盐酸氯苯胍标准品于10 mL棕色容量瓶中,用色谱甲醇溶解,制成含氯苯胍1 000 μg·mL-1的标准储备液。放入4 ℃冰箱保存。2) 注射液:定量称取盐酸氯苯胍原料药,用体积分数为40%的N, N-二甲基乙酰胺水溶液稀释成4 mg·mL-1的注射液,现配现用。3)0.05 mol·L-1的磷酸二氢铵缓冲液:称取磷酸二氢铵5.75 g,于1 000 mL的容量瓶定容,用三乙胺调节pH至6.8。
1.2.2 给药及采样静脉注射组于左耳耳缘静脉注射给药,在给药前(0 h)采集空白样品并在给药后的0.167、0.250、0.5、1.0、1.5、2、3、4、6、8、12、16、24 h分别从右耳采集血液样品。内服组混饲给药,在给药前(0 h)采集空白样品并在给药后的1、2、3、4、5、6、7、8、9、10、11、12、16、24、36、48、72、96 h分别从双耳采集血液样品。采集血液置于肝素钠抗凝管中,混匀,3 000 r·min-1,离心10 min,分离血浆,-20 ℃保存。
1.2.3 血浆样品前处理吸取血浆样品0.5 mL,置于5 mL的离心管中,加入体积分数为1%的乙酸乙酯3 mL,涡旋1 min,10 000 r·min-1离心10 min(4 ℃)。吸取上清液置于15 mL玻璃管中,于40 ℃水浴氮气吹干,后用1 mL色谱甲醇复溶,0.22 μm滤膜过滤,装入进样瓶供HPLC进样分析。
1.2.4 色谱条件色谱柱为Gemini 5u C18 100A(250 mm×4.0 mm×5 μm),美国Penomenex公司。紫外检测波长为312 nm;流动相为磷酸二氢铵溶液-乙腈(体积比30:70) 溶液;柱温30 ℃,流速1 mL·min-1,进样量为20 μL。
1.2.5 数据处理使用IBM公司的SPSS16.0统计分析软件计算血浆中盐酸氯苯胍浓度的平均值和标准差,同时以血药浓度平均值和时间作药-时曲线图。使用美国Pharsight公司的WinnonlinTM非房室模型计算试验动物的药动学参数,
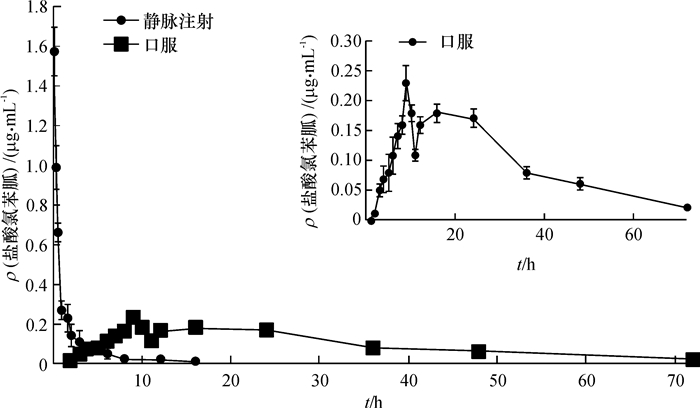
2 结果与分析 2.1 静脉注射盐酸氯苯胍的药动学特征兔耳缘静脉注射盐酸氯苯胍(2.00 mg·kg-1)后,不同时间的血药浓度见表 1,绘制的药-时曲线见图 1。采用非房室模型对血药浓度进行分析,得到的药动学参数见表 2。结果表明,静注给药后的药时曲线下面积AUC0-t为1.72 μg·h·mL-1,血浆清除率为1.17 L·h-1·kg-1,表观分布容积(Vd)为2.87 L·kg-1,t1/2为1.72 h。该药静脉注射后表观分布容积较大,表示药物大部分分布于组织,且消除迅速,在给药剂量为2.00 mg·kg-1的情况下,血浆内的药物6 h即可基本消除。
|
|
表 1 兔静脉注射盐酸氯苯胍(2.00 mg·kg-1)与内服盐酸氯苯胍(100.00 mg·kg-1)的血药浓度1) Table 1 The plasma drug concentrations in rabbits treated by intravenous and oral administration of robenidine hydrochloride at 2.00 and 100.00 mg·kg-1 respectively |
|
图 1 兔内服(100.00 mg·kg-1)与静脉注射(2.00 mg·kg-1)盐酸氯苯胍的药-时曲线图 Figure 1 Concentration-time curve of robenidine hydrochloride in rabbits treated by oral administration and intravenous administration at 100.00 and 2.00 mg·kg-1 respectively |
|
|
表 2 兔静脉注射和内服盐酸氯苯胍的药动学参数1) Table 2 The plasma pharmacokinetic parameters in rabbits treated by intravenous and oral administration of robenidine hydrochloride |
兔内服盐酸氯苯胍(100.00 mg·kg-1)后,不同时间的血药浓度见表 1,绘制的药-时曲线见图 1。采用非房室模型对血药浓度进行分析,得到的药动学参数见表 2。结果表明,盐酸氯苯胍内服给药吸收非常缓慢,达到高峰时间(tmax)为20 h,并且吸收较差,表现为Cmax较低,仅为0.32 μg·mL-1, AUC0-t为6.33 μg·h·mL-1,表明药物进入体内的总量很低;t1/2为8.94 h,说明药物排泄缓慢,在体内保留时间较长;经计算,该药物的绝对生物利用度仅为7.36%,说明内服盐酸氯苯胍后,药物基本不吸收,而是主要以原型排出体外,这与田苗苗等[10]的试验结果相符。此外,盐酸氯苯胍2种给药方式的各药动学参数均存在极显著的差异(P<0.01)。
3 讨论与结论对于具有肝肠循环的药物来说,其静脉注射的药-时曲线往往具有再吸收的特点[11-12]。从静脉注射盐酸氯苯胍的药动学参数可以看出,静脉注射给药时表观分布容积大,药物分布广泛,消除速度较快,血药中的药物浓度在6 h后便低于定量限,且在0~24 h的药-时曲线没有显示该药物具有再吸收的特点。一方面是由于药物的表观分布容积大,且在血浆中消除速度较快;另一方面可能与盐酸氯苯胍的在兔体内主要由肾脏代谢有关。该药物是否具有肝肠循环,还需进一步的试验验证。
观察内服盐酸氯苯胍的药-时曲线可知,该药物内服给药的药时曲线明显具有2个吸收过程,第1个吸收时段为0~8 h,为内服给药的常规吸收过程;第2个吸收时段为给药后12~24 h,且在此过程中到达最高浓度。本试验中,大白兔使用代谢笼进行饲喂,尿液与粪便及时分离回收,排除了动物因食粪造成药物再吸收的可能。药物在肠道内环境以及肠道微生物的作用下,代谢成水溶性强更易被肠道吸收的化合物。
在生产实践中,盐酸氯苯胍主要用于防治鸡、兔的球虫感染,作用部位在肠道,不需要吸收后发挥全身治疗作用,造成动物性食品中的药物残留。本研究中,内服给药的末端消除半衰期较长,生物利用度低表明内服给药消除缓慢,体内存留时间较长,进入动物体内的氯苯胍量较低。Zulalian等[13]采用14C标记法对氯苯胍在鸡体内的代谢和残留规律研究发现,单剂量内服用14C标记的盐酸氯苯胍,鸡在24 h内排出标记放射性化合物为82%, 144 h后盐酸氯苯胍排出量达99%。田苗苗等[10]的研究表明,兔内服氯苯胍后主要以原药的形式排出体外,随粪便排出的氯苯胍占内服总量的87.17%,尿液中氯苯胍占内服总量的0.56%。这与本试验的结果相符,也符合盐酸氯苯胍的临床用药目的。
| [1] |
陈杖榴. 兽医药理学[M]. 北京: 中国农业出版社, 2010, 373.
(  0) 0) |
| [2] |
范本伦. 氯苯胍:一种新的高效球虫药[J]. 国外畜牧科技, 1979(3): 43-48. (  0) 0) |
| [3] |
SORRIBAS V, ARRUEBO M P, ALVARADO F, et al. Action of robenidine on the intestinal transport and digestion of nutrients in rabbit[J]. Eur J Pharmacol, 1993, 248(2): 137-144. (  0) 0) |
| [4] |
KENNETT R L, KANTOR S, GALLO A. Efficacy studies with robenidine, a new type of anticoccidial, in the diet[J]. Poult Sci, 1974, 53(3): 978-986. DOI:10.3382/ps.0530978 (  0) 0) |
| [5] |
European Food Safety Authority (EFSA)b. Scientific opinion on safety and efficacy of cycostat 66G (robenidine hydrochloride) for rabbits for breeding and fattening: Panel on additives and products or substances used in animal feed[J]. EFSA J, 2011, 9(3): 1-32. (  0) 0) |
| [6] |
YEOM H, YANG D H, SUH J H, et al. Determination of robenidine residues in chicken muscle by high performance liquid chromatography with ultraviolet detection[J]. Arch Pharm Res, 2013, 36(3): 359-365. DOI:10.1007/s12272-013-0065-y (  0) 0) |
| [7] |
刘勇军, 吴银良, 姜艳彬. 高效液相色谱法测定鸡组织与鸡蛋中氯苯胍的残留量][J]. 色谱, 2010, 28(9): 905-907. (  0) 0) |
| [8] |
WILGA J, WASIK A K, NAMIESNIK J. Comparison of extraction techniques of robenidine from poultry feed samples[J]. Talanta, 2007, 73(5): 812-819. DOI:10.1016/j.talanta.2007.04.046 (  0) 0) |
| [9] |
汤菊芬, 蔡佳, 廖建萌, 等. HPLC-MS/MS法同时测定水产品中的诺氟沙星、盐酸小檗碱、盐酸氯苯胍残留[J]. 中国兽药杂志, 2014(8): 55-60. (  0) 0) |
| [10] |
田苗苗, 郭春娜, 怀彬彬, 等. 盐酸氯苯胍灌服后在兔尿液和粪便中的排泄规律[J]. 华南农业大学学报, 2015, 36(3): 8-12. DOI:10.7671/j.issn.1001-411X.2015.03.002 (  0) 0) |
| [11] |
程娟. A771726在大鼠体内肝肠循环的研究[D]. 合肥: 安徽医科大学, 2010. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yike201003015&dbname=CJFD&dbcode=CJFQ
(  0) 0) |
| [12] |
郑培良. 药物肝肠循环对其药理作用的影响[J]. 中级医刊, 1987(7): 43-44. (  0) 0) |
| [13] |
ZULALIAN J, CHAMPAGNE D A, WAYNE R S, et al. Absorption, excretion, and metabolism of 1, 3-bis(p-chlorobenzylideneamino)guanidine hydrochloride (robenz robenidine hydrochloride) in the chicken[J]. J Agric Food Chem, 1975, 23(4): 724-730. DOI:10.1021/jf60200a049 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


