2. 华南农业大学 农学院/广东省微生物信号与作物病害防控重点试验室,广东 广州 510642
2. College of Agriculture, South China Agricultural University/Guangdong Province Key Laboratory of Microbial Signals and Disease Control, Guangzhou 510642, China
柑橘黄龙病(Citrus Huanglongbing,HLB)是柑橘生产上的一种毁灭性病害,最早于我国广东珠江三角洲、潮汕地区进行经济作物病害调查时被发现,随后成为研究热点[1-3]。目前,除了地中海盆地、西亚和澳洲外,黄龙病已在亚洲、非洲、大洋洲、南美洲和北美洲的50个国家和地区发生为害,几乎覆盖了全球所有的柑橘主产区[4],严重制约着世界柑橘产业的健康发展。虽然目前黄龙病菌还不能进行人工培养,也未能完成严格意义上的柯赫氏法则,但基于当前的研究,一致认为柑橘黄龙病是由韧皮部杆菌Candidatus Liberibacter spp.引起的。Garnier等[5]证实夹竹桃科草本植物长春花Catharanthus roseus可以通过嫁接的方式感染黄龙病菌,而且与柑橘属寄主一样,黄龙病菌感染长春花后可以在其体内进行有效增殖。研究还发现长春花染病后叶片上的症状更明显,菌液浓度更高,因此常用作黄龙病的指示植物和试验材料[6]。
植物在进化过程中形成了复杂的防御机制,当植物正常生长时,体内活性氧代谢处在一个低水平的动态平衡中。当受到病原侵染时,植物体内活性氧产生和清除的代谢平衡被破坏,过量的活性氧引发细胞的过氧化,破坏细胞膜的结构与功能,导致植物细胞死亡[7]。在维持活性氧平衡的过程中酚类物质和细胞保护酶系统起到了非常重要的作用。关于多酚氧化酶(PPO)的活性与寄主抗病性的关系在水稻Oryzasativa、小麦Triticumae stivum、棉花Gossypium spp.等寄主与稻瘟病菌Pyricularia oryzae、条锈病菌Puccinia striiformisf sp. tritici、棉枯萎病菌Fusarium oxysporumf sp. vasinfectum、霜霉病菌Peronospora parasitica和轮纹病菌Physalospora piricola等多种病原菌互作系统中都有研究[8-10]。大量研究结果表明,在不同作物与病原互作中,PPO活性的变化趋势存在显著差异,但是其活性的变化规律仍然反映了植物对病原菌的抵抗能力。对于同属于韧皮部杆菌属的土豆斑马片病原Candidatus Liberibacter solanacearum,Wallis等[11]研究发现PPO含量在感染发病的土豆中高于不显症的土豆。鲜见柑橘黄龙病病原感染与PPO活性变化的关系研究。本文以长春花为寄主,在其被黄龙病菌感染的不同时间,通过实时荧光定量PCR对PPO基因在各个时期的表达量进行分析,并结合生理生化指标的测定,探讨黄龙病菌感染长春花过程中PPO活性的变化,旨在为寄主抗黄龙病机理研究及抗病育种提供参考。
1 材料与方法 1.1 材料将保存于华南农业大学长岗山网室内,经检测为Ca. L. asiaticus阳性的长春花枝条(病原可通过菟丝子从染病柑橘上获取)作为嫁接用病芽条;经检测Ca. L. asiaticus阴性的长春花枝条作为嫁接用健康芽条。
2014年3月,华南农业大学长岗山网室内,将长春花种子播种于育种盆中,待幼苗长到2~3 cm时移栽至直径为15 cm花盆内,保证每盆1株,隔天浇水1次。待植株长至20 cm时,以去顶嫁接病芽的长春花作为染病组,以嫁接健康芽的长春花作为健康组。嫁接后,将所有长春花苗放置阴凉处避免阳光直射,保持嫁接口处芽条湿润,1周后将嫁接苗从阴凉处取出,转移至网室内,隔天浇水1次。
1.2 方法嫁接病芽后14 d开始,隔天取嫁接点下方叶片,以叶中脉提取DNA,进行常规PCR检测,以确定染病植株作为阳性样品。最后按嫁接后染病20、25、30、35、40和45 d共6个时间取样,每个时间点所取样品包含3棵阳性植株,3棵健康植株,每棵植株的叶、主茎和根3个部分作为独立的样品,液氮冷冻后于-80 ℃条件下保存,用于酶活力测定和RNA提取。
1.2.1 长春花组织总RNA提取及反转录RNA提取参考Omega植物RNA提取试剂盒说明书,提取的总RNA经10 g·L-1琼脂糖凝胶电泳鉴定完整性,核酸蛋白测定仪Nanodrop 2000(美国Thermo Fisher公司)测定纯度及浓度。总RNA经DNaseⅠ消化处理后取1 μg作为模板,加入1 μL Oligo(dT)18 Primer (50 μmol·L-1),1 μL dNTP Mixture(10 mmol·L-1)和RNase free ddH2O共10 μL混合均匀,65 ℃保温5 min后在冰上迅速冷却,离心后向上述混合液中加入4 μL 5×Primer Script TMⅡ Buffer,0.5 μL RNase Inhibitor(40 U·μL-1),1 μL Primer Script TMⅡ RTase(200 U·μL-1),4.5 μL RNase free ddH2O,振荡混匀后离心, 42 ℃反应1 h,然后70 ℃保温15 min,将得到的cDNA溶液置于-20 ℃条件下保存备用。
1.2.2 长春花PwPPO基因片段克隆与序列分析根据土豆Solanum tuberosum、番茄Solanum lycopersicum、小麦、拟南芥Arabidopsis thaliana、烟草Nicotiana tabacum、山茶Camellia japonica等物种PPO基因的同源序列,使用PremierPrimer 5设计出多对引物,由上海英俊公司合成。筛选出长春花多酚氧化酶基因(PwPPO)的引物PwPPOF: 5′-ACAGACCCTACTTCTCCAA-3′,PwPPOR: 5′-TGACGCCTTCCTCCACCTA-3′。将反转录得到的cDNA为模板,扩增保守区段序列,PCR扩增反应体系为25 μL,包含1 μL cDNA,浓度为10 μmol·L-1的引物PwPPOF和PwPPOR各0.5 μL,2.5 μL 10×PCR Buffer, 2.5 μL dNTP Mixture(2.5 mmol·L-1), 0.4 μL Taq DNA polymerase(5 U·μL-1), 17.6 μL ddH2O。反应条件为96 ℃ 5 min;95 ℃ 45 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;最后72 ℃ 7 min。PCR扩增产物经全式金(Transgen)EasyPure® Quick Gel Extraction Kit回收后,按照Transgen PEASY-T1 Simple cloning Kit说明书进行连接转化,阳性菌落送上海生工生物工程股份有限公司测序。利用DNAMAN对克隆所得到的序列进行相似性分析。
1.2.3 PwPPO基因的实时荧光定量PCR表达分析根据“1.2.2”中PwPPO基因保守片段的测序结果,PwPPOF和PwPPOR可作为PwPPO基因实时荧光定量表达的引物。筛选内参基因18S rRNA[12],18s rRNA F: 5′-GCTTAGGCCAAGGAAGTTTG-3′,18s rRNA R:5′-TCTATCCCCATCACGATGAA-3′。qRT-PCR以SYBER Green为染料,梯度稀释质粒DNA为模板制备标准曲线。检测时以10倍稀释的样品cDNA为模板,20 μL反应体系:10 μL SYBER Green mix,浓度为10 μmol·L-1的上下游引物各0.5 μL,2.5 μL cDNA,其余用ddH2O补足。每个反应重复3次。反应程序:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,39个循环,反应结束后分析熔解曲线。使用BIO-RAD公司IQ5定量PCR仪,样品所有目的基因和内参基因的Ct以3次重复的平均值计算,数据分析根据2-ΔΔCt法[13]进行,分析PwPPO基因的时序表达时用第1次采样的对照样品的相对表达值校正,数据均以mRNA的相对表达量表示。
1.2.4 PPO活性分析PPO活性的测定采用邻苯二酚法[14]:称取新鲜植物组织0.1 g,加液氮研磨后加入1 mL 0.05 mol·L-1 pH 6.8的磷酸缓冲液,将匀浆转移至2 mL离心管中,4 ℃条件下12 000 r·min-1离心15 min,取上清液作为酶粗提液;取0.5 mL邻苯二酚(0.1mol·L-1),0.5 mL粗酶液,2.5 mL pH 6.8的磷酸缓冲液(0.05 mol·L-1),以清水为对照,测定D420 nm的变化。以1 min内D420 nm变化0.01为l个酶活力单位(U),以鲜质量为基础,酶活性单位表示为U·g-1,每样品重复测定3次。
1.3 数据处理应用SPSS13.0软件统计数据,ANOVA和邓肯氏新复极差法分析数据,Excel软件进行数据处理及图表绘制。
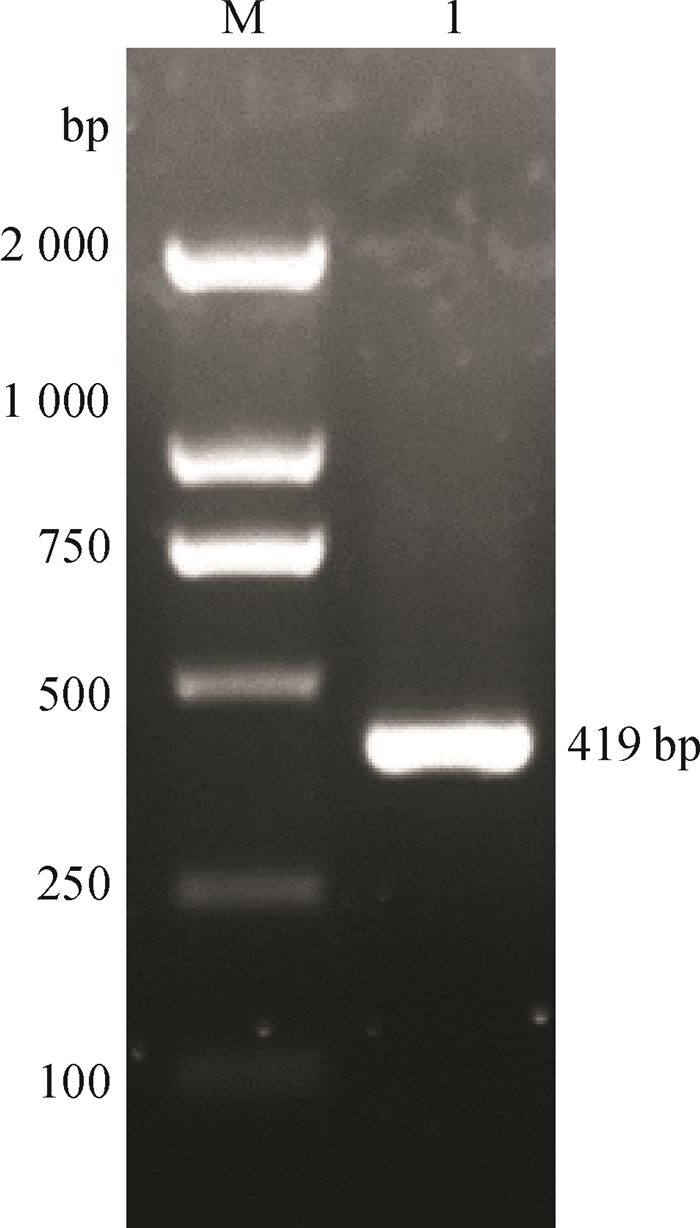
2 结果与分析 2.1 PwPPO基因扩增与分析利用反转录第一链cDNA作为模板,引物为PwPPOF和PwPPOR,扩增PwPPOcDNA片段,产物经琼脂糖凝胶电泳检测,得到片段长度为419 bp的目的基因(图 1)。目的条带经切胶回收、连接和转化后送上海生工生物工程股份有限公司测序。测序结果进行BLAST分析,结果表明PCR扩增序列与Genbank中其他植物已知的PPO基因的相似性最高可达83%。
|
图 1 PwPPO基因特异性引物的PCR扩增产物电泳图 Figure 1 A garose gel electrophoresis of PwPPO PCR product with specific primers M: DL 2000 DNA Marker;1:PwPPO基因。 |
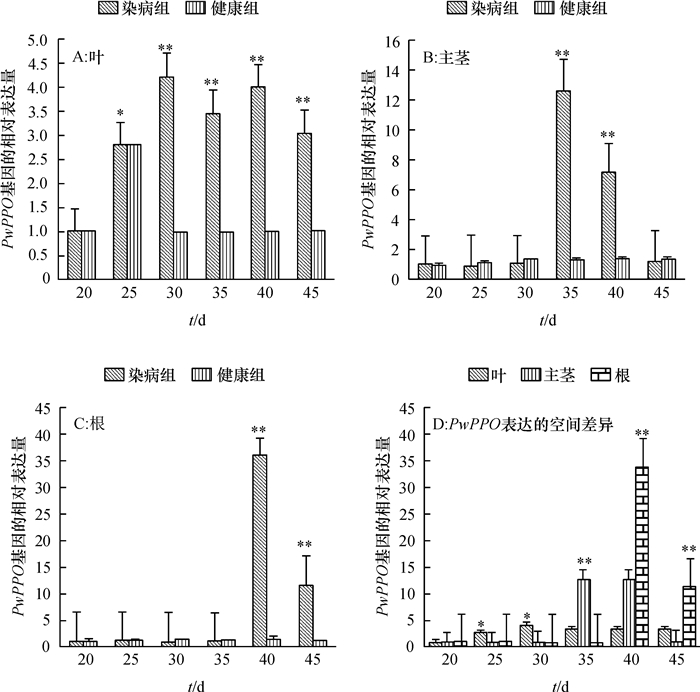
长春花叶片DNA常规PCR检测结果显示,试验组所有样品均为Ca. L. asiaticus阳性,对照组样品均为Ca. L. asiaticus阴性。qRT-PCR分析结果显示,在试验组和对照组都能检测到PwPPO mRNA的表达,在染病长春花的叶、主茎和根中,PwPPO的表达总体呈现先上调后下降的趋势(图 2A、2B、2C),但不同组织上调表达的时间和幅度不同。叶片中PwPPO的表达从嫁接后25 d开始明显上调,在30 d达到最大值,上调4.23倍,差异极显著(P < 0.01),染病后期(35~45 d)上调均超过3.00倍,差异显著(P < 0.05)。主茎中PwPPO的表达量在染病早期(20~30 d)无明显上调趋势,在35 d达到试验周期中的最大值,上调12.64倍,差异极显著(P < 0.01),随后表达量下降,在45 d时与对照差异不明显(P>0.05)。根中PwPPO基因的表达在感染后期快速上调,40 d时上调达到33.80倍(P < 0.01),45 d上调表达倍数有所下降,但仍达到11.39倍,差异极显著(P < 0.01)。由图 2D可以看出PwPPO基因表达在染病长春花上的空间差异,在染病早期(20 d)时,叶、主茎、根组织中PwPPO的表达几乎没有差异,表达水平较低;25~30 d,叶片中PwPPO基因的表达上调倍数较高,与主茎、根间差异显著;35 d PwPPO在主茎中的表达占优势,而后期(40~45 d)根中的PwPPO表达量较叶和主茎高。
|
图 2 健康和染病长春花各组织中PwPPO的表达量变化 Figure 2 Changes of PwPPO expression in different tissues of healthy and infected periwinkles *和**分别表示同一时间不同处理间差异达显著和极显著(P<0.05,P<0.01,Duncan’s法)。 |
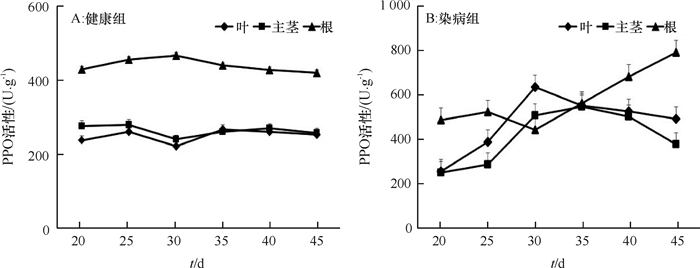
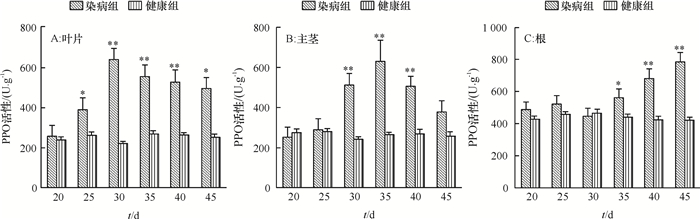
从嫁接后第20天开始,测定用于1.2.3中qRT-PCR试验的长春花叶片、主茎和根的PPO活性,结果表明,健康对照中各时期叶、主茎和根中PPO活性变化不大,根部的活性要高于叶和主茎(图 3A)。染病长春花叶和主茎中PPO的活性变化呈现相似的规律,分别在30和35 d达最大值,分别为634.67和548.11 U·g-1,在感染中后期酶活力下降,45 d分别下降至492.00和377.00 U·g-1,根部的PPO活性变化整体呈逐渐增加的趋势,在45 d达到最大值792.00 U·g-1(图 3B)。与对照相比,染病的长春花叶、主茎和根中PPO活性均较健康对照高,分别于30,35和45 d达到对照的2.87、2.10和1.89倍,差异极显著(P < 0.01)(图 4A、4B、4C)。
|
图 3 健康和染病长春花不同组织中PPO活性变化 Figure 3 Changes of PPO activities in different tissues of healthy and infected periwinkles |
|
图 4 健康与染病长春花相同组织中PPO活性比较 Figure 4 Comparison of PPO activities in the same tissues of healthy and infected periwinkles *和**分别表示染病组与健康组差异达显著和极显著(P<0.05,P<0.01,Duncan’s法)。 |
本研究根据不同物种PPO基因的同源序列设计出多套长春花PwPPO基因的引物,利用筛选出的特异性引物,PCR扩增得到长春花长度419 bp的PwPPO片段。通过序列比对分析发现扩增得到的PwPPO基因目的片段与刺痒黎豆Mucuna pruriens的PPO基因序列相似性最高,达到83%,说明所克隆的基因片段属于PPO基因家族的成员。
植物体内,PPO可以通过参与酚的氧化,形成对病菌毒性较高的醌类物质,并参与木质素的合成,使细胞壁增厚来抵御病菌的侵入和扩展从而抑制寄主发病,因此,PPO与寄主的病原性防御反应密切相关,在寄主拮抗微生物侵染过程中发挥着重要作用[15]。在哈茨木霉Trichoderma harziaiarum与水稻[16]、寡雄腐霉Pythium oligandrum与烟草Nicotiana tabavum[17]、绿色木霉Trichoderma viride与黄瓜Cucumis sativus[18]和溃疡病菌Pseudomonas syringae pv.tomato与番茄Solanum lycopersicum[19]等互作研究中均发现PPO活性的增强与寄主抗病能力的增加有密切关系。本研究运用qRT-PCR和生理生化方法分析不同时间长春花叶、主茎和根中PwPPO基因的表达量和PPO活性变化。结果表明,黄龙病菌侵染后长春花各组织中PwPPO基因的表达量总体呈上调的趋势,酶活性测定结果也证实染病长春花中PPO活力较健康长春花中的活性高,说明在黄龙病菌侵染的长春花中PPO活性的增加与寄主抵抗病原入侵有一定的相关性。与健康组相比,染病长春花各组织中均发现在PwPPO基因上调表达倍数较高的阶段,PPO的活性也较强,说明PwPPO基因的表达量与PPO活性之间存在一定的正相关性。在黄龙病菌的刺激下,长春花通过增加各组织中PwPPO mRNA的表达量来提高植株PPO的整体水平,达到增强抵抗病原菌入侵的目的。至于长春花不同组织中PwPPO基因的表达量以及PPO活性上调的幅度和时间不完全一致,原因之一可能与PPO的组织特异性有一定关系,研究发现幼叶、花、根的分生组织以及正在生长的果实中PPO mRNA含量都较高,而成熟组织,如成熟的叶片和茎中则较少[20]。本试验也证实在健康的长春花中,主茎部位PPO活性最低,根部活性最高。其二可能与黄龙病菌对植物不同组织感染的时间和分布有关。顶端嫁接试验表明,黄龙病菌可以从嫁接点随着营养物质的运输转移到根部,很多研究也证实其在寄主植物不同组织中分布是不均匀的[21],从而导致长春花不同部位间防御反应发生的时间和强度有一定差异。
长春花作为黄龙病菌研究中常用的指示植物和试验材料,其与黄龙病菌的互作可以为黄龙病菌与柑橘类寄主的互作研究提供重要参考。本试验证实PwPPO基因表达量与PPO活性成正比,与长春花抵抗黄龙病菌侵染的能力密切相关。这一结果将促进黄龙病菌与长春花互作机理的深入研究,而有关病原侵染后PPO表达的分子机制以及是否可以将PPO作为筛选抗性材料的生化指标,还需要进一步试验和研究。
| [1] |
REINKING A. Diseases of economic plants in South China[J]. Philippine Agr, 1919, 8: 109-135. (  0) 0) |
| [2] |
CHEN Q. A report of a study on yellow shoot disease of citrus in Chaoshan[J]. New Agric Q Bull, 1943, 3(142): 75. (  0) 0) |
| [3] |
林孔湘. 柑桔黄稍(黄龙)病研究:Ⅰ:病情调查[J]. 植物病理学报, 1956(2): 1-11. (  0) 0) |
| [4] |
BOVE JM. Heat-tolerant Asian HLB meets heat-sensitive African HLB in the Arabian Peninsula!Why?[J]. J Citrus Pathol, 2014, 1(1): 1-78. (  0) 0) |
| [5] |
GARNIER M, BOVE J M. Transmission of the organism associated with citrus greening disease from sweet orange to periwinkle by dodder[J]. Phytopathology, 1983, 73(10): 1358-1363. DOI:10.1094/Phyto-73-1358 (  0) 0) |
| [6] |
BOVE J M. Huanglongbing: A destructive, newly-emerging, century-old disease of citrus[J]. J Plant Pathol, 2006, 88(1): 7-37. (  0) 0) |
| [7] |
XU X B, QIN G Z, TIAN S P. Effect of microbial biocontrol agents on alleviating oxidative damage of peach fruit subjected to fungal pathogen[J]. Int J Food Microbiol, 2008, 126(1/2): 153-158. (  0) 0) |
| [8] |
石雪晖, 王波英, 吴艳纯, 等. 葡萄叶片中单宁, 木质素, PPO活性与抗黑痘病的关系[J]. 中外葡萄与葡萄酒, 1997(4): 8-11. (  0) 0) |
| [9] |
潘汝谦, 黄旭明, 古希昕. 活性氧清除酶类在黄瓜感染霜霉病过程中活性变化[J]. 植物病理学报, 1998, 29(3): 287-288. (  0) 0) |
| [10] |
袁庆华, 桂枝, 张文淑. 苜蓿抗感褐斑病品种内超氧化物歧化酶、过氧化物酶和多酚氧化酶活性的比较[J]. 草业学报, 2002, 11(2): 100-104. (  0) 0) |
| [11] |
WALLIS C M, CHEN J C, CIVEROLOEL. Zebra chip-diseased potato tubers are characterized by increased levelsof host phenolics, amino acids, and defense-related proteins[J]. Physiol Mol Plant P, 2012, 78: 66-72. DOI:10.1016/j.pmpp.2012.02.001 (  0) 0) |
| [12] |
肖翠, 严佳文, 龙桂友, 等. 柑橘内参基因的稳定性评价[J]. 果树学报, 2012, 29(6): 978-984. (  0) 0) |
| [13] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and 2-ΔΔCt method[J]. Method, 2002, 25(4): 402-408. (  0) 0) |
| [14] |
黎婕, 陈中, 林伟锋. 梅州金柚果肉中多酚氧化酶特性的研究[J]. 食品工业科技, 2013, 34(21): 180-183. (  0) 0) |
| [15] |
尹亚丽, 郭彦军, 倪郁, 等. 腐霉利与菌核病菌胁迫下紫花苜蓿理化指标的变化[J]. 植物保护学报, 2010, 37(3): 283-284. (  0) 0) |
| [16] |
黄有凯, 罗曼, 蒋立科, 等. 哈茨木霉对水稻过氧化物酶及多酚氧化酶活性的影响[J]. 微生物学通报, 2003, 30(5): 1-4. (  0) 0) |
| [17] |
赵建, 吴叶宽, 袁玲, 等. 寡雄腐霉发酵液对烤烟生长的影响及对烟草黑胫病的防治作用[J]. 植物保护学报, 2013, 40(1): 68-72. (  0) 0) |
| [18] |
庄敬华, 高增贵, 杨长城, 等. 绿色木霉菌T23对黄瓜枯萎病防治效果及其几种防御酶活性的影响[J]. 植物病理学报, 2005, 35(2): 179-183. (  0) 0) |
| [19] |
BASHAN Y, OKON Y, HENIS Y. Peroxidase, polyphenoloxidaseand phenols in relation to resistance against Pseudomonas syringae pv.tomato in tomato plants[J]. Can J Bot, 1987, 65(2): 366-372. DOI:10.1139/b87-047 (  0) 0) |
| [20] |
SHAHAR T, HENNIG N, GUTFINGER T. The tomato 66.3-kD polyphenol oxidase gene: Molecular identification and developmental expression[J]. Plant Cell, 1992, 4(2): 135-147. DOI:10.1105/tpc.4.2.135 (  0) 0) |
| [21] |
TATINENI S, SAGARARN U S, GOWDA S, et al. In planta distribution of Candidatus Liberibacter asiaticus as revealed by polymerase chain reaction (PCR) and real-time PCR[J]. Phytopathology, 2008, 98(5): 592-599. DOI:10.1094/PHYTO-98-5-0592 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


