1. College of Life Science,Jilin Agricultural University, Changchun, 130118 China
1. Faculty of Agronomy, Jilin Agricultural University, Changchun, 130118 China
磷是继氮之后作物所需的第2大营养元素,在作物光合作用、能量转移、信号转导及大分子物质的生物合成中都起着关键的作用[1]。但根据资料调查显示,我国有74%的耕地土壤缺磷[2]。可溶性磷肥施入农田后,由于土壤的固定作用,大部分迅速转变为作物难以吸收的无效磷,无法被植物直接吸收利用,导致作物对磷肥的当季利用率不超过30%[3]。土壤中溶磷微生物能依靠自身的代谢或与其它生物协同作用[4],将不溶性磷转变成植物可吸收利用的磷。
溶磷菌可明显促进作物的株高、干质量[5]及产量的增加[6],也可以促进作物对磷素的吸收[7],增加土壤生物量。因此,越来越多的溶磷菌被分离,主要集中在假单胞菌属Pseudomonas、埃希氏菌属Escherichia、肠细菌属Enterbacter等[8]。不同的溶磷菌溶磷的形式不同。微生物分泌的有机酸可作为Ca2+的螯合剂,从而使磷从不溶性磷酸盐中释放出来。其中葡萄糖酮酸在土壤磷酸盐的风化和溶解过程中起着重要作用[9]。Arvind等[10]提出,参与直接氧化途径的葡萄糖脱氢酶(GDH)和葡萄糖酸脱氢酶(GADH)都定位在溶磷微生物的细胞膜外侧[8],当葡萄糖扩散至质膜时,在GDH的作用下被氧化成葡糖酸,葡糖酸进一步在GADH的作用下被直接氧化形成酸性特别强的葡糖酮酸[11], 然后被分泌到细胞壁和细胞膜之间,使胞外处于酸性极高的环境,从而溶解不溶性磷酸钙[12]。
FAD(黄素腺嘌呤二核苷酸)-GADH由FAD-脱氢酶大亚基、含有血红素C的中间亚单位和1个小亚基组成,大亚基和中间亚单位的功能主要是参与氢及电子的传递,小亚基功能未知[13]。本研究以水稻根际土壤分离到的溶磷细菌—Serratia sp. NDW3为研究对象,对菌株NDW3 GADH小亚基基因ga2dh进行克隆与分析,旨在明确该基因的性质以及在菌株NDW3溶磷过程中的作用特点,进一步揭示溶磷菌的溶磷机制,为溶磷菌在农业生产上的应用提供理论基础。
1 材料与方法 1.1 材料菌株Serratia sp. NDW3为吉林农业大学作物营养代谢与调控实验室于2014年分离于吉林农业大学水稻试验田、具有较好溶磷能力的溶磷菌。大肠埃希菌菌株DH5α、BL21(DE3) 及载体pET28a(+)均为该实验室保存。pMD18-T载体试剂盒、琼脂糖凝胶DNA回收试剂盒及限制性内切酶、Ex-Taq酶、T4 DNA连接酶、DNA Marker、蛋白质分子量标准均购于TaKaRa公司。细菌RNA提取试剂盒为天根生化科技(北京)有限公司产品,Easy Script TMFirst-strand cDNA Synthesis Super Mix反转录试剂盒为北京全式金生物技术有限公司产品,其它试剂均为国产分析纯。
NBRIP (National botanical research institute′s phosphate)培养基及LB培养基的配制参照文献[14]。
1.2 菌株NDW3溶磷量的测定采用钼蓝比色法测定菌株的溶磷量[15],以NBRIP为基础培养基,Ca3(PO4)2为唯一磷源,接种等量灭活菌液为对照。菌株NDW3接种在LB培养基中,当培养液细胞浓度为D600 nm =0.6时,菌液以
GADH活性测定参照Yang等[16]方法:通过铁氰化钾作为电子受体,取780 μL McIIvaine缓冲液放入25 mL离心管中,然后加入0.1 mol·L-1铁氰化钾和1 mol·L-1葡萄糖酸钠各100 μL,混匀后加入20~200 μL提取的粗酶液,再加入500 μL铁-Dupanol溶液终止反应,25 ℃温育20 min进行显色,最后加入3.5 mL去离子水,在波长为660 nm条件下测定光密度值,空白对照用去离子水代替酶液。GADH酶活力单位被定义为每分钟内催化1 μmol葡萄糖酸钠所需的酶量(4.0个光密度等于氧化1 μmol的葡萄糖酸),酶活性用每毫克蛋白的酶活力单位数表示。
1.4 荧光定量PCR根据细菌总RNA试剂盒方法提取菌株NDW3的RNA,采用Easy Script TM First-strand cDNA Synthesis Super Mix反转录试剂盒合成cDNA。实时荧光定量PCR采用定量试剂SYBR Premix ExTaqTM进行扩增反应,用Primer 5.0软件设计目的基因引物,GA2DH-F:5′-CATCGTTTACAGCGTGGACTAC-3′,GA2DH-R:5′-TCCAGGTGTAGCGGTGAAATG-3′,内参基因为16S rRNA,引物16S-F: 5′-CCAACCGACCTTTTTCACCC-3′, 16S-R: 5′-TACGGCGTGTTCAT-CTGGC-3′。反应体系为20 μL,包括SYBR Premix ExTaqTM Ⅱ (2×) 10 μL,上下游引物各0.8 μL,ROX Reference Dye (50×) 0.4 μL,cDNA模板1.0 μL,ddH2O 6.0 μL。PCR反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃复性30 s,40个循环。每个反应设置3次重复。利用Step One生物软件和Microsoft Excel分析处理试验结果,参照ABI公司提供的ΔΔ Ct计算方法计算基因相对表达量。
1.5 ga2dh基因的克隆与序列分析从GenBank上检索序列,根据同属菌ga2dh基因的序列设计引物。以菌株NDW3的基因组DNA为模板,分别以ga2dh-F: 5′-GACTATCTTTGGATGGAATGTG-3′和ga2dh-R: 5′-GCGTCTACTTTTTTCA-TTACCG-3′为引物进行PCR扩增。PCR产物经10 g·L-1琼脂糖凝胶电泳检测,检测正确的DNA片段经凝胶试剂盒回收与pMD18-T载体连接,转化大肠埃希菌DH5α。经酶切及PCR验证为阳性的克隆送上海生工生物工程公司测序。将核苷酸序列转化成氨基酸序列后进行BLAST分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),并利用SWISS-MODLE网站进行结构预测,TMHMM-2.0软件进行蛋白质跨膜区域的预测。
1.6 原核表达载体pET-28a-ga2dh的构建与鉴定以测序为阳性的重组质粒pMD18-T-ga2dh为模板,两端具有EcoR I/XhoI酶切位点的引物Ga2dh-F:5′-CCGGAATTCGACTATCTTTGGATGGAATGTG-3′和Ga2dh-R:5′-CCGCTCGAGGCGTCTACTTTTTTCATTACCG-3′(下滑线部分为酶切位点)进行PCR,获得两端分别带有EcoR I和Xho I酶切位点的目的片段。EcoR I和Xho I双酶切目的片段和pET28a(+),凝胶回收并于16 ℃金属浴内连接12 h。连接产物42 ℃热激转化大肠埃希菌BL21(DE3) 感受态细胞。
1.7 重组质粒pET-28a-ga2dh在大肠埃希菌体内的诱导表达将鉴定为阳性的BL21(pET-28a-ga2dh)挑取单菌落到含卡那霉素(Kan)的LB液体培养基中,37 ℃,160 r·min-1,过夜培养。以
菌体BL21(pET-28a-ga2dh)及BL21(pET-28a)GADH活性测定方法如下:将过夜培养的菌悬液,按
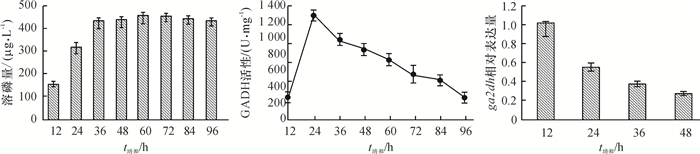
为了明确GADH小亚基基因ga2dh的表达与GADH活性及溶磷之间的关系,测定了菌株NDW3在96 h内溶磷量的变化及GADH的活性。如图 1所示,随培养时间的延长,溶磷量在36 h之前表现出不断增加的趋势,36~96 h内变化不明显。GADH活性在12 h时较小,24 h时达到峰值,然后逐渐降低。48 h内ga2dh表达量随着时间的增加而下降,12 h相对表达量远高于48 h。
|
图 1 菌株NDW3溶磷量、GADH活性及ga2dh基因表达量的变化 Figure 1 Changes in soluble phosphorus content, GADH activity and ga2dh gene expression level during phosphate solubilizing by strain NDW3 |
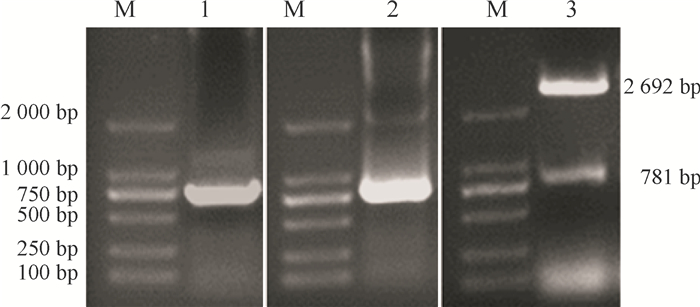
如图 2所示,以Serratia sp. NDW3提取的基因组DNA为模板,PCR扩增出约780 bp左右清晰的目的片段。利用PCR和双酶切验证目的片段与pMD18-T载体的连接,PCR与酶切都获得清晰的目的条带,说明目的基因与载体连接成功。
|
图 2 ga2dh基因的PCR扩增与鉴定 Figure 2 PCR amplification and verification of ga2dh gene M: DL2000 Marker; 1:NDW3 PCR扩增产物; 2:重组质粒的PCR鉴定;3:重组质粒的酶切鉴定。 |
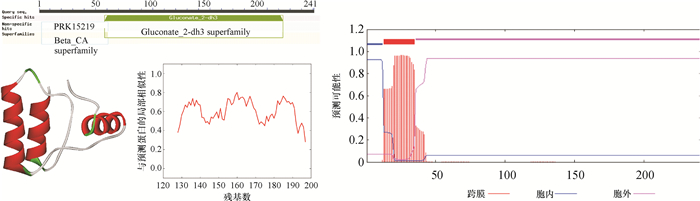
利用BLAST对ga2dh基因序列及GenBank核酸数据库进行分析。菌株NDW3的ga2dh基因序列与Serratia sp. SCBI (CP003424.1) 相似性最高,为99.62%。ga2dh基因的生物信息学分析结果见图 3。从图 3A看出,ga2dh基因编码的蛋白属于葡萄糖酸脱氢酶亚基3超家族,结构主要由3个α-螺旋构成,且预测结果的局部相似性均超过0.6。利用TMHMM-2.0将蛋白质序列进行跨膜区的预测(图 3B),结果发现蛋白质序列中前12个氨基酸位于胞内,36位氨基酸之后形成的蛋白质结构位于胞外,13~35氨基酸位点之间形成跨膜的区域。
|
图 3 ga2dh基因序列的生物信息学分析 Figure 3 Bioinformatic analysis of ga2dh gene A: ga2dh蛋白保守结构域的三维结构模拟及可靠性检测B: ga2dh蛋白跨膜区域预测 |
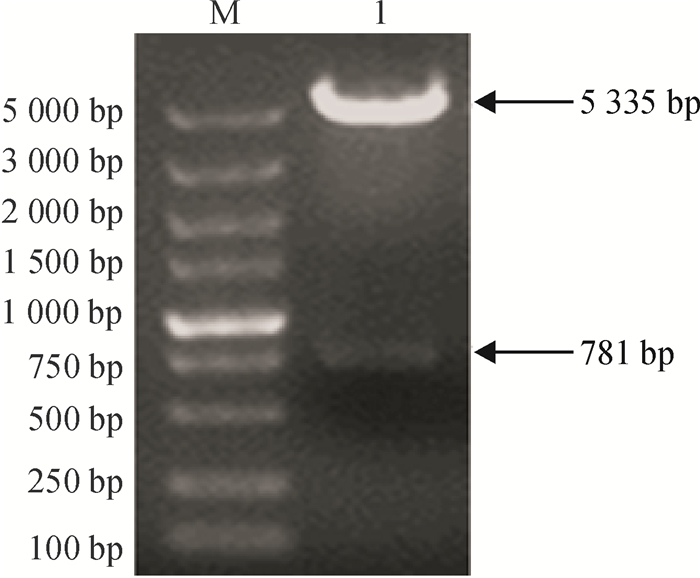
利用测序结果正确的pMD18-T-ga2dh为模板进行PCR,获得两端带有EcoR I和Xho I酶切位点的目的片段,利用双酶切与载体pET-28a进行连接,并转化大肠埃希菌BL21。阳性克隆提取质粒,并进行双酶切验证。结果如图 4所示,酶切后的基因片段及载体大小分别与目的基因及pET-28a载体的大小一致,说明原核表达载体pET-28a-ga2dh构建成功。
|
图 4 重组质粒的酶切鉴定 Figure 4 Restriction digestion analysis of recombinant plasmid M: DL5000 Marker;1:重组质粒的酶切片段。 |
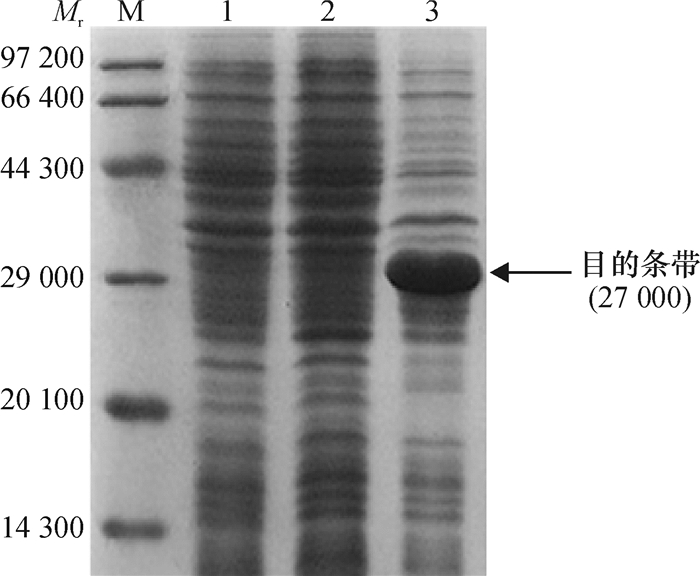
将BL21(pET-28a-ga2dh)进行诱导表达,SDS-PAGE电泳结果如图 5所示,BL21(pET-28a-ga2dh)在相对分子质量约27 000处存在明显的蛋白表达条带,且含量远高于对照,说明该基因在大肠埃希菌BL21中可以表达。
|
图 5 ga2dh基因在BL21中的蛋白表达 Figure 5 Protein expression of ga2dh gene in bacterium BL21 M:蛋白Marker;1:BL21(pET-28a);2:未诱导的BL21(pET-28a-ga2dh);3:诱导的BL21(pET-28a-ga2dh)。 |
利用LB培养基对带有不同质粒的BL21菌株进行培养,GADH活性如表 1所示。结果表明:BL21(pET-28a-ga2dh)菌株GADH活性随着培养时间增加而逐渐增强,在4 h时菌株的酶活性为411.67 U·mg-1,显著高于其他时间段(P < 0.05)。BL21(pET-28a)菌株在4 h内GADH活性也随着时间的增加而增强,但同一时间内,酶活性都远低于BL21(pET-28a-ga2dh),且4 h时,酶活性仅为BL21(pET-28a-ga2dh)体内酶活性的20.65%。这说明GADH小亚基基因ga2dh的表达,能够使大肠埃希菌BL21 GADH的活性显著增加。
|
|
表 1 GADH活性分析 Table 1 The activity analysis of GADH |
Serratia sp.是1类具有溶磷能力的革兰阴性菌株,Serratia marcescens GPS 5[17],Serratia sp. MSK1[18]等菌株已被分离并鉴定。本研究从水稻根际土壤中也分离到1株溶磷能力较好的菌株Serratia sp. NDW3。Goldstein等[19]认为菌株溶磷的特性受无机磷酸盐浓度的影响。本试验以NBRIP为培养基,不溶性磷酸钙为唯一磷源时,随培养时间的延长,菌株NDW3溶磷量表现出先增加,36 h后趋于稳定的趋势, 这说明菌株NDW3溶磷可能同样受不溶性磷的调节,培养基中可溶性磷浓度达到一定值时,菌株溶磷特性受到抑制。
溶磷微生物的溶磷机理非常复杂,Sashidhar等[8]认为葡萄糖直接氧化成葡萄糖酸是细菌溶磷的主要机制,革兰阴性细菌由于能分泌大量的有机酸进入外膜空间,其溶磷效果要好于革兰阳性菌。研究发现参与直接氧化途径的酶GDH和GADH都锚定在内膜上,但催化结构域却朝向细胞质膜的外表面,直接氧化途径产生的葡萄糖酸和2-酮基葡糖酸被分泌到细胞壁和细胞膜之间,使胞外处于酸性极高的环境[8]。ga2dh基因编码GADH分子的1个小亚基,本试验发现ga2dh基因的相对表达量在12 h最大,GADH活性在24 h达到最大值,而溶磷量在36 h后趋于稳定,这种规律可能是因为菌体内ga2dh基因表达后,GADH蛋白的形成需要一定的时间,或在培养过程中随着时间的增加,pH会抑制葡萄糖酮酸的产生,从而对酶产生了反馈抑制作用。ga2dh基因表达量、酶活性与溶磷量三者表现出依次滞后的趋势与高度相关性,说明Serratia sp. NDW3菌株溶磷的主要机制可能仍是依赖于直接氧化途径。生物信息学分析发现ga2dh基因编码的蛋白质序列存在跨膜以及胞内和胞外的区域。在大肠埃希菌中表达该基因可以明显增加菌体GADH的活性。这说明ga2dh基因编码的小亚基不仅对GADH活性起重要作用,也是介导GADH的跨膜结构的重要组成部分。
| [1] |
KHAN M S, ZAIDI A, AHEMAD M, et al. Plant growth promotion by phosphate solubilizing fungi-current perspective[J]. Arch Agron Soil Sci, 2010, 56(1): 73-98. DOI:10.1080/03650340902806469 (  0) 0) |
| [2] |
史国英, 莫燕梅, 岑贞陆, 等. 1株高效解无机磷细菌BS06的鉴定及其解磷能力分析[J]. 微生物学通报, 2015, 42(7): 1271-1278. (  0) 0) |
| [3] |
SHARMA S B, SAYYED R Z, TRIVEDI M H, et al. Phosphate solubilizing microbes: Sustainable approach for managing phosphorus deficiency in agricultural soils[J]. SpringerPlus, 2013, 2(1): 587-601. DOI:10.1186/2193-1801-2-587 (  0) 0) |
| [4] |
刘聪, 林维, 孙珑, 等. 黑土区林地土壤高效解磷细菌的分离、筛选及其解磷效果[J]. 东北林业大学学报, 2013, 41(11): 83-85. DOI:10.3969/j.issn.1000-5382.2013.11.020 (  0) 0) |
| [5] |
VYAS P, GULATI A. Organic acid production in vitro and plant growth promotion in maize under controlled environment by phosphate-solubilizing fluorescent Pseudomonas[J]. BMC Microbiol, 2009, 9(1): 174-189. DOI:10.1186/1471-2180-9-174 (  0) 0) |
| [6] |
HAMEEDA B, REDDY Y H, RUPELA O P. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna[J]. Curr Microbiol, 2006, 53(4): 298-302. DOI:10.1007/s00284-006-0004-y (  0) 0) |
| [7] |
张淑红. 兼溶5种难溶磷的溶磷细菌筛选及其对花生的促生作用[J]. 河南农业科学, 2015, 44(11): 58-61. (  0) 0) |
| [8] |
SASHIDHAR B, PODILE A R. Mineral phosphate solubilization by rhizosphere bacteria and scope for manipulation of the direct oxidation pathway involving glucose dehydrogenase[J]. J Appl Microbiol, 2010, 109(1): 1-12. (  0) 0) |
| [9] |
DUFF R B, WEBLEY D M, SCOTT R O. Solubilization of minerals and related materials by 2-ketogluconic acid producing bacteria[J]. Soil Sci, 1963, 95(2): 105-114. DOI:10.1097/00010694-196302000-00004 (  0) 0) |
| [10] |
KUMAR A, RAI L C. Proteomic and biochemical basis for enhanced growth yield of Enterobacter sp. LCR1 on insoluble phosphate medium[J]. Microbiol Res, 2015, 170: 195-204. DOI:10.1016/j.micres.2014.06.006 (  0) 0) |
| [11] |
ANTHONY C. The quinoprotein dehydrogenases for methanol and glucose[J]. Arch Biochem Biophys, 2004, 428(1): 2-9. DOI:10.1016/j.abb.2004.03.038 (  0) 0) |
| [12] |
KRISHNARAJ P U, GOLDSTEIN A H. Cloning of a Serratia marcescens DNA fragment that induces quinoprotein glucose dehydrogenase-mediated gluconic acid production in Escherichia coli in the presence of a stationary phase Serratia marcescens[J]. FEMS Microbiol Lett, 2001, 205(2): 215-220. DOI:10.1111/fml.2001.205.issue-2 (  0) 0) |
| [13] |
TOYAMA H, FURUYA N, SAICHANA I, et al. Membrane-bound, 2-keto-D-gluconate-yielding D-gluconate dehydrogenase from "Gluconobacter dioxyacetonicus" IFO 3271: Molecular properties and gene disruption[J]. Appl Environ Microb, 2007, 73(20): 6551-6556. DOI:10.1128/AEM.00493-07 (  0) 0) |
| [14] |
杨美英, 王春红, 武志海, 等. 不同条件下2株溶磷菌溶磷量及葡萄糖脱氢酶基因表达与酶活分析[J]. 微生物学报, 2016, 56(4): 651-663. (  0) 0) |
| [15] |
李兴霖, 秦平, 葛菁萍, 等. 共培养提高解磷菌解无机磷能力及解无机磷基因(pqqE)的克隆[J]. 中国农学通报, 2015(23): 47-52. DOI:10.11924/j.issn.1000-6850.casb15030235 (  0) 0) |
| [16] |
YANG G F, WEI Z, SUN W J, et al. Purification and enzymatic characterization of membrane-bound D-gluconate dehydrogenase from Arthrobacter globiformis[J]. J Mol Catal B-Enzym, 2015, 113: 14-22. DOI:10.1016/j.molcatb.2014.12.014 (  0) 0) |
| [17] |
TRIPURA C B, SASHIDHAR B, PODILE A R. Ethyl methanesulfonate mutagenesis enhanced mineral phosphate solubilization by groundnut-associated Serratia marcescens GPS-5[J]. Curr Microbiol, 2007, 54(2): 79-84. DOI:10.1007/s00284-005-0334-1 (  0) 0) |
| [18] |
SINGH M, TEJO PRAKASH N. Characterisation of phosphate solubilising bacteria in sandy loam soil under chickpea cropping system[J]. Indian J Microbiol, 2012, 52(2): 167-173. DOI:10.1007/s12088-011-0209-z (  0) 0) |
| [19] |
GOLDSTEIN A H, LIU S T. Molecular cloning and regulation of a mineral phosphate-solubilizing gene from Erwinia herbicola[J]. Nat Biotechnol, 1987, 5(1): 72-74. DOI:10.1038/nbt0187-72 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38

