铁皮石斛Dendrobium officinale为中国九大仙草之一,具有抗肿瘤、抗衰老、增强人体免疫力的作用[1]。其主要活性成分为石斛多糖,其水解为单糖后,葡萄糖所占的比例最高[2]。转化酶(Invertase, IVR, E.C.3.2.1.26) 又称为蔗糖酶或β-D-呋喃果糖苷酶,在植物体中催化蔗糖降解为果糖和葡萄糖,是蔗糖代谢的关键酶之一,包括酸性转化酶(Acid invertase,AI)和中性转化酶(Neutral invertase,NI),高活性的AI与植物幼嫩组织的快速生长、贮藏器官的迅速膨大有关[3-4], 且与蔗糖积累呈显著的负相关关系[5]。前期研究表明,铁皮石斛酸性转化酶的活性与蔗糖积累呈负相关关系,但与还原糖及可溶性多糖呈显著正相关关系,说明酸性转化酶对多糖的积累有重要的贡献作用,可能是由于AI催化蔗糖降解形成葡萄糖和果糖,为多糖的合成提供碳源[6]。Wei等[7]也认为霍山石斛D.huoshanense多糖含量与细胞内还原糖的浓度有关;王博[8]认为霍山石斛类原球茎中还原糖和可溶性多糖含量与蔗糖转化酶及蔗糖合成酶活性相关。对多糖的研究主要集中于含量测定、化学成分分析及药理作用,关于多糖的代谢途径尚不清楚,本研究克隆了铁皮石斛可溶性酸性转化酶(Soluble acid invertase, SAI)基因SAI,并进行实时定量表达分析,为进一步研究该基因表达调控和功能奠定基础。
1 材料与方法 1.1 材料与试剂铁皮石斛由云南红河州巨峰石斛种植有限公司提供,以1年生幼嫩叶片为材料进行SAI基因克隆。以1年生、2年生和3年生的根、茎、叶为材料分析铁皮石斛不同年龄和不同组织中SAI基因的表达。
大肠埃希菌DH5α,Marker DL2000 Plus购于北京全式金生物公司,pMD19-T (D102A)载体、5′RACE试剂盒(编号D315)、3′RACE试剂盒(编号D314) 购于TaKaRa公司,总RNA提取试剂盒、DNA消化试剂盒、反转录酶SuperScript® Ⅲ First-Strand Synthesis SuperMix及qPCR反应试剂PowerUp® SYBR® Green Master Mix购于美国Life Technologies公司。PCR反应试剂浓度为TaKaRa LA Taq® 5 U· μL-1、4种dNTP各2.5 mmol· L-1、常规引物10 μmol· L-1、RT-PCR引物20 μmol·L-1。PCR产物用12 g·L-1琼脂糖凝胶电泳检测。
1.2 铁皮石斛SAI基因克隆用RNA提取试剂盒提取铁皮石斛总RNA,RNA纯度采用Merinton SMA4000超微量分光光度计(北京普莱恒通科技有限公司)测定。用DNA消化试剂盒及反转录试剂盒进行消化及反转录。根据Genbank中SAI基因的保守区域,设计铁皮石斛SAI基因的特异性扩增引物SAIF1(5′-GGCACGGGTATGTGGGAGTG-3′)和SAIR1(5′-GGTCATAAAATGTCTTTGATGC-3′),以cDNA为模板进行PCR扩增,反应体系(50 μL)为:cDNA 2 μL,TaKaRa LA Taq® 0.5 μL,10×LA PCR Buffer Ⅱ(含Mg2+)5 μL,dNTP 8 μL,SAIF1和SAIR1各2 μL,灭菌水:30.5 μL。反应程序为94 ℃ 5 min;94 ℃ 30 s,51℃ 45 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。将扩增获得片段克隆到pMD19-T载体上,送上海生工测序。
1.3 铁皮石斛SAI基因3′端克隆根据“1.2”获得的SAI基因部分序列,设计2条上游特异引物SAIF2(5′-AATGAGAACAAGTGGGTG-3′)和SAIF3(5′-GCATCAAAGACATTTTATGACC-3′)。采用3′-RACE试剂盒进行巢式PCR扩增,以引物SAIF2及试剂盒中的Outer Primer进行第1轮PCR扩增,反应体系(50 μL)为:反转录反应液1μL,1×cDNA Dilution Buffer Ⅱ 8 μL,SAIF2引物1 μL,3′RACE Outer Primer 1 μL,TaKaRa LA Taq® 0.25 μL,10×LA PCR Buffer Ⅱ(含Mg2+) 5 μL,灭菌水33.75 μL。反应程序为:94 ℃ 3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,20个循环;72 ℃ 10 min。以第1次PCR产物为模板,以SAIF3及Inner Primer为引物进行第2轮PCR扩增,反应体系(50 μL)为:Outer PCR产物1 μL,dNTP 8 μL,SAIF3引物1 μL,3′RACE Inner Primer 1 μL,TaKaRa LA Taq® 0.25 μL,10×LA PCR Buffer Ⅱ(含Mg2+)5 μL,灭菌水33.75 μL。反应程序为:94 ℃ 3 min;94 ℃ 30 s,51 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。将扩增获得片段克隆到pMD19-T载体上,送上海生工测序。
1.4 铁皮石斛SAI基因5′端克隆用5′-RACE试剂盒克隆SAI基因的5′端序列,根据“1.2”获得的SAI基因部分序列设计2条特异性下游引物SAIR2(5′-ATCAACGCTTACAGGAAA-3′)和SAIR3(5′-CACCCACTTGTTCTCATT-3′)。以引物SAIR2及Outer Primer进行第1轮PCR反应,反应体系(50 μL)为:反转录反应液2 μL,1×cDNA Dilution Buffer Ⅱ 8 μL,SAIR2引物1 μL,5′RACE Outer Primer 1 μL,TaKaRa LA Taq® 0.25 μL,10×LA PCR Buffer Ⅱ(含Mg2+) 5 μL,灭菌水32.75 μL。反应程序为:94 ℃ 3 min,94 ℃ 30 s,52℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。以第1次PCR产物为模板进行第2轮PCR反应,反应体系同“1.3”中第2轮PCR的反应体系(引物替换为SAIR3和5′RACE Inner Primer)。反应程序为:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。将扩增获得片段克隆到pMD19-T载体上,送上海生工测序。用DNAMAN软件进行序列拼接。
1.5 铁皮石斛SAI基因的全长扩增根据拼接序列设计特异引物SAIF4(5′-GCATGCTCTACACCGGTTCCACCAA-3′)和SAIR4(5′-GCTTATGAGAATTGGTATGCGTG-3′)扩增铁皮石斛ORF全长。反应体系参照“1.2”。反应程序为:94 ℃5 min;94 ℃ 30 s,53 ℃ 45 s,72 ℃ 2 min,35个循环;72 ℃ 10 min。将扩增获得片段克隆到pMD19-T载体上,送上海生工测序。
1.6 铁皮石斛SAI基因的生物信息学分析采用Computer pI/Mw Tool在线软件进行蛋白分析,使用ExPASyProtParamTool预测蛋白质的理化性质,利用TMHMM的Transmembrane Prediction Server预测跨膜结构域,使用Swiss-model进行二级结构预测和结构域分析。
1.7 铁皮石斛SAI基因的qRT-PCR分析根据已经获得的铁皮石斛SAI基因序列,设计RT-PCR扩增引物SAIF5(5′-GCTGGGCTTGACACATCGG -3′)和SAIR5(5′-CCACTTGTTCTCATTAGCATCATACC -3′),目的片段123 bp。根据金钗石斛D.nobile内参基因GAPDH(GQ250049.1) 设计内参引物GAPDHF(5′-GTGCCAAGAAGGTTATCATCT-CTG-3′)和GAPDHR(5′-CTCATGCTCATTAACACCAACAAC-3′),目的片段74 bp。使用ABI7500荧光定量PCR仪进行实时定量分析,每个样本重复3次,反应体系(20 μL)为:cDNA 5 μL,PowerUp® SYBR® Green Master Mix 10 μL,正向引物0.2 μL,反向引物0.2 μL,50×ROX 0.04 μL,灭菌水4.56 μL。反应程序为:95 ℃ 2 min;95 ℃ 10 s,60 ℃34 s,72 ℃ 30 s,45个循环;循环结束后从60 ℃升高到98 ℃获取熔解曲线。采用SPSS17.0软件LSD多重比较进行显著差异分析。
2 结果与分析 2.1 铁皮石斛SAI基因全长扩增与同源性分析经SMA4000超微量分光光度计测定,各样本总RNA纯度高、完整性好。以铁皮石斛cDNA为模板,SAIF1及SAIR1为引物,PCR扩增获得1条清晰、特异性好的条带,将扩增产物纯化后连接到pMD19-T载体上,筛选阳性质粒、测序。将测序结果进行BLASTx比对,结果显示其与柑橘Citrus unshiu酸性转化酶基因序列、甜橙C.sinensis酸性β-呋喃果糖苷酶基因序列相似性最高,达77%,与其他植物酸性转化酶基因序列相似性均高于68%。
根据已获得的片段设计特异引物,采用RACE试剂盒进行3′端和5′端扩增,3′端扩增获得930 bp左右的片段,5′端获得450 bp左右的片段,测序后进行NCBI BLASTx比对。DANMAN软件拼接后获得1 595 bp的序列,利用ORF finder查找完整的开放阅读框,其ORF包含1 368个碱基,编码455个氨基酸,5′端非编码区有111 bp,3′端非编码区有116 bp。根据ORF设计引物(SAIF4/SAIR4) 扩增编码区,获得了1条特异性较好的条带,大小为1 368 bp(图 1)。
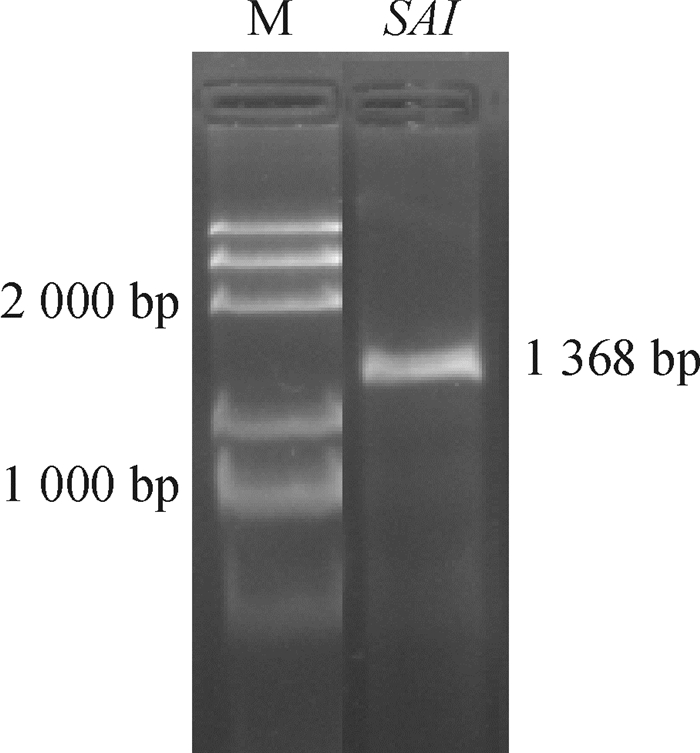
|
图 1 铁皮石斛SAI基因全长扩增 Figure 1 Amplification of full length of SAI gene of Dendrobium officinale M: Marker DL2000 Plus。 |
采用在线软件Computer pI/MW Tool对SAI基因进行蛋白分析,该序列相对分子质量为50 7000,理论等电点5.32。使用在线软件ExPASyProtParamTool分析SAI基因的氨基酸组成,该序列编码的氨基酸中丙氨酸所占的比例最大,占8.1%。其不稳定系数为37.8,无信号肽,基因编码的蛋白是非跨膜结构的亲水性热稳定蛋白,完全在细胞内起作用,定位于液泡中。BLASTx预测该蛋白功能结构域,发现该蛋白含有多个功能结构域和保守结构,其中包括糖基转化酶家族32的保守结构域(图 2)。
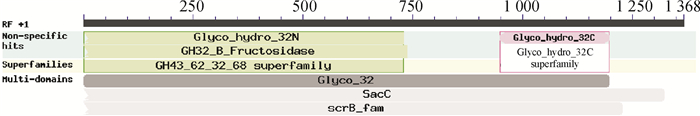
|
图 2 铁皮石斛SAI基因保守结构域 Figure 2 Conservative structure domains of SAI gene of Dendrobium officinale |
采用MEGA5软件UPGMA法对Genbank中部分植物的酸性转化酶基因氨基酸序列进行聚类分析,从图 3可以看出,铁皮石斛SAI基因氨基酸序列与玉米Zea mays液泡转化酶基因、甘蔗Saccharum officinarum SAI基因的亲缘关系最近,三者聚为一类。

|
图 3 植物酸性转化酶基因氨基酸序列的系统进化树 Figure 3 Phylogenetic tree of amino acid sequences of plant acid invertase genes |
使用2-ΔΔCt分析方法[9],将1年生铁皮石斛根的SAI基因表达量设为对照,即2-ΔΔCt值定义为1。从图 4可以看出,SAI基因在铁皮石斛不同发育阶段不同组织的表达量差异较大。在2年生茎中的表达量最高,是1年生和3年生茎的表达量的2.4倍左右,差异显著(P < 0.05),但在1年生和3年生茎中基因表达量无显著差异。在根中,SAI基因的表达量随生育年限的增加呈逐年增加的趋势,但变化幅度较小,1年生与3年生间存在显著差异。在叶中,1年生的表达量最高,显著高于2年生和3年生叶的表达量。
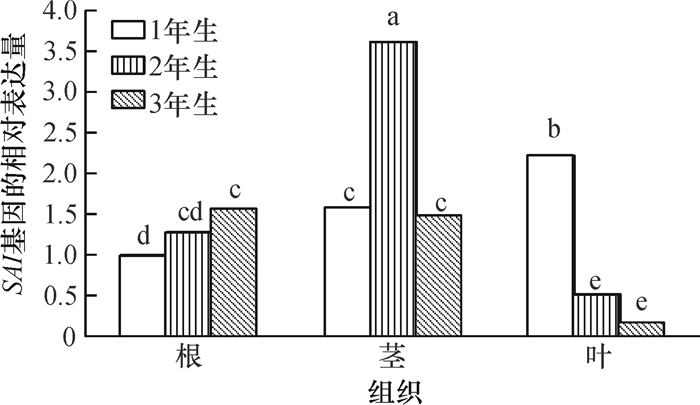
|
图 4 铁皮石斛SAI基因表达的时空特异性分析 Figure 4 Spatio-temporal expression analysis of SAI gene in Dendrobium officinale 柱子上凡具有一个相同小写字母者,表示差异不显著(P>0.05,LSD法)。 |
酸性转化酶是催化蔗糖不可逆降解的关键酶之一,在植物的生长发育和形态建成过程中具有重要作用。酸性转化酶是由1个多基因家族编码的蛋白质[10-11],分为细胞壁酸性转化酶亚家族和液泡酸性转化酶亚家族,在不同种植物或同一种植物的不同部位的多基因家族的不同成员间的相对分子质量不同,从50 000到80 000不等,为单体或二聚体。液泡酸性转化酶在多数植物中至少有2个同工酶,以可溶性蛋白积累于液泡的酸性区域。
本研究克隆了铁皮石斛SAI基因cDNA全长为1 595 bp,ORF编码区为1 368 bp,共编码455个氨基酸,其蛋白相对分子质量为50 700。与其他植物液泡酸性转化酶基因的氨基酸进行同源分析,相似性最高为77%,最低也在68%以上。该基因编码的蛋白具有糖基转化酶家族32的保守结构域,靠近N-末端含有1个β-呋喃果糖苷酶的特征序列,即五肽NDPNG/A保守结构,靠近C-末端还有1个半胱氨酸(Cys)残基及其MWECV/P结构域,这些均为酸性转化酶的催化和功能结构域[12],因此,初步鉴定本研究克隆的基因为铁皮石斛液泡酸性转化酶基因。
在植物生长发育的不同阶段以及不同的器官组织中,酸性转化酶基因的表达具有时间与空间上的差异[13-14]。本研究表明,SAI基因在1年生铁皮石斛根、茎、叶中的表达量较高,主要促进植物的生长发育和形态建成[15]。SAI基因在2年生铁皮石斛茎中的表达量最高,主要促进蔗糖分解成葡萄糖和果糖,为多糖的积累提供基础,这与诸燕等[16]观点一致,认为2年生铁皮石斛可溶性多糖的积累最快,进一步证实铁皮石斛酸性转化酶活性与可溶性多糖的积累有直接关系,可溶性多糖的合成是以葡萄糖、果糖等单糖为起点的。
在甘蔗、胡萝卜等植物中均发现有2个可溶性酸性转化酶基因,甘蔗中AI的2个同工酶相对分子质量为61 100和74 400,在胡萝卜中的相对分子质量分别为61 000和49 000[17-18]。酸性转化酶基因反义转入马铃薯中,使马铃薯中还原糖和淀粉含量降低[19],转入甜瓜中,使葡萄糖、果糖含量降低,蔗糖含量升高[20]。因此,下一步需进行铁皮石斛SAI基因的遗传转化研究,为铁皮石斛SAI基因功能研究以及分子育种和遗传改良奠定基础。
| [1] |
国家药典委员会. 中华人民共和国药典: 1部[S]. 北京: 中国医药科技出版社, 2010: 265.
(  0) 0) |
| [2] |
黄民权, 黄步汉, 蔡体育, 等. 铁皮石斛多糖的提取、分离和分析[J]. 中草药, 1994, 25(3): 128-129. (  0) 0) |
| [3] |
YAMADA K, KOJIMA T, BANTOG N, et al. Cloning of two isoforms of soluble acid invertase of Japanese pear and their expression during fruit development[J]. J Plant Physiol, 2007, 164(6): 746-755. DOI:10.1016/j.jplph.2006.05.007 (  0) 0) |
| [4] |
TIAN H, KONG Q, FENG Y, et al. Cloning and characterization of a soluble acid invertase-encoding gene from muskmelon[J]. Mol Biol Rep, 2009, 36(3): 611-617. DOI:10.1007/s11033-008-9219-2 (  0) 0) |
| [5] |
WANG A Q, HUANG W J, NIU J Q, et al. Effects of ethephon on key enzymes of sucrose metabolism in relation to sucrose accumulation in sugarcane[J]. Sugar Tech, 2013, 15(2): 177-186. DOI:10.1007/s12355-012-0202-9 (  0) 0) |
| [6] |
杨骏, 孟衡玲, 杨生超, 等. 铁皮石斛可溶性糖含量与蔗糖代谢酶活性的相关性研究[J]. 西部林业科学, 2012, 41(2): 62-67. (  0) 0) |
| [7] |
WEI M, JANG S T, LUO J P. Enhancement of growth and polysaccharide production in suspension cultures of protocorn-like bodies from Dendrobium huoshanense by the addition of putrescine[J]. Biotechnol Lett, 2007, 29(3): 495-499. DOI:10.1007/s10529-006-9248-7 (  0) 0) |
| [8] |
王博. 水杨酸调节霍山石斛类原球茎生长和多糖合成的研究[D]. 合肥: 合肥工业大学, 2009.
(  0) 0) |
| [9] |
张驰宇, 徐顺高, 黄新祥. 一种新颖简便的荧光实时RT-PCR相对定量方法的建立[J]. 生物化学与生物物理进展, 2005, 32(9): 883-888. (  0) 0) |
| [10] |
HAOUAZINE-TAKVORIA N, TYMOWSKA-LALANNE Z, TAKVORIAN A, et al. Characterization of two members of the Arabidopsis thaliana gene family, Atβfruct3 and Atβfruct4, coding for vacuolar invertases[J]. Gene, 1997, 197(1/2): 239-251. (  0) 0) |
| [11] |
刘慧英, 朱祝军. 转化酶在高等植物蔗糖代谢中的作用研究进展[J]. 植物学通报, 2002, 19(6): 666-674. (  0) 0) |
| [12] |
SCHROEVEN L, LAMMENS W, VAN LAERE A, et al. Transforming wheat vacuolar invertase into a high affinity sucrose: Sucrose 1-fructosyltransferase[J]. New Phytol, 2008, 180(4): 822-831. DOI:10.1111/nph.2008.180.issue-4 (  0) 0) |
| [13] |
欧庸彬. 马铃薯液泡酸性转化酶基因的表达调控机制研究[D]. 武汉: 华中农业大学, 2013.
(  0) 0) |
| [14] |
HEDLEY P E, MACHRAY G C, DAVIES H V. Potato (Solanum tuberosum) invertase-encoding cDNAs and their differential expression[J]. Gene, 1994, 145(2): 211-214. DOI:10.1016/0378-1119(94)90007-8 (  0) 0) |
| [15] |
潘秋红, 张大鹏. 植物酸性转化酶基因及其表达调控[J]. 植物学通报, 2005, 22(2): 129-137. (  0) 0) |
| [16] |
诸燕, 斯金平, 郭宝林, 等. 人工栽培铁皮石斛多糖含量变异规律[J]. 中国中药杂志, 2010, 35(4): 427-430. (  0) 0) |
| [17] |
郑月霞, 许玉林, 张积森, 等. 甘蔗可溶性酸性转化酶基因的克隆及序列分析[J]. 热带作物学报, 2012, 33(11): 2007-2011. DOI:10.3969/j.issn.1000-2561.2012.11.017 (  0) 0) |
| [18] |
牛俊奇, 王爱勤, 黄静丽, 等. 甘蔗可溶性酸性转化酶(SoSAI1) 基因的克隆及表达分析[J]. 中国农业科学, 2013, 46(24): 5248-5260. DOI:10.3864/j.issn.0578-1752.2013.24.019 (  0) 0) |
| [19] |
王清, 黄惠英, 张金文, 等. 反义酸性转化酶基因对低温贮藏马铃薯块茎还原糖和淀粉含量的影响[J]. 植物生理与分子生物学学报, 2005, 31(5): 533-538. (  0) 0) |
| [20] |
樊继德. 甜瓜酸性转化酶基因表达特性分析及功能鉴定[D]. 泰安: 山东农业大学, 2007.
(  0) 0) |
 2017, Vol. 38
2017, Vol. 38

