牛流行热是由牛流行热病毒(Bovine ephemeral fever virus, BEFV)引起的一种非接触传染性疾病,黄牛、奶牛和水牛易感,其他反刍动物也可感染本病[1]。该病主要由蚊虫叮咬而传播,临床上以突然发热、精神沉郁、大量流涎、僵硬、跛行,甚至卧地不起等为特征。本病传播迅速,发病率高,病死率近年来有所上升,甚至出现急性呼吸衰竭病例。本病通常呈周期性流行,每隔3~5年发生1次较大规模的流行,发病季节多为5—10月份。世界多地均有此病流行[2]。我国最早在1955年就出现过本病的报道,1976年首次分离到牛流行热病毒株JB76H[3-4]。广东地区近几年均有发生,该病的发生周期有变短的趋势,严重危害养牛业[4]。
牛流行热的常规诊断方法为血清学检测方法[5-7],目前,国内主要采用微量血清中和试验方法,由于需使用活病毒,且在试验前需要测定病毒的TCID50,不仅费时费力,检测周期长,影响了牛流行热的快速诊断,还存在病毒污染扩散的风险。ELISA检测技术的建立,某种程度也为牛流行热抗体的筛查提供了便利条件[8],核酸检测技术中的普通PCR和荧光定量PCR等技术,具有敏感、快速、特异和高通量等优点[9-10],已广泛用于多种重要疫病病原体的检测,刘志玲等[11]建立了牛流行热病毒LUX-TM荧光RT-PCR检测方法,具有较好的检测准确度和灵敏度,但是荧光定量检测需要昂贵的仪器,且检测试剂成本较高。建立快速高效、低成本的分子生物学诊断方法,对牛流行热的防控具有重要的意义。
逆转录环介导等温扩增(Reverse transcription loop-mediated isthermal amplification,LAMP)技术的出现,在多种病原的检测方面发挥了巨大的作用,尤其是该方法简便、易于操作,对仪器设备要求不高,适合临床生产一线使用[12-14]。通过对LAMP技术的改进,在反应体系中加入显色成分钙黄绿素,还能实现反应产物的可视化[15]。这样直接通过肉眼观察颜色变化即可判定结果,具有较好的临床应用前景。
1 材料与方法 1.1 病毒RNA2013—2015年广东地区牛流行热流行期病牛抗凝血由本实验室采集保存,赤羽病病毒(Akabane virus, AKV)核酸、牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus, IBRV)核酸、牛病毒性腹泻病毒(Bovine viral diarrhea virus, BVDV)核酸由广东检验检疫技术中心动检实验室惠赠。
1.2 试剂RNA抽提试剂盒购自Invitrogen;AMV Reverse Transcriptase购自Promega公司;Bst DNA聚合酶购自TOYOBO公司;甜菜碱购自Sigma公司。
1.3 仪器Bio-Rad梯度PCR仪、Bio-Rad型电泳仪:美国Bio-Rad公司生产;凝胶成像系统:美国Alpha公司生产;5810R冷冻离心机:德国Eppendorf公司生产;恒温水浴箱:德国GFL公司生产。
1.4 引物的设计与合成参照Genbank中BEFV糖蛋白G的基因序列,应用DNAStar 7.0软件MegAlign 5.0程序进行分析,利用在线软件(http://primerexplorer.jp/elamp4.0.0 /index.html)在序列保守区域设计LAMP引物(表 1),其中,F3、B3为外引物,FIP、BIP为内引物。
|
|
表 1 LAMP引物 Table 1 LAMP Primers |
按照RNA抽提试剂盒的说明书进行病毒RNA的抽提,提取的RNA在-80 ℃条件下保存备用。
1.6 RT-LAMP方法的优化及建立参照国内其它病毒的LAMP检测反应体系,以牛流行热病毒RNA为模板,先建立一个25 μL LAMP反应体系:5 mmol·L-1的甜菜碱5.0 μL、100 mmol·L-1的MgSO4 1.0 μL、8 U·μL-1的Bst DNA聚合酶1.0 μL、10×Bst DNA聚合酶缓冲液2.5 μL、10 mmol·L-1的dNTPs 3.0 μL、BIP(20 μmol·L-1)2.0 μL +FIP(20 μmol·L-1)2.0 μL、F3(20 μmol·L-1)2.0 μL +B3(20 μmol·L-1)2.0 μL、模板RNA 1 μL、5 U·μL-1的AMV反转录酶1.0 μL、RNase inhibitor 0.5 μL、加DEPC水至25 μL。阴性对照模板为DEPC水,反应后用15 g·L-1琼脂糖凝胶电泳检测扩增结果。
之后根据反应优化策略,对Mg2+浓度、甜菜碱浓度、Bst DNA聚合酶浓度、dNTP浓度、引物浓度等条件分别进行优化。设置反应温度为60、61、62、63、64和65 ℃,确定最佳退火温度。反应时间以10 min起始,每隔10 min取样检测至1 h,确定最佳反应时间。
1.7 RT-LAMP方法的灵敏性检测将抽提获得的RNA进行10倍梯度逐级稀释,以100、10-1、10-2、10-3、10-4、10-5和10-6不同稀释液作为模板,利用所建立的RT-LAMP反应体系和RT-PCR检测方法进行灵敏性比对。
1.8 RT-LAMP方法的特异性检测分别抽提牛流行热病毒(BEFV)、牛赤羽病病毒(AKV)、牛传染性支气管炎病毒(IBRV)、牛病毒性腹泻病毒(BVDV)RNA,同时设立阴性对照,采用上面已经优化的反应体系和条件,检测RT-LAMP方法的特异性。
1.9 RT-LAMP反应产物的分析LAMP反应体系存在扩增产物,在反应前RT-LAMP体系中按体积比加入1:10的钙黄绿素和氯化锰,反应结束后,样品根据反应结果不同而呈现不同颜色。使用琼脂糖凝胶电泳技术对产物进行分析,阳性反应呈现弥散型条带。
1.10 临床样品检测对采集自广东地区的56份疑似病牛全血,经RNA抽提后分别进行LAMP检测和普通PCR检测。
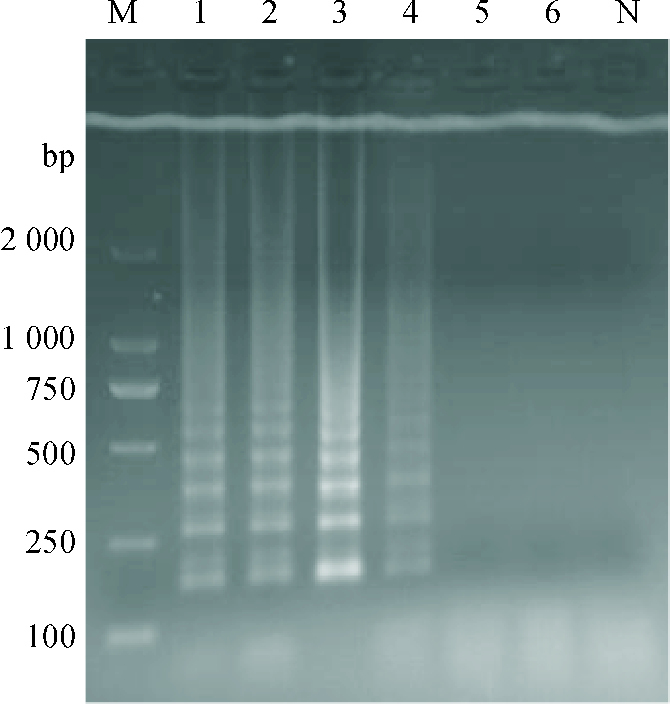
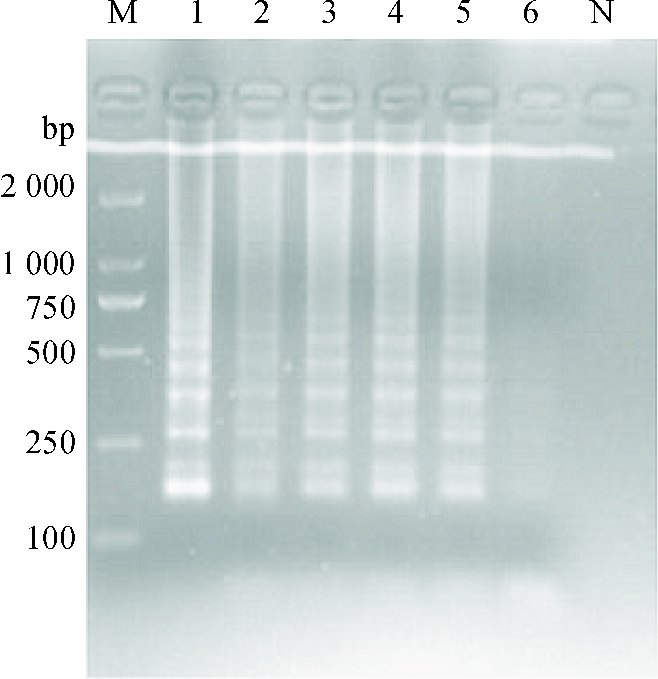
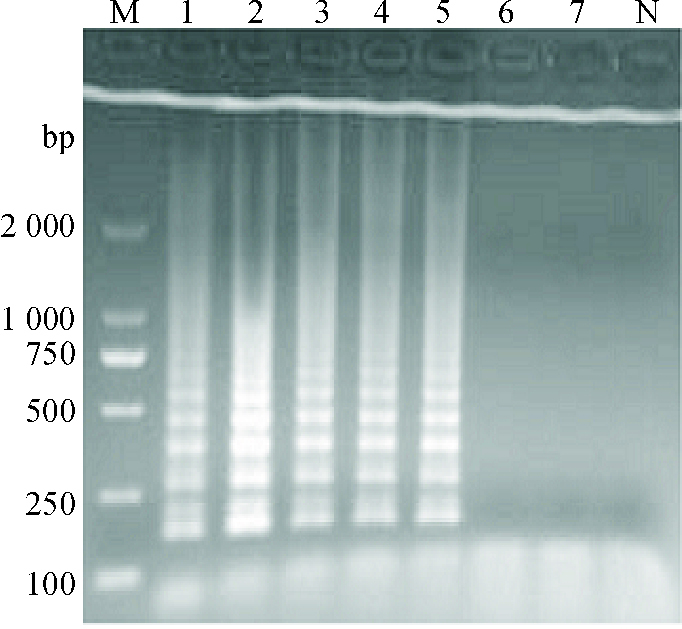
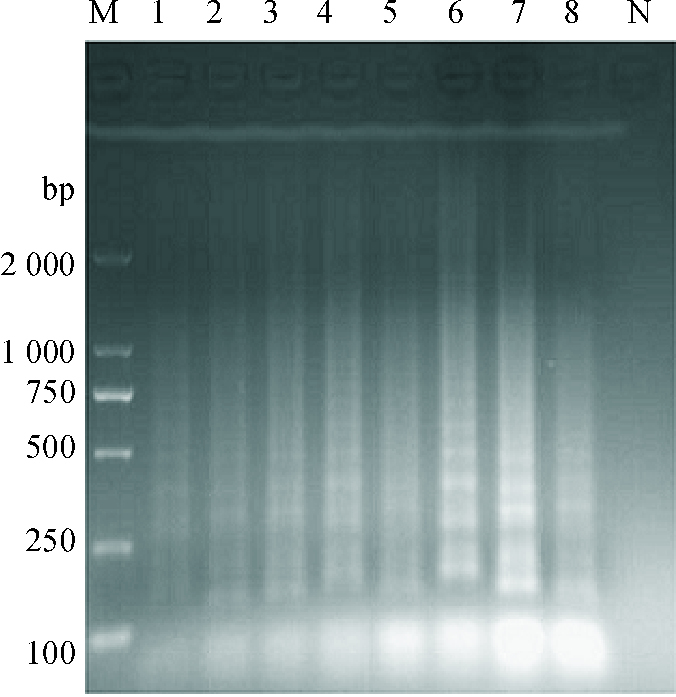
2 结果与分析 2.1 LAMP反应条件的优化通过对反应体系的优化,可见当Mg2+浓度为3 mmol·L-1(图 1)、甜菜碱浓度为0.4 mol·L-1(图 2)、dNTPs mix浓度为1.2 μmol·L-1(图 3)、反应温度为63 ℃(图 4)、内外引物浓度比例为8:1(图 5)时反应梯形条带最明显,在反应40 min后可以观察到明显的梯形条带(图 6),随着时间的延长,条带变得更加清晰。
|
图 1 LAMP反应体系Mg2+浓度的优化 Figure 1 Optimization of Mg2+ concentration in the LAMP reaction system M:DL2000 Marker;1:1 mmol·L-1;2:2 mmol·L-1;3:3 mmol·L-1;4:4 mmol·L-1;5:5 mmol·L-1;6:6 mmol·L-1;N:阴性对照。 |
|
图 2 LAMP反应体系甜菜碱浓度的优化 Figure 2 Optimization of betaine concentration in the LAMP reaction system M:DL2000 Marker;1:0.4 mol·L-1;2:0.6 mol·L-1;3:0.8 mol·L-1;4:1.0 mol·L-1;5:1.2 mol·L-1;6:1.4 mol·L-1;N:阴性对照。 |
|
图 3 LAMP反应体系dNTPs mix浓度的优化 Figure 3 Optimization of dNTPs mix concentration in the LAMP reaction system M:DL2000 Marker;1:0.8 μmol·L-1;2:1.2 μmol·L-1;3:1.6 μmol·L-1;4:2.0 μmol·L-1;5:2.4 μmol·L-1;6:2.8 μmol·L-1;7:3.2 μmol·L-1;N:阴性对照。 |

|
图 4 LAMP反应温度的优化 Figure 4 Optimization of LAMP reaction temperature M:DL2000 Marker;1:60℃;2:61℃;3:62℃;4:63℃;5:64℃;6:65℃。 |
|
图 5 LAMP反应体系内外引物比例优化 Figure 5 Optimization of the ratio of inner to outer primers in the LAMP reaction system M:DL2000 Marker;1:0.2 μmol·L-1(FIP+BIP), 0.2 μmol·L-1(F3+B3);2:0.2 μmol·L-1(FIP+BIP), 0.4 μmol·L-1(F3+B3);3:0.2 μmol·L-1(FIP+BIP), 0.8 μmol·L-1(F3+B3);4:0.2 μmol·L-1(FIP+BIP), 1.0 μmol·L-1(F3+B3);5:0.2 μmol·L-1(FIP+BIP), 1.2 μmol·L-1(F3+B3);6:0.2 μmol·L-1(FIP+BIP), 1.6 μmol·L-1(F3+B3);7:0.2 μmol·L-1(FIP+BIP), 1.8 μmol·L-1(F3+B3);8:0.2 μmol·L-1(FIP+BIP), 2.0 μmol·L-1(F3+B3);N:阴性对照。 |
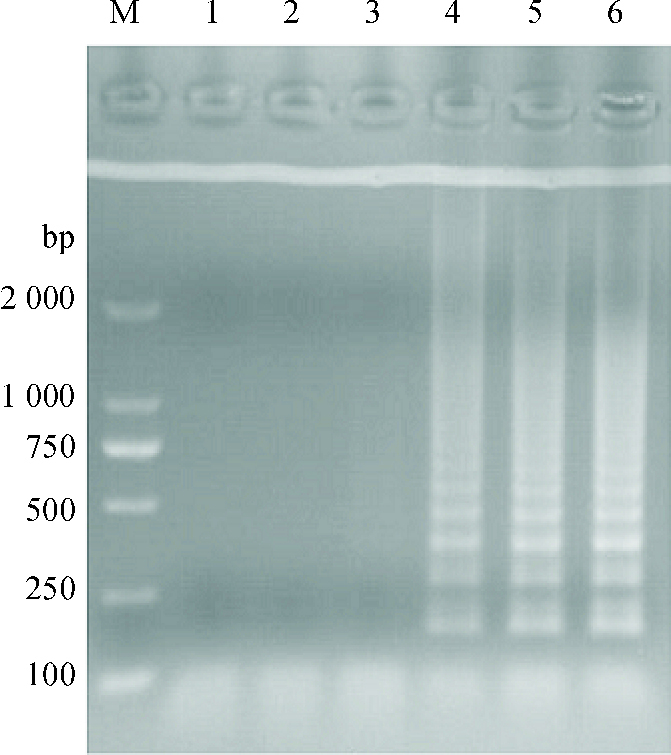
|
图 6 LAMP反应时间的优化 Figure 6 Optimization of LAMP reaction time M:DL2000 Marker;1:10 min;2:20 min;3:30 min;4:40 min;5:50 min;6:60 min。 |
由图 7可见,在将RNA原液稀释100、10-1、10-2和10-3倍后作为模板时,LAMP扩增的产物都出现明显的梯形条带,而普通PCR的扩增产物只有当RNA原液稀释100、10-1和10-2倍出现明显的条带,两者的检测灵敏度相比,LAMP的检测灵敏度提高了10倍。
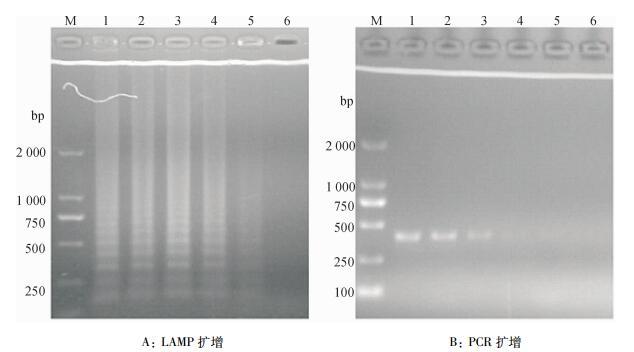
|
图 7 LAMP扩增与PCR灵敏性对比 Figure 7 Sensitivity comparison of LAMP and PCR M:DL2000 Marker;1~6:RNA稀释倍数依次为100、10-1、10-2、10-3、10-4、10-6。 |
分别以BEFV、AKV、IBRV、BVDV作为样品,检测建立的LAMP方法的特异性。从图 8中可以看出,只有以BEFV阳性样品为模板的泳道内出现了明显的梯形条带,其他样品为阴性。结果表明LAMP引物对BEFV具有专一性,依此可区分与牛流行热症状相似的一些牛病。
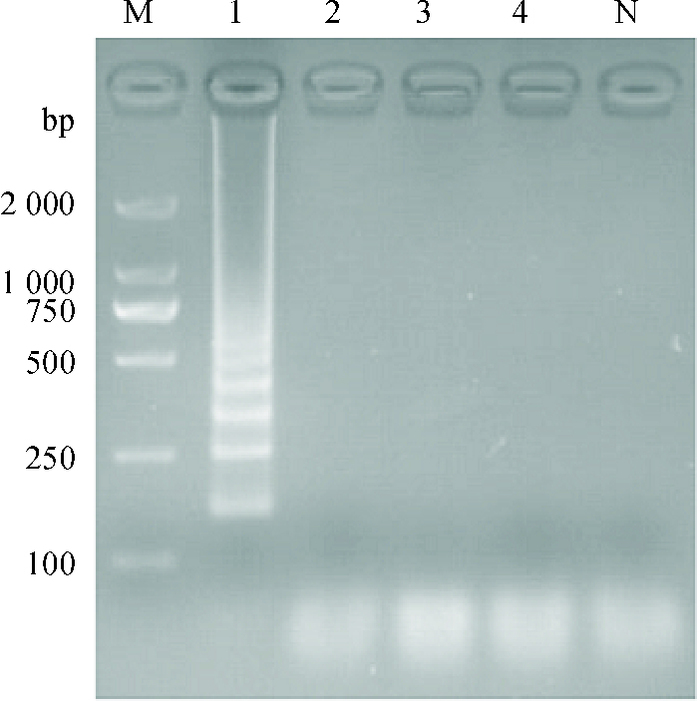
|
图 8 BEFV LAMP反应特异性 Figure 8 Specificity of the LAMP assay detecting BEFV M:DL2000 Marker;1:BEFV(牛流行热病毒);2:AKV(赤羽病病毒);3:IBRV(牛传染性鼻气管炎病毒);4:BVDV(牛病毒性腹泻病毒);N:阴性对照。 |
LAMP反应体系存在扩增产物,在反应前RT-LAMP体系中按体积比加入1:10的钙黄绿素和氯化锰,反应结束后,阳性样品呈浅绿色,阴性样品呈橘红色(图 9)。

|
图 9 BEFV LAMP可视化检测结果 Figure 9 Visualization test of the LAMP assay detecting BEFV 1:阴性样品;2~4:阳性样品。 |
对临床采集的56份疑似牛流行热样品进行检测。PCR方法检测出5份阳性样品,阳性检出率为8.93%,而LAMP方法则检测出6份阳性样品,阳性检出率为10.70%。
3 讨论与结论LAMP是一种在恒温条件下,高效、特异、快速的扩增靶标序列的核酸检测技术[11]。本研究在牛流行热病毒G蛋白基因的6个位点设计4条引物,通过对反应体系和反应条件的优化,建立了可视化RT-LAMP检测方法。利用该方法对牛流行热病毒(BEFV)及IBRV、AKAV、BVDV的RNA进行特异性检测,结果表明该可视化LAMP检测方法对BEFV具有良好的特异性,对BEFV病料中核酸的最低检测限是常规PCR灵敏度的10倍。采用该方法对临床样品进行检测,其中阳性检出率为10.70%,高于普通PCR的检出率(8.93%)。为了便于结果的观测,国内外学者对LAMP检测技术进行显色反应[15]。目前的研究中多数采用SYBR Green I,该方法需在反应结束后打开反应管,加入SYBR Green I方能发挥显色指示作用,根据颜色的不同,从而判定检测结果,该方法简便易行,试剂也相对便宜,但是显色反应需要开盖添加SYBR Green I,这时容易产生气溶胶,由于LAMP反应本身的高特异性和灵敏性,极易导致实验室污染,产生假阳性结果。也有研究者使用浊度仪实时监测LAMP反应结果,但该方法在实际操作中要使用价格昂贵的浊度仪,不利于基层实验室开展检测工作。本研究利用钙黄绿素与Mn2+结合而不发荧光,随着反应的进行,产生了大量更易与Mn2+结合的焦磷酸根离子,从而释放钙黄绿素,游离的钙黄绿素可自发荧光,且Mg2+存在的环境中荧光效果得到加强的原理,使用钙黄绿素+Mn2+混合液替代SYBR Green I进行结果显色指示[15],无需开盖,直接通过肉眼观察颜色变化即可判定检测结果[15]。
| [1] |
NANDI S, NEGI B S. Bovine ephemeral fever: A review[J]. Comp Immunol Microbiol Infect Dis, 1999, 22(2): 81-91. DOI:10.1016/S0147-9571(98)00027-7 (  0) 0) |
| [2] |
AZIZ-BOARON O, KLAUSNER Z, HASOKSUZ M, et al. Circulation of bovine ephemeral fever in the Middle East--strong evidence for transmission by winds and animal transport[J]. Vet Microbiol, 2012, 158(3/4): 300-307. (  0) 0) |
| [3] |
DAVIES F G, OCHIENG P, WALKER A R. The occurrence of ephemeral fever in Kenya, 1968-1988[J]. Vet Microbiol, 1990, 22(2/3): 129-136. (  0) 0) |
| [4] |
ZHENG F, LIN G, ZHOU J, et al. A reverse-transcription, loop-mediated isothermal amplification assay for detection of bovine ephemeral fever virus in the blood of infected cattle[J]. J Virol Methods, 2011, 171(1): 306-309. DOI:10.1016/j.jviromet.2010.10.028 (  0) 0) |
| [5] |
LI Z, ZHENG F, GAO S, et al. Large-scale serological survey of bovine ephemeral fever in China[J]. Vet Microbiol, 2015, 176(1/2): 155-160. (  0) 0) |
| [6] |
吴清明, 魏文才, 陈水生, 等. 奶牛流行热疫情的防控应对[J]. 南方奶业, 2013(1): 11-13. (  0) 0) |
| [7] |
白文彬, 姜春凌, 严隽端, 等. 牛流行热病毒微量血清中和试验[J]. 中国畜禽传染病, 1988(4): 40-43. (  0) 0) |
| [8] |
ZHENG F Y, LIN G Z, QIU C Q. Development and application of G1-ELISA for detection of antibodies against bovine ephemeral fever virus[J]. Res Vet Sci, 2009, 87(2): 211-212. DOI:10.1016/j.rvsc.2009.03.010 (  0) 0) |
| [9] |
STRAM Y, KUZNETZOVA L, LEVIN A. A real-time RT-quantative(q)PCR for the detection of bovine ephemeral fever virus[J]. J Virol Methods, 2005, 130(1/2): 1-6. (  0) 0) |
| [10] |
BLASDELL K R, ADAMS M M, DAVIS S S. A reverse-transcription PCR method for detecting all known ephemeroviruses in clinical samples[J]. J Virol Methods, 2013, 191(2): 128-135. DOI:10.1016/j.jviromet.2013.04.011 (  0) 0) |
| [11] |
刘志玲, 陈茹, 邱索平, 等. 牛流行热病毒LUXTM荧光RT-PCR检测方法的建立[J]. 生物技术通报, 2010(8): 174-179. (  0) 0) |
| [12] |
NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): 63. DOI:10.1093/nar/28.12.e63 (  0) 0) |
| [13] |
CHEN C, CUI S. Detection of porcine parvovirus by loop-mediated isothermal amplification[J]. J Virol Methods, 2009, 155(2): 122-125. DOI:10.1016/j.jviromet.2008.10.004 (  0) 0) |
| [14] |
SHIVAKOTI S, ITO H, MURASE T, et al. Development of reverse transcription-loop-mediated isothermal amplification (RT-LAMP) assay for detection of avian influenza viruses in field specimens[J]. J Vet Med Sci, 2010, 72(4): 519-523. DOI:10.1292/jvms.09-0473 (  0) 0) |
| [15] |
ZHU R Y, ZHANG K X, ZHAO M Q. Use of visual loop-mediated isotheral amplification of rimM sequence for rapid detection of Mycobacterium tuberculosis and Mycobacterium bovis[J]. J Microbiol Methods, 2009, 78(3): 339-343. DOI:10.1016/j.mimet.2009.07.006 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


