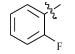
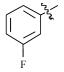
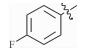
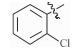
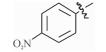
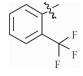
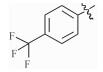
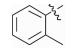
感染鸡毒支原体Mycoplasma gallisepticam 而引起的慢性呼吸道病是危害禽类的常见疾病,严重影响着养禽业的健康发展[1],据不完全统计,鸡毒支原体感染鸡群后,会导致雏鸡弱雏率增加10%左右,蛋鸡产蛋率下降10%~20%,肉鸡体质量减少38%,饲料转化率降低21%,胴体质量亦随之下降,该病已成为严重威胁养禽业的疾病之一[2],而使用抗菌药物是防治鸡毒支原体病的一种重要手段[3]。由于鸡毒支原体没有细胞壁,所以对青霉素类、头孢类等抗菌药不敏感,较为有效的抗菌药有氟喹诺酮类、泰乐菌素、红霉素、庆大霉素、强力霉素、泰妙菌素、沃尼妙林等[4]。其中泰妙菌素等截短侧耳素类衍生物具有独特的抗菌机理,不仅对鸡毒支原体有很好的抑菌效果,而且不易产生耐药性,已经被广泛应用于临床鸡毒支原体病的防治。
截短侧耳素是由 Kavanagh[5]于1951年从高等真担子菌高侧耳属Pleurotus mutilus 和P. passeckerinaus 菌种培养分离得到的一种三环二萜类化合物,其主体结构由五元、六元和八元环骈合而成。因其独特的抑菌机制,药学工作者设计合成了大量新型截短侧耳素衍生物用于抗菌药物开发[6]。截短侧耳素的结构修饰主要集中在C14位侧链上[7],C14位侧链如果连接中性基团或酸性基团的化合物,则抗菌活性极低,连接2个碱性中心侧链的衍生物其活性也较低,而连接1个碱性中心的硫醚基侧链,其衍生物抗菌活性往往较好[8-9]。基于噻唑环能增加多数抗菌药物的活性,Ling等[10]设计合成了侧链上含有噻唑环的截短侧耳素类衍生物,经生物活性分析发现,其对临床分离的MRSA(Methicillin-resistant Stphylococcus aureus)和耐甲氧西林表皮葡萄球菌均有良好的体外抑菌效果。Wang等[11]在截短侧耳素C14侧链上引入2-氨基噻唑得到系列衍生物,对一些革兰氏阳性耐药菌的抗菌活性强于阿莫西林和泰妙菌素。Shang等[12]在C14位侧链引入噻二唑杂环作为连接基团,合成了大量截短侧耳素衍生物,经体外抑菌活性研究,发现其中具有氨基或叔胺基的化合物对MRSA、无乳链球菌具有较好的抗菌活性。但对抑制截短侧耳素衍生物支原体活性的研究并不多见。
基于以上关于截短的工作侧耳素衍生物的合成及活性研究,结合前人的研究成果[12-13],本研究设计合成了C14支链引入噻二唑片段的18种截短侧耳素衍生物,以高分辨质谱对所合成化合物进行结构确证,以鸡毒支原体为研究对象,通过体外药敏试验研究了所合成衍生物取代基团对抑菌活性的影响,以期为新型高效截短侧耳素类动物专用抗支原体感染类药物的研发提供试验依据。
1 材料与方法 1.1 试剂与仪器试验材料:截短侧耳素原料、对甲基本磺酰氯、取代苯甲酰氯、2-氨基-5-巯基-1, 3, 4-噻二唑、吡啶、乙腈、异丙醇、三氯甲烷、乙酸乙酯、石油醚、硅胶板、无菌EP管、无菌猪血清、L-半胱氨酸、辅酶I、NaOH溶液、鸡毒支原体菌株S6;仪器:磁力搅拌器、旋转蒸发仪、紫外灯、循环泵、无菌超净工作台、二氧化碳恒温培养箱、高压灭菌器、LTQ-Orbitrap高分辨质谱仪(赛默飞世尔科技公司,美国)。
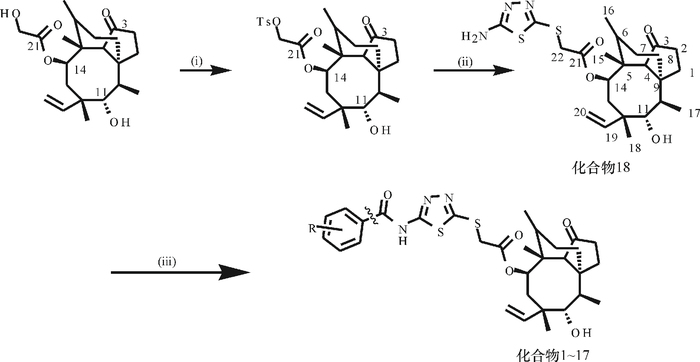
1.2 截短侧耳素衍生物的合成18 种截短侧耳素衍生物的合成在Shang等[13]、王波等[14]合成方法基础上略作改进,具体步骤为以对甲苯磺酰氯活化截短侧耳C14支链上的羟基得对甲苯磺酰化截短侧耳素,碱性条件下与2-氨基-S5-巯基-1, 3, 4-噻二唑反应在截短侧耳素C14支链引入噻二唑环,得到化合物18,最后再与苯环上有不同取代基的苯甲酰氯进行酰基化反应,得到化合物(1~17)(图 1)。所有产物经柱色谱分离得到高纯度的18种含有不同取代基的截短侧耳素衍生物,18种化合物经高分辨质谱进行结构确证。
|
图 1 截短侧耳素衍生物的合成路线 Figure 1 The synthetic route of pleuromutilin derivatives 试剂及反应条件:(ⅰ)对甲苯磺酰氯,吡啶,0 ℃,3 h,产率56.3%;(ⅱ) 2-氨基-5-巯基噻二唑,NaOH,0 ℃,2 h ; (ⅲ)乙酸乙酯,三乙胺,50~70 ℃,48 h。 |
鸡毒支原体培养基(pH7.8):称取鸡毒支原体基础培养基47.4 g,加热溶解于1 000 mL蒸馏水中,116 ℃高压灭菌30 min,冷却至45 ℃左右加入150 mL无菌猪血清(猪血清56 ℃灭活30 min),以及L-半胱氨酸0.125 g和还原型辅酶Ⅰ0.125 g,用无菌1 mol·mL-1NaOH溶液调pH至7.8左右。密封放4 ℃保存,于1个月内使用。
1.3.2 鸡毒支原体菌株S6的启用鸡毒支原体标准株S6,购自中国兽医药品监察所。取鸡毒支原体标准株S6冻干粉接种于鸡毒支原体液体培养基中,置于5%(φ)二氧化碳培养箱,37 ℃培养4~6 d,当培养基颜色由红色变为橙黄色时,传代2次,然后扩大培养。
1.3.3 抗菌药原液的配制分别称取0.025 6 g截短侧耳素衍生物 1~18于10 mL容量瓶中,用N, N-二甲基甲酰胺溶解, 定容,使药物质量浓度均为2 560 μg·mL-1,同时按照相同的方法配制质量浓度为2 560 μg·mL-1的泰妙菌素作为对照,用0.22 μm滤膜过滤除菌,小管分装,-20 ℃保存备用。
1.3.4 化合物最小抑菌质量浓度的测定采用2倍稀释法每排双面板取无菌2 mL EP管15个,每个编号的衍生物对应1排双面板。在第1管中加入0.9 mL液体培养基,其余各管加入0.5 mL,取配好的药液0.1 mL加入第1管中充分混合后,取0.5 mL混合液加入第2管中,依此类推,最后吸出0.5 mL弃去,然后每管中加入106 CFU·mL-1的菌液0.5 mL,盖好盖子,得到化合物浓度依次2倍递减的15个液体培养基。另作空白对照,37 ℃条件下培养,观察鸡毒支原体的生长情况,以分析18种截短侧耳素衍生物的最小抑菌质量浓度(Minimum inhibitory concentration,MIC)。
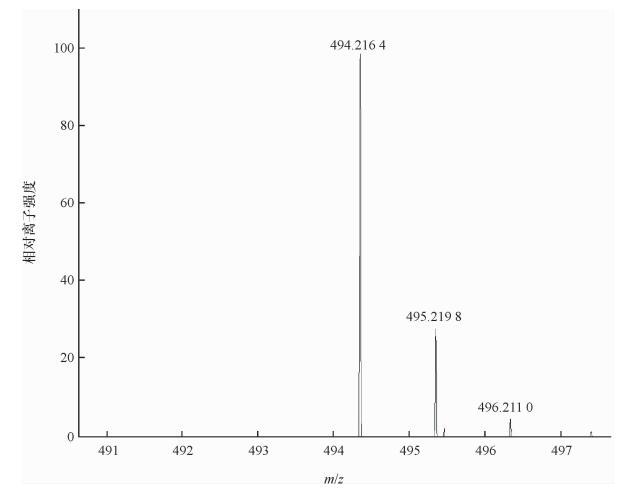
2 结果与分析 2.1 结构确认因合成路线、原料确定,部分化合物经过类似的合成路线进行合成,且已完成结构表征[12-13],本研究合成的18种截短侧耳素衍生物仅由高分辨质谱进行结构确证。以化合物18(C24H35N3O4S2)(图 2)为例,高分辨质谱分析表明其精确质量数理论值为494.214 2,所得化合物精确质量数实测值为494.216 4,表明合成所得产物为目标化合物。所有化合物精确质量数如表 1所示。
|
图 2 化合物18高分辨质谱图 Figure 2 High resolution mass spectrum of compound 18 |
|
|
表 1 18种衍生物精确质量数和18种衍生物及泰妙菌素对S6支原体MIC结果 Table 1 The MIC against Mycoplasma gallisepticum S6 strain and HR-MS of 18 pleuromutilin derivatives and Tiamulin |
用试管2倍稀释法,对18种截短侧耳素衍生物及泰妙菌素进行鸡毒支原体抑制活性评价,试验结果如表 1所示。
由表 1可知,化合物12、15及17对鸡毒支原体的MIC为0.125 0 μg·mL-1,化合物1、3、4、6、13及16对鸡毒支原体的MIC为0.250 0 μg·mL-1,化合物2、5、7~11及14对鸡毒支原体的MIC为0.500 0 μg·mL-1,化合物18与泰妙菌素对S6鸡毒支原体的MIC均为0.015 6 μg·mL-1。
3 讨论与结论截短侧耳素衍生物与细菌核糖体50s亚基相互作用发挥抑菌作用,其C14支链能影响该类化合物的抗菌活性[15]。本文结果显示,C14支链引入噻二唑片段的截短侧耳素衍生物18对鸡毒支原体抑制活性最强,与泰妙菌素相当。化合物18氨基被苯甲酰基化后所得化合物17活性减弱,可能因化合物17中苯甲酰基的吸电子作用降低了噻二唑环上酰胺氮原子电子云的密度,减弱了化合物17中C14支链与核糖体50s亚基中碱基的相互作用进而降低了化合物17的活性。而化合物1~11分子中的苯甲酰基上均有强吸电子基团(氟、氯、硝基及三氟甲基),与化合物17相比,分子中噻二唑及酰胺氮原子电子云
密度进一步降低,可能因此导致化合物1~11对鸡毒支原体的抑制活性均弱于化合物17。Shang等[13]研究表明在化合物17苯环上引入氨基能增强目标化合物对MRSA等的抑菌活性,鉴于氨基为给电子基团,我们分别在17苯环上引入甲基和甲氧基这2种给电子基团,以期增强目标化合物抑制鸡毒支原体活性,但所得化合物仅12及15与17抑菌活性相当。与甲基及甲氧基相比,氨基除了具有给电子效应外,还可能与核糖体上碱基存在强相互作用[12-13],故而使含氨基衍生物抑菌活性得以增强。本研究并未合成苯环具有氨基取代的衍生物,因而在发挥抗支原体活性时,氨基是否仍具有这一特点尚需在进一步的试验验证。
本研究在截短侧耳素C14支链上引入噻二唑片段,合成了18种截短侧耳素衍生物,研究了取代基团对衍生物抑制鸡毒支原体活性的影响。化合物18对支原体的抑菌活性最强,与泰妙菌素相当。Zhang等[16]研究表明化合物18以948.15 mg·kg-1剂量饲喂小鼠无明显急性毒性;以5 mg·kg-1剂量连续28 d饲喂小鼠无明显蓄积毒性,且其对MRSA感染小鼠的死亡保护率与泰妙菌素相当。以上研究结合本试验中化合物18对S6支原体的体外抑菌结果表明,化合物18有望作为兽医临床抗鸡毒支原体感染的候选药物进行进一步研发。此外,本文所得18种化合物S6支原体抑制活性的构效关系,可为C14支链含噻二唑截短侧耳素类衍生物的设计及后续研究提供依据。
| [1] |
冯元璋. 鸡毒支原体感染及危害[J]. 中国家禽, 2008, 15(12): 45-47. (  0) 0) |
| [2] |
陈凤梅, 牛钟相, 程光民, 等. 鸡毒支原体研究进展[J]. 动物医学进展, 2004, 25(3): 56-59. (  0) 0) |
| [3] |
纪新花, 王永强, 张新民. 鸡支原体病的特点及防控策略[J]. 养禽与禽病防治, 2010(9): 34-36. (  0) 0) |
| [4] |
贾志江, 刘娣琴, 杨红梅. 鸡毒支原体感染的流行病学分析及综合防制[J]. 畜牧兽医杂志, 2010, 29(3): 117-118. (  0) 0) |
| [5] |
KAVANAGH H R. Antibiotic substances from basidiomycetes: VIII: Pleurotus multilus (Fr.) Sacc. and Pleurotus passeckerianus Pilat[J]. P Natl Acad Sci USA, 1951, 37(9): 570-574. DOI:10.1073/pnas.37.9.570 (  0) 0) |
| [6] |
TANG Y Z, LIU Y H, CHEN J X. Pleuromutilin and its derivatives:The lead compounds for novel antibiotics[J]. Mini Rev Med Chem, 2012, 12(1): 53-61. DOI:10.2174/138955712798868968 (  0) 0) |
| [7] |
邹懿, 黄宇琪, 胡昌华. 截短侧耳素及其衍生物的研究进展[J]. 中国抗生素杂志, 2009, 34(2): 65-68. (  0) 0) |
| [8] |
SHANG R, WANG S, XU X, et al. Chemical synthesis and biological activities of novel pleuromutilin derivatives with substituted amino moiety[J]. PLoS One, 2013, 8(12): e82595. DOI:10.1371/journal.pone.0082595 (  0) 0) |
| [9] |
YI Y, YANG G, ZHANG C, et al. Synthesis and evaluation of novel pleuromutilin derivatives with a substituted pyrimidine moiety[J]. Eur J Med Chem, 2015, 101(13): 179-184. (  0) 0) |
| [10] |
LING Y, WANG X, WANG H, et al. Design, synthesis, and antibacterial activity of novel pleuromutilin derivatives bearing an amino thiazolyl ring[J]. Arch Pharm, 2012, 345(8): 638-646. DOI:10.1002/ardp.v345.8 (  0) 0) |
| [11] |
WANG X, LING Y, WANG H, et al. Novel pleuromutilin derivatives as antibacterial agents: Synthesis, biological evaluation and molecular docking studies[J]. Bioorg Med Chem Lett, 2012, 22(19): 6166-6172. DOI:10.1016/j.bmcl.2012.08.021 (  0) 0) |
| [12] |
SHANG R, PU X, XU X, et al. Synthesis and biological activities of novel pleuromutilin derivatives with a substituted thiadiazole moiety as potent drug-resistant bacteria inhibitors[J]. J Med Chem, 2014, 57(13): 5664-5678. DOI:10.1021/jm500374c (  0) 0) |
| [13] |
SHANG R, WANG G, XU X, et al. Synthesis and biological evaluation of new pleuromutilin derivatives as antibacterial agents[J]. Molecules, 2014, 19(11): 19050-19065. DOI:10.3390/molecules191119050 (  0) 0) |
| [14] |
王波, 李健, 汤有志, 等. 空间位阻对丁胺侧链取代截短侧耳素衍生物鸡毒支原体抑制活性的影响[J]. 中国畜牧兽医, 2012, 39(12): 101-103. DOI:10.3969/j.issn.1671-7236.2012.12.024 (  0) 0) |
| [15] |
DAVIDOVICH C, BASHAN A, AUERBACH-NEVO T, et al. Induced-fit tightens pleuromutilins binding to ribosomes and remote interactions enable their selectivity[J]. P Natl Acad Sci USA, 2007, 104(11): 4291-4296. DOI:10.1073/pnas.0700041104 (  0) 0) |
| [16] |
ZHANG C, YI Y, CHEN J, et al. In vivo efficacy and toxicity studies of a novel antibacterial agent: 14-O-[(2-amino-1,3,4-thiadiazol-5-yl)thioacetyl] mutilin[J]. Molecules, 2015, 20(4): 5299-5312. DOI:10.3390/molecules20045299 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38