作为土壤微生物功能多样性的重要承担者,酶在土壤物质循环和能量转化过程中起着重要的催化作用,其活性的高低反映土壤的各种生物化学反应的动力和强度,对土壤肥力的形成与提高、土壤生态系统循环具有重要的意义[1-2]。土壤脲酶、碱性磷酸酶和脱氢酶分别影响土壤尿素水解、氮磷循环、底物脱氢等重要过程,而过氧化氢酶和蔗糖酶则能够较好的表征土壤中有机质的转化水平。早在20世纪初,国内外学者就已经用土壤酶活性来判断外来物质对土壤的污染程度及可能对生态环境造成的影响[3-4]。Kalam等[5]研究指出丙环唑、丙溴磷、丙草胺3种农药可显著抑制土壤磷酸酶、脱氢酶和脲酶的活性;姜虎生等[6]研究表明乙草胺、丁酯、春多多、氟乐灵4种除草剂对土壤脱氢酶都有不同程度的抑制作用;傅丽君等[7]指出经杀灭菊酯和阿维菌素处理的土壤,磷酸酶活性变化呈现“抑制-恢复-激活”趋势。
二甲戊灵[N-1-乙基丙基-3, 4-二甲基-2, 6-二硝基苯胺]是一种高效低毒的二硝基苯胺类选择性芽前除草剂,其作用机制为抑制杂草分生组织细胞分裂和伸长,适用于棉花Gossypium spp.、大豆Glycine max L.、水稻Oryza sativa、玉米Zea mays、小麦Triticum aestivum Linn.及蔬菜作物马唐Digitaria sanguinalis L.、稗草Echinochloa crusgalli L.、狗尾草Setaria viridis L.、马齿苋Portulaca oleracea L.、灰藜Chenopodium album Linn.等一年生禾本科植物和阔叶杂草[8],是新疆应用最为广泛的除草剂之一[9]。国内外有关二甲戊灵的研究主要集中在田间应用、剂型改良及残留降解等方面[10-12],但对土壤酶活性影响的研究却较少涉及。因此,在前期室内试验的基础上[13],本研究探讨施用二甲戊灵后棉田土壤酶活性的变化,以期为二甲戊灵的合理使用及环境可持续发展提供理论依据。
1 材料与方法 1.1 材料试验在石河子大学试验站农田进行(44°18′N,86°02′E)。试验地土壤的有机质、全氮、速效磷、速效钾含量分别为29.15、1.56、43.50、140.58 g·kg-1。供试药剂为330 g·L-1的二甲戊灵EC(江苏丰山集团)。供试棉花Gossypium spp.品种为新陆早45号。
1.2 方法大田喷施二甲戊灵的浓度梯度为2 700、4 050、5 400 g·hm-2,每个处理3次重复,并设置未施用二甲戊灵的对照,采用随机区组设计,小区面积10 m×3 m。施药后0、1、5、10、15、20、30、40、60、90 d分别采集土壤深度0~5、5~10、10~15、15~20 cm土样,采用三点取样法,过2 mm筛,风干后置于-20 ℃保存待测。
酶活性的测定方法参考文献[14]。碱性磷酸酶活性采用磷酸苯二钠比色法测定;脲酶活性采用苯酚-次氯酸钠比色法测定;脱氢酶活性采用三苯基四氮唑蓝(TTC)比色法测定;蔗糖酶活性采用3, 5-二硝基水杨酸比色法测定;过氧化氢酶采用紫外分光光度法测定[15]。
1.3 数据处理采用软件SPSS 19.0和Excel进行数据整理和分析。酶活性激活率计算公式为:
| $激活率= \frac{{A - B}}{A} \times 100\% $ |
式中,A为处理土壤酶活性,B为未施用农药土壤酶活性。
2 结果与分析 2.1 对土壤碱性磷酸酶活性的影响施用二甲戊灵的棉田土壤,对碱性磷酸酶活性的影响总体表现为抑制。由图 1可知,二甲戊灵对0~5 cm土壤较其他土层对碱性磷酸酶激活作用强,抑制作用弱。二甲戊灵对5~10 cm土壤层碱性磷酸酶活性影响总体表现为抑制,药后40 d抑制作用最强,2 700、4 050、5 400 g·hm-2 3种处理对应的抑制率分别为93.79%、90.77%和87.43%;30和90 d时,抑制率减弱。二甲戊灵对10~15 cm土壤层碱性磷酸酶活性的影响,初期激活作用明显,后多为抑制,60 d时抑制作用开始下降。二甲戊灵对15~20 cm土壤层碱性磷酸酶活性的抑制作用持续期较长,药后40 d抑制作用开始下降。
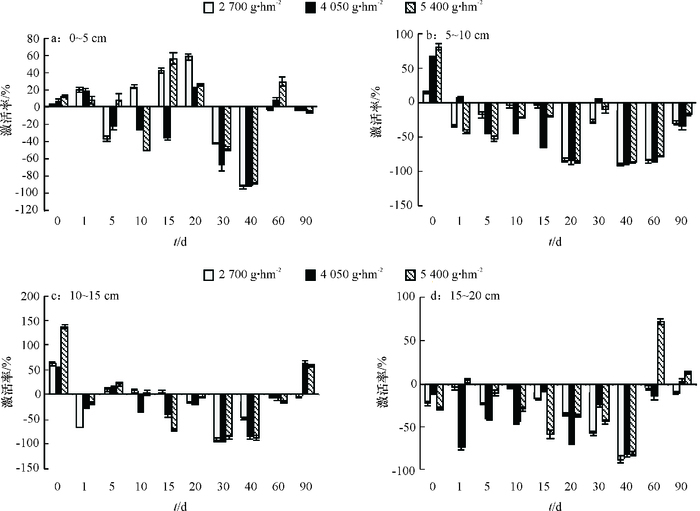
|
图 1 二甲戊灵对不同深度土壤磷酸酶活性的影响 Figure 1 Effects of pendimethalin on alkaline phosphase activity at different depth of soil |
二甲戊灵对0~5 cm土壤层脲酶的影响总体是激活作用,表现为浓度越高,激活作用越强。二甲戊灵对5~15 cm中层土壤脲酶激活作用较表层土壤(0~5 cm)弱,但持续期长达60 d。二甲戊灵对15~20 cm深层土壤脲酶活性前期影响较弱,药后10 d开始呈现激活状态,后一直整体保持激活状态(图 2)。
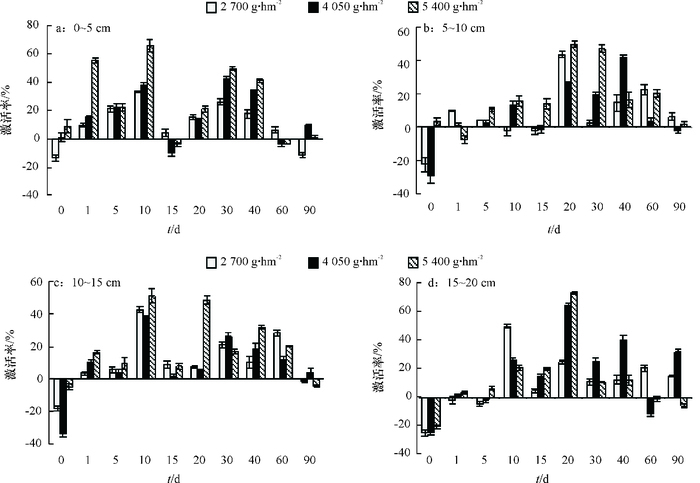
|
图 2 二甲戊灵对不同深度土壤脲酶活性的影响 Figure 2 Effects of pendimethalin on soil urease activity at different depth of soil |
施用二甲戊灵对棉田土壤蔗糖酶活性的影响见图 3,蔗糖酶活性多表现为激活作用。二甲戊灵对0~5 cm表层土壤蔗糖酶的影响,0 d时低浓度呈现抑制作用,1~40 d, 随浓度升高,激活作用增强,60~90 d,激活作用下降;二甲戊灵对10~15 cm深层土壤蔗糖酶活性表现为激活作用,0 d时2 700、4 050、5 400 g·hm-23种处理对应的激活率分别为3.80%、4.84%和17.65%,二甲戊灵处理后0~40 d 0~10 cm土壤层蔗糖酶激活率保持上升趋势,40 d时对土壤中蔗糖酶激活作用达最高,后激活率下降。二甲戊灵药后20 d对10~20 cm深层土壤蔗糖酶活性激活率达最高,其中,15~20 cm深层土壤二甲戊灵低浓度(2 700 g·hm-2)处理激活率最高,为72.90%。
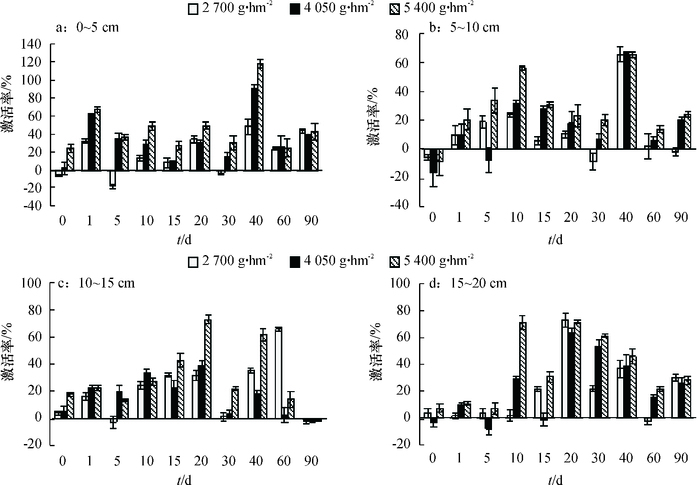
|
图 3 二甲戊灵对不同深度土壤蔗糖酶活性的影响 Figure 3 Effects of pendimethalin on soil invertase activity at different depth of soil |
二甲戊灵处理对棉田土壤脱氢酶活性的影响如图 4所示。0~5 cm土层土壤的脱氢酶活性随二甲戊灵浓度的增加而增强,最高激活率在药后5和10 d,高浓度(5 400 g·hm-2)处理对应的激活率分别为27.91%和26.91%。二甲戊灵对5~10 cm土层土壤脱氢酶活性的影响药后0~10 d表现为高浓度激活,低浓度抑制,药后15~90 d多表现为抑制作用。二甲戊灵对10~15 cm土层土壤脱氢酶活性影响总体是激活作用,在施药初期和末期,二甲戊灵浓度越高,激活作用越强,中期低浓度出现不同程度的抑制作用;二甲戊灵对15~20 cm深层土壤脱氢酶活性的影响,药后0~5 d,激活效果显著,最高激活率出现在药后5 d,2 700、4 050、5 400 g·hm-2 3种处理对应的激活率分别为11.81%、24.69%和27.90%,10 d后激活作用不明显,土壤脱氢酶活性被抑制。
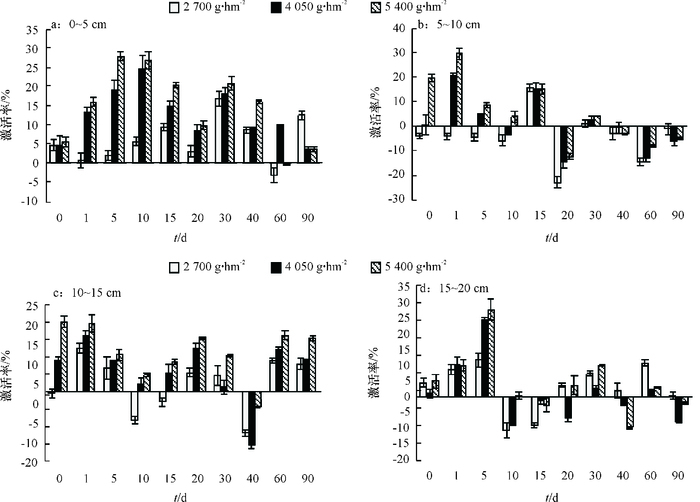
|
图 4 二甲戊灵对不同深度土壤脱氢酶活性的影响 Figure 4 Effects of pendimethalin on soil dehvdrogenase activity at different depth of soil |
二甲戊灵对棉田土壤过氧化氢酶活性的影响见图 5,施药前期,二甲戊灵对各土层过氧化氢酶活性影响不明显,后期出现不同程度的激活作用。二甲戊灵处理表层土壤(0~5 cm)1~30 d,低浓度二甲戊灵(2 700 g·hm-2)对土壤过氧化氢酶活性有一定的抑制作用,抑制率均较小,为1%左右,高浓度二甲戊灵对过氧化氢酶活性有轻微激活作用,激活率为2%~13%;相比较而言, 二甲戊灵对5~20 cm土壤过氧化氢酶活性影响发生在40~90 d,激活率在10%左右,90 d时激活作用加强,3种浓度二甲戊灵处理10~20 cm土层土壤过氧化氢酶激活率均大于10%。
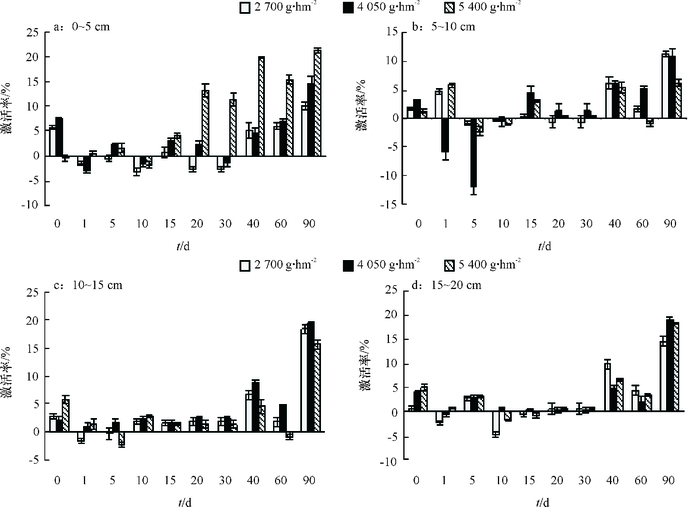
|
图 5 二甲戊灵对不同深度土壤过氧化氢酶活性的影响 Figure 5 Effects of pendimethalin on soil catalase activity at different depth of soil |
碱性磷酸酶是评价土壤磷素生物转化方向与强度的指标,能够促进有机磷化合物转化为植物可利用的无机磷酸,为植物生长提供有效磷素。呼蕾等[16]研究表明除草剂草甘膦完全抑制了土壤磷酸酶的活性。傅丽君等[17]研究也指出经杀菌剂甲基托布津和代森锰锌处理的土壤,磷酸酶活性受到明显抑制,这与本试验结果一致。本试验中,施用二甲戊灵的棉田土壤中磷酸酶活性总体呈下降趋势,除表层土壤外,抑制持续时间均较长。
脲酶是土壤中唯一对尿素在土壤中转化及利用有重大影响的酶,人们常用土壤的脲酶活性表征土壤的氮素状况[18]。本研究中二甲戊灵对土壤脲酶有激活作用,但早期有轻微的抑制作用,但抑制时间相对较短,分析原因可能是本试验条件下二甲戊灵的加入,为土壤微生物提供了碳源,从而激活了土壤的脲酶活性,缩短了抑制时间;也可能是因为土壤的理化性质不同造成的结果,研究结果显示,二甲戊灵处理0~5 cm土层对脲酶活性的激活程度最大,这与崔荟萍等[19]施用仲丁灵和使它隆对燕麦田土壤酶活性的研究结果一致。
脱氢酶是土壤中的主要酶类之一,脱氢酶能促进有机物脱氢,起着氢的中间传递体的作用[20]。二甲戊灵对脱氢酶有激活作用,且与浓度呈正相关。有研究证实土壤脱氢酶活性与土壤微生物量有密切关系[21]。这可能是因为初期微生物利用碳源生长导致的脱氢酶活性增加,之后随二甲戊灵逐渐降解,微生物生长受到抑制,土壤脱氢酶活性降低。
蔗糖酶广泛存在于土壤中,不仅能够表征土壤生物学活性强度,也可以作为评价土壤熟化程度和肥力的重要指标[22]。二甲戊灵对蔗糖酶活性有激活作用,对0~5 cm土壤蔗糖酶的激活作用最强,可能是该土层二甲戊灵被光和生物降解后作为酶反应的底物所致。同时,蔗糖酶又可将土壤中的蔗糖转化为葡萄糖,供微生物利用,从而增加了土壤中微生物的数量,增强了其生物活性。
土壤过氧化氢酶能酶促分解生物呼吸和有机物的氧化反应产生的过氧化氢,从而消除过氧化氢对土壤生物体的毒害作用[23],此外其活性还与土壤呼吸作用和土壤微生物活动息息相关。二甲戊灵对过氧化氢酶活性影响总体是激活作用,激活程度受土壤深度影响,处理前30 d内,土壤过氧化氢酶活性变化较小,表明过氧化氢酶对二甲戊灵并不敏感,这与荆瑞勇等[24]研究指出乙草胺处理60 d土壤过氧化氢酶活性变化较小的结果一致。
农药对土壤酶活性的影响与施用的土壤类型、土壤环境、气候条件、农药分子结构、农药用量及施用时间、研究方法以及取样时间等诸多因素有关[25]。因此,不同除草剂对土壤酶活性的影响存在着一定的差异。从本试验结果来看:1) 二甲戊灵施用后,土壤碱性磷酸酶活性受到抑制,且持续期较长;脲酶、蔗糖酶和脱氢酶活性受到不同程度的激活;过氧化氢酶活性总体变化不大。2) 由于不同土层微生物群落存在差异,二甲戊灵对酶活性的影响也不尽相同。其中,表层(0~5 cm)土壤对土壤酶活性反应更为敏感,与其他土层差异显著。3) 由于微生物的活动,酶活性被抑制是暂时的,本试验条件下3种浓度处理对其没有持续性影响,但并不表明长期施用二甲戊灵不会危害生态系统的安全,适宜的田间施用量和适当的施用频率是使用该除草剂的关键。今后,需进一步研究二甲戊灵长期胁迫下微生物、土壤酶、土壤生理生化等的变化,以期为安全施用二甲戊灵提供一定的技术支持和理论参考。
| [1] |
GIANFREDA L, RAO M A. Interactions between xenobiotics and microbial and enzymatic soil activity[J]. Crit Rev Env Sci Tec, 2008, 38(4): 269-310. DOI:10.1080/10643380701413526 (  0) 0) |
| [2] |
KOTROCZÓ Z, VERES Z, FEKETE I, et al. Soil enzyme activity in response to long-term organic matter manipulation[J]. Soil Biol Biochem, 2014, 70: 237-243. DOI:10.1016/j.sojlbio.2013.12.028 (  0) 0) |
| [3] |
EMILIO B, RAQUEL M, ROGELIO N. Estimating soilresilience to a toxic organic waste by measuring enzyme activities[J]. Soil Biol Biochem, 2004, 36(10): 1615-1623. DOI:10.1016/j.soilbio.2004.07.014 (  0) 0) |
| [4] |
JUNG J, PHILIPPOT L, PARK W. Metagenomic and functional analyses of the consequences of reduction of bacterial diversity on soil functions and bioremediation in diesel-contaminated microcosms[J]. Sci Rep, 2016(6): 23012. DOI:10.1038/srep23012 (  0) 0) |
| [5] |
KALAM A, TAH J, MUKHERJEE A K. Pesticide effects on microbial population and soil enzyme activities during vermicomposting of agricultural waste[J]. J Environ Biol, 2004, 25(2): 201-208. (  0) 0) |
| [6] |
姜虎生, 王宏燕. 除草剂对土壤脱氢酶活性及呼吸强度的影响[J]. 吉林农业科学, 2011, 36(5): 53-55. (  0) 0) |
| [7] |
傅丽君, 杨文金. 4种农药对枇杷园土壤磷酸酶活性及微生物呼吸的影响[J]. 中国生态农业学报, 2007, 15(6): 113-116. (  0) 0) |
| [8] |
SWARCEWICZ M K, GREGORCZYK A. The effects of pesticide mixtures on degradation of pendimethalin in soils[J]. Environ Monit Assess, 2012, 184(5): 3077-3084. DOI:10.1007/s10661-011-2172-x (  0) 0) |
| [9] |
梁友, 贾会娟, 董雪, 等. 4种土壤处理除草剂对龙葵的防除效果及安全性评价[J]. 江西农业大学学报, 2014, 36(1): 102-108. (  0) 0) |
| [10] |
王宇, 黄春艳, 黄元炬, 等. 除草剂在向日葵田除草效果及安全性试验[J]. 农学学报, 2014, 4(6): 20-23. DOI:10.11924/j.issn.1000-6850.2013-1132 (  0) 0) |
| [11] |
ZAIT Y, SEGEV D, SCHWEITZER A, et al. Development and employment of slow-release pendimethalin formulations for the reduction of root penetration into subsurface drippers[J]. J Agr Food Chem, 2015, 63(6): 1682-1688. DOI:10.1021/jf504839q (  0) 0) |
| [12] |
贾会娟, 金前, 梁友, 等. 高效液相色谱测定棉田不同土壤深度二甲戊灵残留量[J]. 石河子大学学报(自然科学版), 2015, 33(6): 689-693. (  0) 0) |
| [13] |
金前, 贾会娟, 李雪玲, 等. 二甲戊灵胁迫下的土壤酶活性变化[J]. 新疆农业科学, 2015, 52(5): 889-894. (  0) 0) |
| [14] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986, 1-327.
(  0) 0) |
| [15] |
杨兰芳, 曾巧, 李海波, 等. 紫外分光光度法测定土壤过氧化氢酶活性[J]. 土壤通报, 2011, 42(1): 207-210. (  0) 0) |
| [16] |
呼蕾, 和文祥, 王旭东, 等. 草甘膦的土壤酶效应研究[J]. 农业环境科学学报, 2009, 28(4): 680-685. (  0) 0) |
| [17] |
傅丽君, 赵士熙, 王海, 等. 4种农药对土壤微生物呼吸及过氧化氢酶活性的影响[J]. 福建农林大学学报(自然科学版), 2005, 34(4): 441-445. (  0) 0) |
| [18] |
郭明, 尹亚梅, 何良荣, 等. 农用化学物质对土壤脲酶活性的影响[J]. 农业环境保护, 2000, 19(2): 68-71. (  0) 0) |
| [19] |
崔荟萍, 赵桂琴, 刘欢. 除草剂对燕麦田土壤脲酶和碱性磷酸酶活性的影响[J]. 中国草地学报, 2014, 36(1): 37-43. (  0) 0) |
| [20] |
CYCON M, PIOTROWSKA S Z, KOZDRO J. Dehydrogenase activity as an indicator of different microbial responses to pesticide-treated soils[J]. Chem Ecol, 2010, 26(4): 243-250. DOI:10.1080/02757540.2010.495062 (  0) 0) |
| [21] |
ÁLVAREZ M A, HILTON S L, BENDING G D, et al. Changes in activity and structure of the soil microbial community after application of azoxystrobin or pirimicarb and an organic amendment to an agricultural soil[J]. Appl Soil Ecol, 2016, 106: 47-57. DOI:10.1016/j.apsoil.2016.05.005 (  0) 0) |
| [22] |
马彦霞, 郁继华, 张晶, 等. 设施蔬菜栽培茬口对生态型无土栽培基质性状变化的影响[J]. 生态学报, 2014, 34(14): 4071-4079. (  0) 0) |
| [23] |
张学鹏, 宁堂原, 杨燕, 等. 不同浓度石灰氮对黄瓜连作土壤微生物生物量及酶活性的影响[J]. 应用生态学报, 2015, 26(10): 3073-3082. (  0) 0) |
| [24] |
荆瑞勇, 王丽艳, 王彦杰, 等. 乙草胺对土壤微生物数量和酶活性的影响[J]. 中国生态农业学报, 2010, 18(6): 1302-1305. (  0) 0) |
| [25] |
林晓燕, 王玮, 赵宇华, 等. 苄嘧磺隆对淹水稻田土壤呼吸和酶活性的影响[J]. 浙江大学学报(农业与生命科学版), 2008, 34(1): 109-113. (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


