2. 广东省农业科学院果树研究所/农业部南亚热带果树生物学与遗传资源利用重点实验室,广东 广州 510640
2. Institute of Fruit Tree Research, Guangdong Academy of Agricultural Sciences/Key Laboratory of South Subtropical Fruit Biology and Genetic Resource Utilization, Ministry of Agriculture, Guangzhou 510640, China
细胞凋亡(Apoptosis)是一种特殊的细胞死亡方式,又称程序性细胞死亡(Programmed cell death, PCD),指为维持内环境稳定,由基因控制的细胞自主有序的主动死亡过程[1]。在形态学方面,细胞凋亡表现为细胞质浓缩、染色质聚集、核酸内切酶活化和出现凋亡小体等特征。发生过程包括凋亡的起始、凋亡小体形成和凋亡小体被邻近细胞吞噬并消化。通常情况下,细胞凋亡是为了维持各器官的稳定性,受机体内调控,当细胞凋亡调控失衡时,可引起细胞过度增殖或过度凋亡,导致细胞死亡和相关疾病的发生[2-3]。印楝素作为植物源农药的典型代表,被认为是最优秀的生物农药之一,最适合于商品化开发的植物源杀虫剂[4-6]。天然农药与化学生物学教育部重点实验室(华南农业大学)最早在国内开展了印楝素生物活性及作用机理的研究,经过几代人的努力取得了一定进展。在细胞水平陆续证实了印楝素能够抑制粉纹夜蛾Cabbage looper Hi-5、斜纹夜蛾Spodoptera litura SL-1、草地贪夜蛾Spdoptera frugiperda Sf9细胞增殖,影响细胞骨架正常功能,诱导细胞凋亡[7-11],并于2016年证实了印楝素A可通过PI3K/Akt/Tor信号通路诱导斜纹夜蛾卵巢细胞发生自噬性细胞死亡[12]。小菜蛾Plutella xyllostella是农业生产中的重要害虫,也是对印楝素最为敏感的害虫之一,但是,印楝素在小菜蛾细胞方面的相关性研究鲜见报道,其分子靶标至今不明[13-14],这严重地制约了印楝素的科学使用。本文以小菜蛾胚胎细胞为研究对象,探讨印楝素胁迫作用下对细胞增殖和凋亡的影响及可能的机制,以期获得印楝素抑制昆虫细胞增殖的分子机理,为印楝素的科学使用提供理论依据。
1 材料与方法 1.1 材料印楝素,由天然农药与化学生物学教育部重点实验室分离纯化,质量分数>95%;小菜蛾胚胎细胞系, 由福建农林大学馈赠。Cell Counting Kit-8(简称CCK-8试剂盒)、BCA蛋白浓度测定试剂盒、RIPA裂解液、PMSF、PI、DAPI、β-Tubulin鼠单克隆抗体、HRP标记羊抗兔IgG等购自碧云天生物技术公司;Grace’s昆虫细胞培养基购自Gibco公司;p-Drosophila Akt (Ser505) 抗体和裂解Caspase-3 (Asp175) 抗体购自Cell Signaling Technology公司。
1.2 方法 1.2.1 CCK-8方法检测细胞毒性CCK-8试剂盒是一种基于WST-8而广泛应用于细胞增殖和细胞毒性的快速、高灵敏度检测的试剂盒。WST-8是一种类似于MTT的化合物,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的甲臜化合物(Formazan)。细胞增殖越多越快,颜色越深;细胞毒性越大,则颜色越浅。对于同样的细胞,颜色的深浅和细胞数目呈线性关系。
于96孔板中加入对数生长期的小菜蛾胚胎细胞100 μL(细胞密度为5 000孔-1),培养48 h后弃培养基,加入含有印楝素分别为0.312 5、0.625、1.25、2.5、5、10、20和40 μg·mL-1细胞培养液,每个浓度设置4个复孔,对照含有φ为0.1% DMSO的培养液。培养24 h后每孔加入10 μL CCK-8溶液,空白对照的孔中加入相应量细胞培养液和CCK-8溶液但没有加入细胞。在细胞培养箱内继续孵育3 h,在450 nm测定光密度。
1.2.2 PI和DAPI染色镜检在激光共聚焦专用培养皿中加入1 mL含小菜蛾胚胎细胞的Grace’s昆虫细胞培养基和φ为10%胎牛血清培养细胞,48 h后弃培养液,加入含有不同浓度印楝素的细胞培养液,对照加入φ为0.1% DMSO的细胞培养液。24 h后,用无菌的PBS洗涤3次,每次10 min;加入1 mL 3.7 g·L-1甲醛固定细胞5 min,去除甲醛,PBS洗涤3次,每次10 min;然后分别加入少量PI和DAPI染色液,覆盖住样品即可,室温放置3~5 min。染色结束后用PBS清洗3次,每次10 min;使用激光共聚焦显微镜检测死亡细胞和凋亡小体,并进行统计分析。
1.2.3 Western-blotting分析在六孔板中每孔加入1 mL含小菜蛾胚胎细胞的昆虫培养基,待细胞密度达到90%时弃培养液,加入含有不同浓度印楝素的细胞培养液,对照加入含φ为0.1% DMSO的细胞培养液。24 h后收集细胞,加入150~250 μL裂解液RIPA(在使用前数分钟内加入PMSF,使PMSF的最终浓度为1 mmol·L-1),充分裂解后,10 000~14 000 r·min-1离心3~5 min,取上清液。采用BCA蛋白定量试剂盒对提取的细胞总蛋白进行定量,具体步骤参照试剂盒说明书。定量后的蛋白经SDS-PAGE电泳后进行转膜,用一抗4 ℃孵育过夜,缓慢摇动;洗膜后加入体积比1:1 000稀释度的辣根过氧化酶(HRP)标记的羊抗兔IgG作为二抗,室温孵育2 h;将膜用TBST洗涤3次,每次10 min。最后加入ECL发光液,利用化学发光仪进行显色。
1.2.4 统计分析利用SPSS19.0单向方差分析(SPSS, Chicago, USA),比较试验组与对照组平均数之间的差异,判断差异显著性。
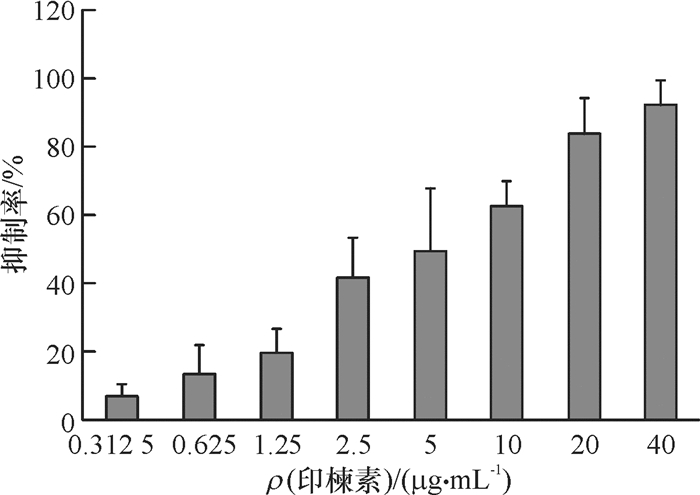
2 结果与分析 2.1 印楝素对小菜蛾胚胎细胞毒力的影响利用CCK-8法检测印楝素对小菜蛾胚胎细胞的抑制率,从结果(图 1)中可以看出,印楝素在较低浓度(0.625 μg·mL-1)时对小菜蛾胚胎细胞就表现出明显的抑制作用,处理浓度大于5 μg·mL-1时细胞抑制率高于50%,细胞抑制率随印楝素处理浓度增加呈上升趋势。印楝素处理小菜蛾胚胎细胞24 h后的抑制中浓度为4.4 μg·mL-1。
|
图 1 印楝素处理小菜蛾胚胎细胞24 h的细胞抑制率 Figure 1 The inhibitory rate of azadirachtin on Plutella xyllostella embryonic cells in 24 h after treatment |
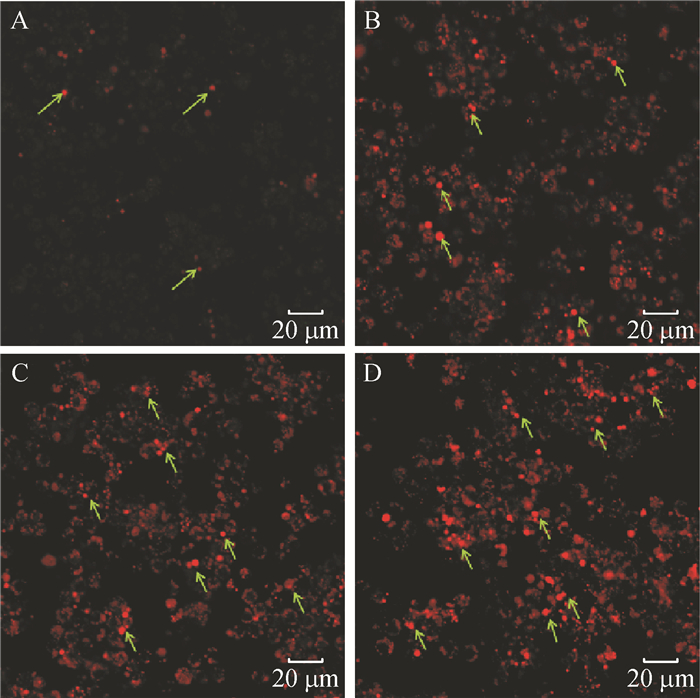
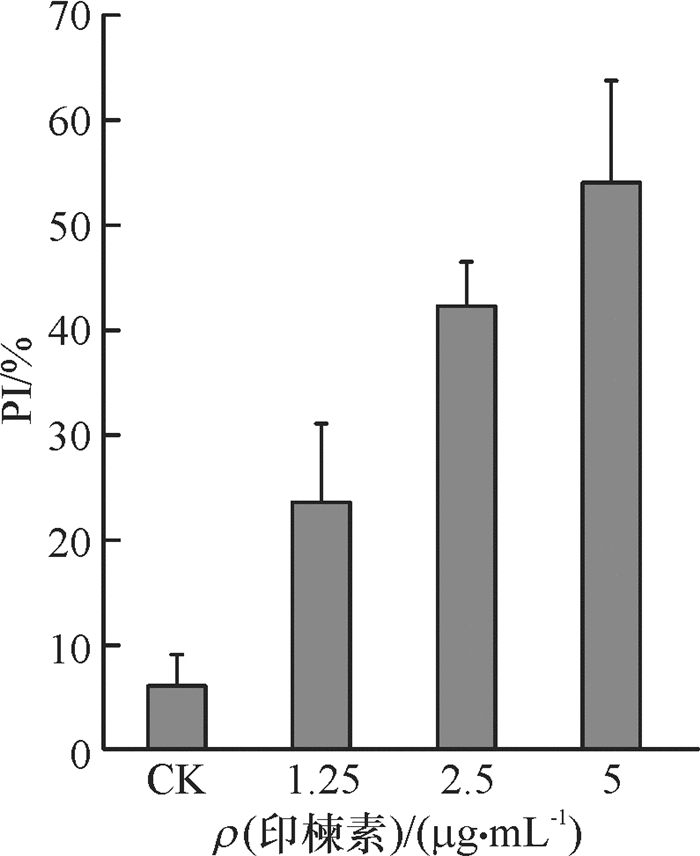
荧光染料PI(碘化丙啶)是一种可对DNA染色的细胞核染色试剂,PI不能通过活细胞膜,但却能穿过破损的细胞膜对细胞核染色。将不同浓度的印楝素处理细胞24 h后,利用激光共聚焦在激发波长为535 nm处进行检测并拍照。结果(图 2)表明,未经印楝素处理的细胞,由于生理状态下的正常损伤也有微量的细胞膜破损,PI染色后出现少量红色荧光;当1.25 μg·mL-1印楝素处理细胞24 h后细胞膜严重受损,出现了大量的红色荧光细胞。经Photoshop取色并计数统计,结果(图 3)表明,荧光强度随印楝素处理浓度的增加而增强。
|
图 2 印楝素处理小菜蛾胚胎细胞后的PI染色镜检结果 Figure 2 Microscopic examination of Plutella xyllostella embryonic cells stained with PI after treatment of azadirachtin A:未经处理的正常细胞(CK),B、C、D分别为:1.25、2.5、5 μg·mL-1印楝素处理24 h;箭头所指为死亡细胞。 |
|
图 3 不同浓度印楝素处理PI染色的细胞数与细胞总数百分比(PI) Figure 3 The percentage of PI staining cells in total cells after treated with different concentrations of azadirachtin |
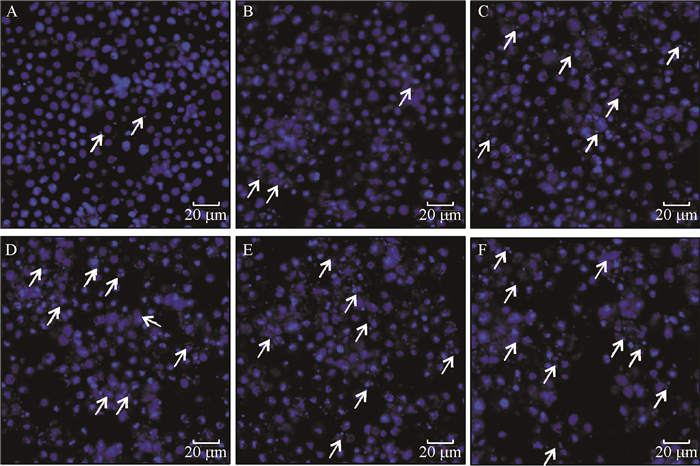
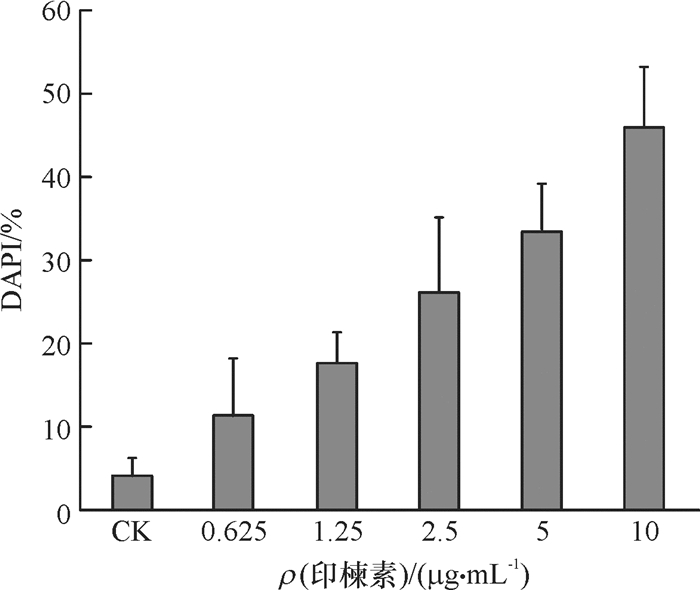
DAPI是一种可以穿透细胞膜的蓝色荧光染料,与双链DNA结合后产生比DAPI自身强20多倍的荧光。细胞凋亡的形态学特征之一是细胞核固缩,在局部区域发生核碎裂出现凋亡小体,通过DAPI染色在激光共聚焦显微镜下能够将致密浓染的凋亡小体与正常细胞核区别开,这一染色镜检技术已用于昆虫细胞凋亡的检测[15-16]。用不同浓度印楝素处理小菜蛾胚胎细胞24 h后对诱导细胞进行DAPI染色镜检,结果见图 4和图 5。在各组细胞中均出现核碎裂引起的凋亡小体。统计学结果表明,印楝素处理后24 h细胞中发生的凋亡小体率与处理浓度呈正相关。这一结果显示印楝素具有诱导小菜蛾胚胎的趋势,且在24 h内具有浓度依赖性。
|
图 4 印楝素诱导小菜蛾胚胎细胞的凋亡小体 Figure 4 Apototic bodies of Plutella xyllostella embryonic cells induced by azadirachtin A:未经处理的正常细胞(CK),B、C、D、E、F分别为: 0.625、1.25、2.5、5、10 μg·mL-1印楝素处理24 h;箭头表示细胞中被DAPI染色的凋亡小体。 |
|
图 5 凋亡小体发生率(统计样本中出现凋亡小体的点数与细胞总数之比,DAPI) Figure 5 Incidence rate of apoptotic bodies (percentage of apoptotic bodies in total cells, DAPI) |
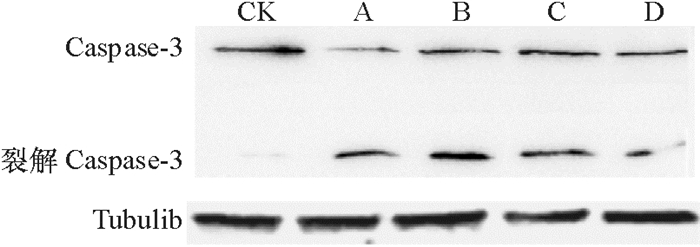
Caspase-3是细胞凋亡过程中最关键的执行分子(Key executioner)之一,可以剪切细胞凋亡过程中的许多关键蛋白,例如PARP。Caspase-3的激活需要将没有活性的全长Caspase-3(35 000) 在Asp 28和Ser 29之间以及Asp 175和Ser 176之间进行剪切,产生有活性的肽段。通过Western-blotting检测裂解Caspase-3的表达水平,结果(图 6)显示,经印楝素处理后出现明显杂交信号带。说明印楝素诱导小菜蛾胚胎细胞产生依赖于Caspase-3的Ⅰ型凋亡。
|
图 6 Western-blotting检测印楝素诱导小菜蛾胚胎细胞中裂解Caspase-3表达 Figure 6 Western-blotting results of cleaved Caspase-3 levels in Plutella xyllostella embryonic cells induced by azadirachtin CK:未经处理的正常细胞,A、B、C、D分别为:1.25、2.5、5、10 μg·mL-1印楝素处理24 h。 |
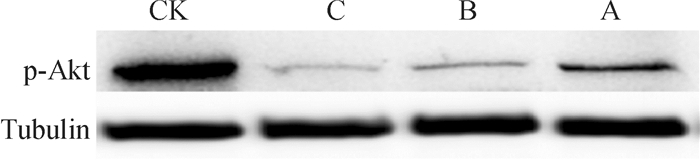
PI3K/Akt/Tor信号通路的主要成员有PI3K、Akt、Tor、p70S6K1、PTEN等。p-Akt是体内重要的磷酸化酶,下游的作用底物繁多,可以通过磷酸化直接或间接影响(激活或抑制)下游Tor、Bcl-2、GSK、Caspase、Tuberin、Foxo家族等,进而发挥其广泛而复杂的生理作用。图 7的结果显示,印楝素诱导小菜蛾胚胎细胞24 h后,p-Akt蛋白表达量与对照相比出现了明显的抑制。表明印楝素可通过抑制Akt信号通路的活化诱导小菜蛾胚胎细胞产生凋亡。
|
图 7 印楝素对Akt信号通路的影响 Figure 7 Effect of azadirachtin on Akt signal pathway CK:未经处理的正常细胞,A、B、C分别为:1.25、2.5、5 μg·mL-1印楝素处理24 h。 |
印楝素作为植物源农药的典型代表,对昆虫的生长发育表现出明显的抑制作用。早在1993年,Rembold和Annadurai曾报道印楝素可影响草地贪夜蛾Sf9卵巢细胞的增殖和蛋白合成。大量研究表明,印楝素可以导致昆虫细胞的增殖抑制,例如粉纹夜蛾Hi-5、斜纹夜蛾SL-1、草地贪夜蛾Sf9等[7-12]。本文采用CCK-8方法证实了印楝素可抑制小菜蛾胚胎细胞的增殖。PI荧光探针可以作为晚期凋亡细胞和死亡细胞的指示剂,不同浓度的印楝素处理细胞24 h后,经PI染色后的细胞荧光强度随印楝素处理浓度的增加而增强。
早期研究表明,印楝素可以诱导P53蛋白参与的细胞周期阻滞和线粒体介导的细胞凋亡[10]。在草地夜蛾Sf9细胞中印楝素可通过诱导溶酶体释放组织蛋白酶从而导致细胞凋亡[11]。本文通过DAPI染色镜检凋亡小体,研究了印楝素诱导小菜蛾胚胎细胞的凋亡发生情况,结果发现凋亡随印楝素处理浓度增加而增强。Caspase-3蛋白是细胞凋亡过程中最关键的执行分子之一,Caspase-3的激活需要将没有活性的全长Caspase-3在Asp 28和Ser 29之间以及Asp 175和Ser 176之间进行剪切,产生有活性的17 000肽段[17]。Caspase-3的激活常被作为细胞凋亡的一个重要指标。在本文中可以清晰地观察到剪切型Caspase-3,表明印楝素诱导的细胞凋亡是依赖于Caspase-3的Ⅰ型凋亡。
Akt蛋白具有丝-苏氨酸激酶活性,参与细胞周期调控等重要作用。Akt可使Caspase-9的Ser 196位点磷酸化而失活、阻止线粒体中细胞色素C的释放,从而发挥抗细胞凋亡的作用[18-22]。Shao等[12]前期研究证实了印楝素A可通过抑制p-Akt而诱导斜纹夜蛾卵巢细胞发生自噬。本文研究发现印楝素诱导小菜蛾胚胎细胞24 h后,p-Akt蛋白表达量与对照相比出现了明显的抑制。表明印楝素可通过抑制Akt信号通路的活化诱导小菜蛾胚胎细胞凋亡。
本文以小菜蛾胚胎细胞为研究对象,探讨了印楝素对小菜蛾胚胎细胞增殖的影响,结果表明,印楝素对小菜蛾胚胎细胞的增殖有明显的抑制作用,并通过抑制Akt信号通路的活化诱导细胞产生依赖于Caspase-3的Ⅰ型凋亡,揭示了印楝素抑制小菜蛾胚胎细胞增殖的分子机理,为印楝素的科学使用提供理论依据。
| [1] |
张晓晖, 姚天明, 黄高昇, 等. 细胞凋亡的最新研究进展[J]. 第四军医大学学报, 2002, 23(12): 42-44. (  0) 0) |
| [2] |
NEZHA F, COHEN C, RAHAMAN J, et al. Comparative immunohistochemical studies of bcl-2 and P53 proteins in benign and malignant ovarian endometriotic cysts[J]. Cancer, 2002, 94(11): 2935-2940. DOI:10.1002/(ISSN)1097-0142 (  0) 0) |
| [3] |
NASU K, NISHIDA M, KAWANO Y, et al. Aberrant expression of apoptosis-related molecules in endometriosis: A possible mechanism underlying the pathogenesis of endometriosis[J]. Rerrod Sci, 2011, 18(3): 206-218. DOI:10.1177/1933719110392059 (  0) 0) |
| [4] |
IMMARAJU J A. The commercial use of azadirachtin and its integration into viable pest control programmes[J]. Pestic Sci, 2015, 54(3): 285-289. (  0) 0) |
| [5] |
VASSILIOU V A. Botanical insecticides in controlling Kelly's citrus thrips (Thysanoptera: Thripidae) on organic grapefruits[J]. J Econ Entomol, 2011, 104(6): 1979-1985. DOI:10.1603/EC11105 (  0) 0) |
| [6] |
SRIVASTAVA S, SRIVASTAVA A K. In vitro azadirachtin production by hairy root cultivation of azadirachta indica in nutrient mist bioreactor[J]. Appl Biochem Biotech, 2012, 166(2): 365-378. DOI:10.1007/s12010-011-9430-9 (  0) 0) |
| [7] |
李文欧, 徐汉虹, 张志祥, 等. 印楝素对粉纹夜蛾Hi-5细胞的毒性机理[J]. 昆虫学报, 2008, 51(8): 824-829. (  0) 0) |
| [8] |
钟国华, 水克娟, 吕朝军, 等. 印楝素对SL1的细胞凋亡诱导作用[J]. 昆虫学报, 2008, 51(6): 618-627. (  0) 0) |
| [9] |
程杏安, 黄劲飞, 胡美英, 等. 印楝素诱导Sf9细胞凋亡的显微和超微形态变化[J]. 华南农业大学学报, 2010, 31(4): 52-58. (  0) 0) |
| [10] |
HUANG J F, SHUI K J, LI H Y, et al. Antiproliferative effect of azadirachtin on Spodoptera litura Sl-1 cell line through cell cycle arrest and apoptosis induced by up-regulation of p53[J]. Pestic Biochem Phys, 2011, 99(1): 16-24. DOI:10.1016/j.pestbp.2010.08.002 (  0) 0) |
| [11] |
WANG Z, CHENG X G, MENG Q Q, et al. Azadirachtin-induced apoptosis involves lysosomal membrane permeabilization and cathepsin L release in Spodoptera frugiperda Sf9 cells[J]. Int J Biochem Cell B, 2015, 64: 126-135. DOI:10.1016/j.biocel.2015.03.018 (  0) 0) |
| [12] |
SHAO X H, LAI D, ZHANG L, et al. Induction of autophagy and apoptosis via PI3K/AKT/TOR pathways by azadirachtin A in Spodoptera litura cells[J]. Sci Rep-UK, 2016, 6: 35482. DOI:10.1038/srep35482 (  0) 0) |
| [13] |
FISHEL F M. IRAC's insecticide mode of action classification[M]. Florida: Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida, 2008, 1-5.
(  0) 0) |
| [14] |
WANG H, LAI D, YUAN M, et al. Growth inhibition and differences in protein profiles in azadirachtin-treated Drosophila larvae[J]. Electrophoresis, 2014, 35(8): 1122-1129. DOI:10.1002/elps.v35.8 (  0) 0) |
| [15] |
WEI W, GAI Z, AI H, et al. Baculovirus infection triggers a shift from amino acid starvation-induced autophagy to apoptosis[J]. PLoS One, 2012, 7(5): e37457. DOI:10.1371/journal.pone.0037457 (  0) 0) |
| [16] |
WU F, LI Y, WANG F, et al. Differential function of the two Atg4 homologues in the aggrephagy pathway in Caenorhabditis elegans[J]. J Biol Chem, 2012, 287(35): 29457-29467. DOI:10.1074/jbc.M112.365676 (  0) 0) |
| [17] |
李小明, 孙志贤. 细胞凋亡中的关键蛋白酶Caspase-3[J]. 医学分子生物学杂志, 1999, 1: 6-9. (  0) 0) |
| [18] |
ROSEN N, SHE Q B. Akt and cancer is it all mTOR?[J]. Cancer Cell, 2006, 10(4): 254-256. DOI:10.1016/j.ccr.2006.10.001 (  0) 0) |
| [19] |
XIN M G, DENG X M. Nicotine inactivation of the proapoptotic function of bax through phosphorylation[J]. J Biol Chem, 2005, 280(11): 10781-10789. DOI:10.1074/jbc.M500084200 (  0) 0) |
| [20] |
SONG G, OUYANG G L, BAO S D. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005, 9(1): 59-71. DOI:10.1111/jcmm.2005.9.issue-1 (  0) 0) |
| [21] |
GIBSON E M, HENSON K S, HANEY N, et al. Epidermal growth factor protects epithelial-derived cells from tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis by inhibiting cytochrome c release[J]. Cancer Res, 2002, 62(2): 488-496. (  0) 0) |
| [22] |
KIM E C, YUN B S, RYOO I J, et al. Complestatin prevents apoptotic cell death: Inhibition of a mitochondrial caspase pathway through AKT/PKB activation[J]. Biochem Bioph Res Co, 2004, 313(1): 193-204. DOI:10.1016/j.bbrc.2003.11.104 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


