2. 广东省农业科学院 果树研究所/农业部南亚热带果树生物学与遗传资源利用重点实验室,广东 广州 510640
2. Institute of Fruit Tree Research, Guangdong Academy of Agricultural Sciences/Key Laboratory of South Subtropical Fruit Biology and Genetic Resource Utilization, Ministry of Agriculture, Guangzhou 510640, China
香蕉枯萎病又称巴拿马病,是由尖孢镰刀菌古巴专化型Fusarium oxysporum f. sp. cubense侵染香蕉所引起的毁灭性土传真菌病害,是全球香蕉生产中危害最严重的病害[1-2]。目前防治香蕉枯萎病的措施主要有轮作、选育抗病品种、化学防治和生物防治等。但是,香蕉抗病品种育种周期长,短期内难以见效;至今也未研发出特效或高效的化学药剂,常规杀菌剂防治效果不理想,长期使用还将引起农药残留、环境污染、病原菌抗药性等问题[3-4]。生物防治作为一种生态安全的防治措施,在香蕉枯萎病防治中越来越受到重视。
施肥防病是最新发展起来的前沿技术,它改变了传统的生物防治方法,为香蕉枯萎病的防治提供了一种新的途径[4-6]。生物药肥具有肥料和杀虫或杀菌双重功效,不仅可以有效减轻病虫害、大幅减少化学农药的使用,还能解决一些化学农药难以解决的问题,对有效利用资源、保护生态环境、发展可持续农业具有重要的现实意义。已有报道将生物有机肥与生防菌(如木霉菌、枯草芽胞杆菌、胶质芽胞杆菌和巨大芽胞杆菌等)混合使用可以有效降低香蕉枯萎病的发病率[4, 7-11]。但大多数研究只是将腐熟的有机肥和生防菌简单混合使用,鲜见以植物有机物为生防菌培养基质和吸附载体制备生物药肥的报道。
印楝渣是杀虫植物印楝Azadirachta indica的种仁提取印楝素后的副产品,因其利用率低而被丢弃。但印楝渣仍含有少量具有杀虫、抑菌作用的活性成分,而且还含有大量有机质和微量元素等营养成分以及纤维,可用作生防菌的培养基原料和吸附载体。本研究将耐药生防菌与印楝渣混合发酵,制备印楝渣生物药肥,应用到接种香蕉枯萎病菌的土壤中,探讨其对香蕉生长和香蕉枯萎病防治的影响,旨在为印楝渣资源化利用以及印楝渣生物药肥在香蕉枯萎病生物防治的田间应用提供技术支撑和实践依据。
1 材料与方法 1.1 材料解淀粉芽孢杆菌Bacillus amyloliquefaciens HN-11从印楝根际土壤中分离并鉴定,保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏号CGMCC NO:8421)。香蕉枯萎病病原菌尖孢镰刀菌古巴专化型4号生理小种(Fusarium oxysopoyum f.sp. cubence Race 4,Foc4) 由华南农业大学农学院植物病理系姜子德教授提供;携带绿色荧光蛋白GFP标记的尖孢镰刀菌古巴专化型4号生理小种(Foc4-GFP)由广东省农业科学院果树研究所李春雨博士提供。印楝渣为印楝种仁提取印楝素后的副产品,颗粒状,粒径为1~2 mm。巴西蕉Musa acuminata AAA Cavendish cv.Brazil营养杯组培苗由广东省农业科学院果树研究所香蕉组培苗中心提供。供试土壤采自华南农业大学农场,砂壤土,有机质、全氮、全磷、全钾质量分数分别为20.50、1.12、0.45和25.4 g·kg-1,土壤风干灭菌后备用。
PDA培养基:马铃薯200.0 g,蔗糖20.0 g,琼脂18.0 g,蒸馏水1 000 mL。NA培养基:蛋白胨10.0 g,牛肉膏3.0 g,氯化钠5.0 g,琼脂15.0 g,蒸馏水1 000 mL。Landy培养基:葡萄糖20.0 g,L-谷氨酸钠5.0 g,MgSO40.5 g,KCl 0.5 g,KH2PO41.0 g,CuSO40.16×10-3 g,FeSO4 0.15×10-3 g,MnSO4 5.0×10-3 g,蒸馏水1 000 mL。CDM培养基:NaNO3 3.0 g,K2HPO4 1.0 g,MgSO4 0.5 g,KCl 0.5 g,FeSO4 0.01 g,蔗糖30.0 g,琼脂15.0 g,蒸馏水1 000 mL。液体基础培养基:KH2PO4 1.0 g,(NH4)2SO4 5.0 g,NaCl 0.1 g,MgSO4·7H2O 0.5 g,CaCl2 0.1 g,酵母膏0.2 g,蒸馏水1 000 mL,pH 7.0。印楝渣固体培养基:印楝渣95%(w),添加麦麸5%(w)增加通透性。
1.2 生防菌对香蕉枯萎病菌的抑制作用 1.2.1 平板对峙法在PDA培养基平板中心位置一侧2 cm处接种直径为5 mm的香蕉枯萎病菌菌饼,在另一侧对称处接种一环经活化的生防菌HN-11,以不接种生防菌为对照,28 ℃倒置黑暗培养5 d,观察生防菌HN-11对病原菌菌丝生长的抑制作用。
1.2.2 抑菌圈法将生防菌HN-11在NA培养基上活化,分别挑取一环接种于含50 mL NA培养基、Landy培养基和CDM培养基的250 mL三角瓶中,28 ℃条件下180 r·min-1振荡培养2 d。培养液离心后经0.22 μm滤膜过滤,得无菌发酵液。将香蕉枯萎病菌Foc4在PDA平板上活化,培养7 d后,用无菌水冲洗菌丝制得Foc4孢子液;吸取1 mL孢子悬浮液(孢子数为1×107 cfu·mL-1),加入到融化并冷却到45 ℃左右的PDA培养基中,混匀,倒平板。待培养基凝固后,将牛津杯依次放置于培养基上,取100 μL无菌发酵液加入牛津杯中,以无菌水作空白对照。置于28 ℃培养2 d,以抑菌圈大小判断生防菌HN-11对病原菌Foc4的抑菌活性。
1.3 生防菌与印楝渣的相容性测定 1.3.1 印楝渣提取液的抑菌作用取印楝渣10 g,分别加入甲醇、乙酸乙酯和蒸馏水各10 mL,混匀后置于黑暗中浸提2 d,离心取上清液,经0.22 μm无菌过滤器过滤除菌后,根据抑菌圈法测定印楝渣的甲醇、乙酸乙酯和水提取液对解淀粉芽孢杆菌HN-11生长的影响,以提取溶剂作为对照。以是否产生抑菌圈来判断其对生防菌是否有抑菌活性。
1.3.2 生防菌的生长测定挑取解淀粉芽孢杆菌HN-11单菌落接种至NA液体培养基中,以180 r·min-1于28 ℃摇瓶中培养24 h,得种子液。将种子液按2%体积比接入以印楝渣(8.0 g)为唯一碳源的液体基础培养基中,对照分别以葡萄糖(8.0 g)、可溶性淀粉(8.0 g)或玉米粉(8.0 g)作为唯一碳源;分别置于摇瓶中,180 r·min-1,28 ℃条件下培养。48 h后分别取1 mL发酵菌液,测定各组的D600 nm,判断HN-11菌株生长能否以印楝渣为唯一碳源。
1.4 抑菌机理研究 1.4.1 土壤培养法测定抑菌效果试验设置3个处理:添加印楝渣(6.0 g),接种香蕉枯萎病菌Foc4-GFP(5 mL);添加生防菌株HN-11(5 mL),接种香蕉枯萎病菌Foc4-GFP(5 mL);对照只接种香蕉枯萎病菌Foc4-GFP(5 mL),不添加印楝渣和生防菌株HN-11。
称取24.0 g灭菌土壤,按照试验处理分别添加印楝渣或生防菌,然后接种5 mL携带绿色荧光蛋白GFP标记的香蕉枯萎病菌Foc4-GFP(孢子浓度为4×107 cfu·mL-1),再加入无菌水4 mL,混匀后置于培养皿中28 ℃条件下黑暗培养2 d。每处理分别取1.0 g样品,加入10 mL无菌水,摇匀,吸取10 μL上清液滴于载玻片上,荧光显微镜观察病原菌孢子的萌发情况,拍照,并统计相同放大倍数下3个不同视野中的孢子数。
1.4.2 生防菌对病原菌菌丝形态结构的影响处理和对照菌丝取自平板对峙法样品,挑取离生防菌最近的病原菌菌丝,分别加入φ为3%的戊二醛溶液固定24 h,用0.1 mol·mL-1磷酸缓冲液(pH 7.2) 漂洗3次,用w为1%的锇酸溶液固定1.5 h,磷酸缓冲液再漂洗3次;用φ为30%、50%、75%和90%的乙醇溶液顺序脱水各1次,每次10 min;然后以φ为50%、70%、90%和100%的乙酸异戊酯溶液分别漂洗2 min。将菌丝置于铜网上干燥,离子溅射喷金后,扫描电镜观察并采集图像。
1.5 印楝渣生物药肥的制备及对香蕉生长和香蕉枯萎病的影响 1.5.1 印楝渣生物药肥的制备将生防菌HN-11种子液按体积比1%接种量,接入含2 L液体NA培养基的5 L三角瓶中,28 ℃条件下180 r·min-1振荡培养2 d。将所得发酵液按150 mL·kg-1的量接种到印楝渣固体培养基中,混匀后培成梯形堆体,置于室温发酵腐熟。发酵过程中,根据需要补充水分,保持湿度40%~45%,堆体温度过高时进行翻堆处理。发酵至堆体不再产热结束,适当喷洒HN-11发酵液使印楝渣生物药肥中生防菌的含量大于2×108 cfu·g-1。
1.5.2 对香蕉生长的影响试验设置3个处理:添加5%(w)生物药肥;添加10%(w)印楝渣生物药肥;不添加生物药肥(对照)。每处理按土质量比将生物药肥与风干土(10 kg)混匀,装入塑料盆。挑选大小一致香蕉苗(5~6片叶),每盆移栽1株,每5盆1组,每组为1个重复,共重复3次。常规浇水管理,60 d后调查香蕉苗生长情况,分别测量鲜质量、干质量、株高和茎粗。
1.5.3 对香蕉枯萎病的防治试验设置4个处理:添加5%(w)印楝渣生物药肥,接种Foc4;添加10%(w)印楝渣生物药肥,接种Foc4;不加生物药肥,接种Foc4(阳性对照);不加生物药肥,也不接种Foc4(空白对照)。每处理按土质量比将生物药肥与风干土(10 kg)混匀,装入塑料盆。每盆移栽大小一致的香蕉苗(5~6片叶)1株,每5盆1组,每组为1个重复,共重复3次。待香蕉移栽定植7 d后,除空白对照外,其余处理采用伤根浇入法接种,每盆浇灌Foc4孢子悬浮液(孢子数为1×106 cfu·mL-1)10 mL。常规浇水管理,病原菌接种30 d后调查香蕉苗发病情况,并拍照。
1.6 数据处理试验所得数据经Excel 2007和SPSS 13.0软件进行处理及分析。
香蕉枯萎病病情分级标准参照张志红等[8]的方法;病情指数和防病效果的计算参考许志刚[12]的方法:
病情指数=∑(各级发病数×该级代表数)/总数×最高级代表值×100,
防病率=(对照病情指数-处理病情指数)/对照病情指数×100%。
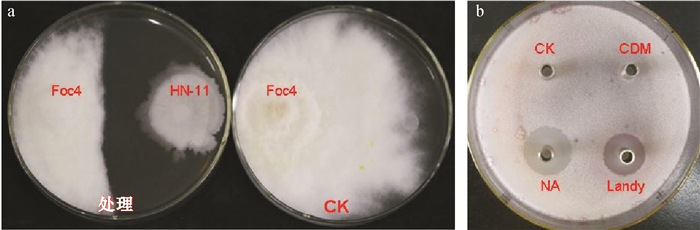
2 结果与分析 2.1 生防菌HN-11对香蕉枯萎病菌的抑制作用平板对峙试验结果(图 1a)表明,生防菌解淀粉芽孢杆菌HN-11对香蕉枯萎病菌Foc4有明显的拮抗活性,能有效抑制香蕉枯萎病Foc4的菌丝生长,抑菌率为72.1%。牛津杯法试验结果(图 1b)显示,以NA和Landy为培养基时,HN-11菌株的发酵液对Foc4病原菌产生明显的抑菌圈,其中NA培养基发酵液的抑菌圈最大;以察氏培养基CDM发酵时,不能产生抑菌圈。这表明以硝酸钠为唯一碳源的CDM培养基不利于生防菌HN-11产生抑菌活性物质;NA培养基是生防菌HN-11最佳的培养基,有利于生防菌发酵产生抑菌活性物质。
|
图 1 解淀粉芽孢杆菌HN-11对香蕉枯萎病菌的抑制效果 Figure 1 Inhibition effect of Bacillus amyloliquefaciens HN-11 against banana fusarium wilt pathogen a:平板对峙试验;b:牛津杯法试验。 |
生防菌HN-11在以印楝渣为唯一碳源的培养基中生长时,培养48 h后,发酵液D600 nm达到0.766,与葡萄糖相当(0.745),但比可溶性淀粉(0.823) 低,比玉米粉(0.583) 高。此外,印楝渣的甲醇、乙酸乙酯和水提取液均没有对生防菌解淀粉芽孢杆菌HN-11产生抑菌圈。以上结果表明,解淀粉芽孢杆菌HN-11与印楝渣具有良好的相容性,可以在以印楝渣作为唯一碳源的培养基中生长。因此,本研究以印楝渣作为生防菌HN-11的培养基和吸附载体制备印楝渣生物药肥。
2.3 印楝渣生物药肥对香蕉生长的促进作用印楝渣生物药肥对香蕉生长的影响见图 2,印楝渣未经发酵腐熟直接施用会对香蕉产生药害(图 2a),而发酵腐熟制备的印楝渣生物药肥对香蕉没有产生药害现象(图 2b)。当印楝渣生物药肥的施用量(w)为5%和10%时,2个月后处理组香蕉的长势均好于对照。

|
图 2 印楝渣生物药肥对香蕉生长的影响 Figure 2 Effect of neem bioorganic fertilizer on banana growth a:施用未经发酵腐熟的印楝渣处理;b:施用发酵腐熟的印楝渣生物药肥; CK:不添加生物药肥,A、B、C分别为添加生物药肥(w)5%、10%和15%。 |
表 1为印楝渣生物药肥对香蕉形态指标的影响。由表 1可知,2个处理组香蕉的鲜质量、干质量、株高和茎粗均有不同程度的提高,与对照的差异达到显著水平;但施用量(w)为5%和10%时,两处理组间的差异不显著。以上结果表明,印楝渣通过与生防菌HN-11发酵腐熟施用可以避免对香蕉产生药害,并且制成的印楝渣生物药肥能够明显地促进香蕉生长。
|
|
表 1 印楝渣生物药肥对香蕉形态指标的影响1) Table 1 Effects of neem bioorganic fertilizer on banana morphological indexes |
图 3为施用印楝渣生物药肥对香蕉枯萎病的影响。在不施用印楝渣生物药肥和不接种香蕉枯萎病Foc4病原菌情况下(图 3D),香蕉正常生长,没有枯萎现象,病情指数为0。接种Foc4病原菌而不施用印楝渣生物药肥时(图 3C),30 d后该对照组香蕉大部分表现出枯萎症状,病情指数达到了90%。当接种Foc4病原菌并施用w为5%和10%印楝渣生物药肥(图 3B、3A)时,30 d后这2个处理组香蕉大部分植株保持旺盛长势,仅少数植株的叶缘出现轻微枯黄现象,病情指数分别为20和25,与对照组差异显著。统计分析表明,施用w为5%和10%印楝渣生物药肥对香蕉枯萎病的防病效果分别达到72.2%和77.8%。以上结果表明,印楝渣生物药肥可以有效控制香蕉枯萎病的发生。

|
图 3 印楝渣生物药肥对香蕉枯萎病的防治效果 Figure 3 Control efficiency of neem bioorganic fertilizer against banana fusarium wilt A:10%(w)生物药肥+Foc4;B:5%(w)生物药肥+Foc4;C:阳性对照(Foc4);D:空白对照。 |
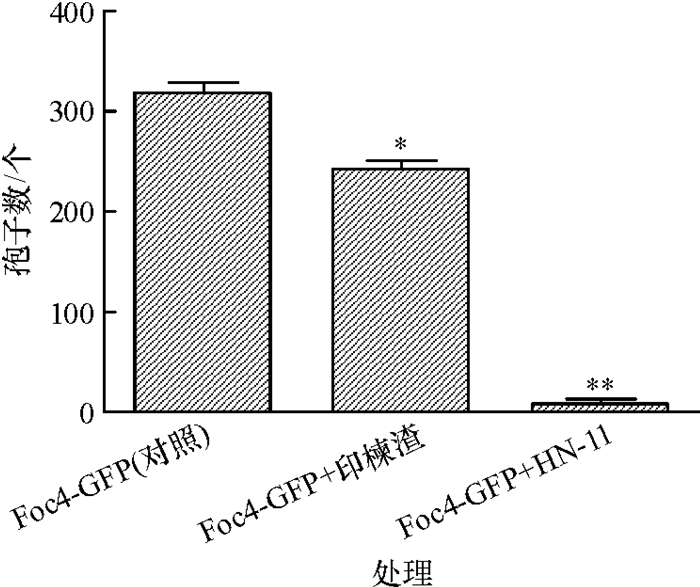
与对照(图 4a)相比,添加印楝渣(图 4b)和生防菌株HN-11(图 4c)均能降低土壤中香蕉枯萎病菌的孢子数,生防菌HN-11的作用最明显,与对照的差异极显著(图 5)。这表明印楝渣生物药肥中的印楝渣和生防菌HN-11成分均对香蕉枯萎病菌起到抑制作用,其中生防菌HN-11是最主要的抑菌成分。

|
图 4 印楝渣和生防菌株HN-11对香蕉枯萎病菌孢子的影响 Figure 4 Effects of neem cake and biocontrol strain HN-11 on Fusarium oxysporum Foc4 spores |
|
图 5 印楝渣和生防菌株HN-11处理后的香蕉枯萎病菌孢子数 Figure 5 Number of Fusarium oxysporum Foc4 spores after treating by neem cake and biocontrol strain HN-11 *、**分别表示处理与对照在0.05、0.01水平差异显著(Duncan’s法)。 |
进一步通过扫描电镜观察生防菌HN-11处理前后香蕉枯萎病菌菌丝形态结构的变化,结果见图 6。从图 6可以看出,对照组香蕉枯萎病菌菌丝表面光滑完整(图 6a),而经生防菌HN-11作用后,香蕉枯萎病菌菌丝表面粗糙,出现不规则皱褶,部分菌丝断裂、凹陷(图 6b)。

|
图 6 生防菌株HN-11对香蕉枯萎病菌菌丝形态结构的影响 Figure 6 Effects of biocontrol strain HN-11 on the morphological structure of Fusarium oxysporum Foc4 hyphae |
土壤中香蕉枯萎病病原菌是引起香蕉枯萎病害的主要因素,而土壤中生防菌的含量是影响防病效果的关键因素[8, 13]。在香蕉枯萎病的生物防治上,生防菌如果没有一个合适的载体进入土壤后很难存活,因此单一或少数生防菌的施用难以达到有效的防治效果[14];将生防菌与充分腐熟的有机肥混合使用的防治效果较好[3-5, 9]。生防菌在有机肥协助下形成的“基质-菌群”生态系统有利于调节土壤的微生态环境。改变香蕉根际土壤微生物的生态特征和物理化学特性,从而起到防病、抑病作用[8, 14]。
本研究将印楝渣作为生防菌株HN-11的培养基进行发酵腐熟,制成印楝渣生物药肥使用,印楝渣不仅为生防菌株HN-11提供养分,还作为其吸附载体,保证其发挥作用,这与生防菌HN-11和印楝渣具有良好相容性有关,并且该生防菌可以在以印楝渣为唯一碳源的培养基中生长繁殖。印楝渣生物药肥的盆栽试验结果表明,印楝渣生物药肥不仅可以促进香蕉的生长,而且可以显著降低香蕉植株枯萎病的发病程度。施用w为5%和10%的印楝渣生物药肥处理组的病情指数比对照明显降低,这可能是由于印楝渣生物药肥中所含的生防菌解淀粉芽孢杆菌HN-11在香蕉根际定殖后,对病原菌孢子萌发起到良好的抑制作用,破坏菌丝形态结构,保护香蕉根系免受病原菌侵入,起到防病作用,这与Yuan等[9]的研究结果相似。
有研究表明,印楝渣还含有少量的抑菌活性物质,对鹰嘴豆Gicer arietinum Linn.等植物的病害也有一定防治效果[15-17]。本试验也表明印楝渣对香蕉枯萎病菌起到一定的抑制作用,但是效果不如生防菌解淀粉芽孢杆菌HN-11明显,这说明生防菌HN-11是印楝渣生物药肥的主要药效成分,而印楝渣主要为生防菌繁殖以及香蕉生长提供营养物质,起到载体和肥效作用。印楝渣对香蕉生长的试验结果表明,未经发酵腐熟直接施用高剂量印楝渣(w大于5%)会引起香蕉伤苗、叶片枯黄、抑制香蕉生长。这可能是由未腐熟的印楝渣施入土壤后,发酵耗糖争氮,产生有毒物质引起的。赵欢欢等[18]研究也表明,植物废弃物(如茶枯)未经腐熟直接大量使用,不仅会减少香蕉结果率和果梳个数,而且使香蕉更易感染香蕉枯萎病和死亡。本研究将生防菌株HN-11添加到印楝渣中,既加快了印楝渣的腐熟进程,又克服了其直接使用会对植物造成伤苗的难题,还可起到防治香蕉枯萎病的作用。
印楝渣作为杀虫植物的农副产品,资源较为丰富,与生防菌发酵制备生物药肥,使之合理使用,一方面可以变废为宝,避免资源浪费;另一方面可为香蕉枯萎病的生物防治提供技术支持。
| [1] |
WU Y L, YI G J, PENG X X, et al. Systemic acquired resistance in Cavendish banana induced by infection with an incompatible strain of Fusarium oxysporum f. sp. cubense[J]. J Plant Physiol, 2013, 170(11): 1039-1046. DOI:10.1016/j.jplph.2013.02.011 (  0) 0) |
| [2] |
杨江舟, 张静, 胡伟, 等. 韭菜根系浸提液对香蕉枯萎病和土壤微生物生态的影响[J]. 华南农业大学学报, 2012, 33(4): 480-487. (  0) 0) |
| [3] |
张志红, 李华兴, 韦翔华, 等. 生物肥料对香蕉枯萎病及土壤微生物的影响[J]. 生态环境, 2008, 17(6): 2421-2425. (  0) 0) |
| [4] |
匡石滋, 李春雨, 田世尧, 等. 药肥两用生物有机肥对香蕉枯萎病的防治及其机理初探[J]. 中国生物防治学报, 2013, 29(3): 417-423. (  0) 0) |
| [5] |
肖相政, 刘可星, 廖宗文. 生物有机肥对番茄青枯病的防效研究及机理初探[J]. 农业环境科学学报, 2009, 28(11): 2368-2373. DOI:10.3321/j.issn:1672-2043.2009.11.028 (  0) 0) |
| [6] |
ZHANG S S, RAZA W, YANG X M, et al. Control of fusarium wilt disease of cucumber plants with the application of a bioorganic fertilizer[J]. Biol Fertil Soils, 2008, 44: 1073-1080. DOI:10.1007/s00374-008-0296-0 (  0) 0) |
| [7] |
何欣, 郝文雅, 杨兴明, 等. 生物有机肥对香蕉植株的生长和香蕉枯萎病防治的研究[J]. 植物营养与肥料学报, 2010, 16(4): 978-985. DOI:10.11674/zwyf.2010.0430 (  0) 0) |
| [8] |
张志红, 冯宏, 肖相政, 等. 生物肥防治香蕉枯萎病及对土壤微生物多样性的影响[J]. 果树学报, 2010, 27(4): 575-579. (  0) 0) |
| [9] |
YUAN J, RUAN Y Z, WANG B B, et al. Plant growth-promoting rhizobacteria strain Bacillus amyloliquefaciens NJN-6-enriched bio-organic fertilizer suppressed fusarium wilt and promoted the growth of banana plants[J]. J Agric Food Chem, 2013, 61(16): 3774-3780. DOI:10.1021/jf400038z (  0) 0) |
| [10] |
FU L, RUAN Y Z, TAO C Y, et al. Continous application of bioorganic fertilizer induced resilient culturable bacteria community associated with banana fusarium wilt suppression[J]. Sci Rep, 2016, 6: 27731. DOI:10.1038/srep27731 (  0) 0) |
| [11] |
李国良, 姚丽贤, 杨苞梅, 等. 有机肥与生防菌结合防治香蕉枯萎病的初步研究[J]. 中国土壤与肥料, 2012(2): 67-72. (  0) 0) |
| [12] |
许志刚. 普通植物病理学[M]. 北京: 中国农业出版社, 2002, 236-262.
(  0) 0) |
| [13] |
SARAVANAN T, MUTHUSAMY M, MARIMUTHU T. Effect of Pseudomonas fluorescens on Fusarium wilt pathogen in banana rhizosphere[J]. J Biol Sci, 2004, 4(2): 192-198. DOI:10.3923/jbs.2004.192.198 (  0) 0) |
| [14] |
蔡燕飞, 廖宗文, 章家恩, 等. 生态有机肥对番茄青枯病及土壤微生物多样性的影响[J]. 应用生态学报, 2003, 14(3): 349-353. (  0) 0) |
| [15] |
SINGH U P, SINGH H B, SINGH R B. The fungicidal effect of neam (Azadirachta indica) extract on some soil borne pathogen of gram (Cicer arietinum)[J]. Mycologia, 1980, 72(6): 1077-1093. DOI:10.2307/3759561 (  0) 0) |
| [16] |
SARAVANAN T, MUTHUSAMY M, MATIMUTHU T. Development of integrated approach to manage the fusarial wilt of banana[J]. Crop Prot, 2003, 22(9): 1117-1123. DOI:10.1016/S0261-2194(03)00146-7 (  0) 0) |
| [17] |
KUMAR D, SINGH K P, JAISWAL R K. Effect of fertilizers and neem cake amendment in soil on spore germination of Arthrobotrys dactyloides[J]. Mycobiology, 2005, 33(4): 194-199. DOI:10.4489/MYCO.2005.33.4.194 (  0) 0) |
| [18] |
赵欢欢, 叶仲辉, 杨文杰, 等. 茶枯对香蕉生长和香蕉枯萎病的影响[J]. 西南大学学报(自然科学版), 2015, 37(9): 25-30. (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


